Баета Лонг – новый агонист рецепторов глюкагоноподобного пептида 1
- Аннотация
- Статья
- Ссылки
- English
Результаты международных контролируемых многоцентровых исследований агониста рецепторов ГПП-1 эксенатида продемонстрировали его высокую эффективность и безопасность у больных СД 2 типа с избыточной массой тела и ожирением. Клинически значимым является и то, что терапия эксенатидом не приводит к развитию выраженных гипогликемий, поскольку эффекты ГПП-1 зависят от уровня глюкозы в крови.
Несмотря на высокую эффективность эксенатида в отношении достижения целевых показателей углеводного обмена, снижения аппетита и массы тела, приверженность лечению пациентов остается невысокой. В целях увеличения приверженности терапии разработан препарат эксенатида с режимом применения один раз в неделю. Это первый зарегистрированный в мире агонист рецепторов ГПП-1 пролонгированного действия. Более 18 000 пациентов приняли участие в клинических исследованиях данного препарата.
В июне 2011 г. препарат эксенатид пролонгированного действия одобрен Европейским медицинским агентством под торговым наименованием Bydureon, в 2012 г. – Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США под тем же наименованием. В марте 2017 г. этот препарат одобрен и зарегистрирован Минздравом России под торговым наименованием Баета Лонг.
Результаты международных контролируемых многоцентровых исследований агониста рецепторов ГПП-1 эксенатида продемонстрировали его высокую эффективность и безопасность у больных СД 2 типа с избыточной массой тела и ожирением. Клинически значимым является и то, что терапия эксенатидом не приводит к развитию выраженных гипогликемий, поскольку эффекты ГПП-1 зависят от уровня глюкозы в крови.
Несмотря на высокую эффективность эксенатида в отношении достижения целевых показателей углеводного обмена, снижения аппетита и массы тела, приверженность лечению пациентов остается невысокой. В целях увеличения приверженности терапии разработан препарат эксенатида с режимом применения один раз в неделю. Это первый зарегистрированный в мире агонист рецепторов ГПП-1 пролонгированного действия. Более 18 000 пациентов приняли участие в клинических исследованиях данного препарата.
В июне 2011 г. препарат эксенатид пролонгированного действия одобрен Европейским медицинским агентством под торговым наименованием Bydureon, в 2012 г. – Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США под тем же наименованием. В марте 2017 г. этот препарат одобрен и зарегистрирован Минздравом России под торговым наименованием Баета Лонг.

Гомеостаз глюкозы в организме в течение суток регулируется многочисленными эндокринными и нейрорегуляторными механизмами. Ведущая роль принадлежит гормонам поджелудочной железы (инсулину, глюкагону), инкретинам и автономной нервной системе [1].
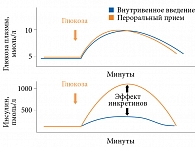
Значимость сигналов желудочно-кишечного тракта в гормональной регуляции гомеостаза глюкозы подтверждает эффект инкретинов (рис. 1) [2]. Установлено, что после перорального приема глюкозы наблюдается более выраженное увеличение секреции инсулина, чем после внутривенной ее инфузии, сопровождающейся аналогичным повышением гликемии. Это обусловлено высвобождением инкретинов в разных отделах пищеварительного тракта в ответ на пероральную нагрузку.
Инкретины относятся к семейству гормонов, стимулирующих секрецию инсулина в ответ на прием пищи. До 70% постпрандиальной секреции инсулина у здоровых лиц объясняется именно эффектом инкретинов. Последний значительно снижен при СД 2 типа и нарушении толерантности к глюкозе.
Наиболее важными инкретинами признаны глюкозозависимый инсулинотропный полипептид (ГИП), известный как желудочный ингибиторный полипептид, и глюкагоноподобный пептид 1 (ГПП-1).
Глюкозозависимый инсулинотропный полипептид
ГИП принадлежит к семейству пептидов «глюкагон – секретин».
Гормон секретируют K-клетки слизистой оболочки двенадцатиперстной кишки и проксимальной части тонкой кишки. Секреция полипептида стимулируется углеводами и жирами. В ответ на прием пищи его концентрация в плазме крови, как правило, повышается в 10–20 раз [3].
Глюкагоноподобный пептид 1
ГПП-1 принадлежит к суперсемейству пептидных гормонов «глюкагон – секретин», объединенных схожестью аминокислотной последовательности с аминокислотной последовательностью глюкагона на 21–48%. Несмотря на то что эти пептиды образуются из проглюкагона, они по-разному влияют на основные метаболические процессы.
В L-клетках (преимущественно представлены в подвздошной и толстой кишках) проглюкагон расщепляется не с образованием глюкагона, как в бета-клетках, а с отсоединением от С-конца ГПП-1 и ГПП-2. Эти пептиды практически на 50% гомологичны глюкагону.
ГПП-1 имеет короткий период полураспада – от 60 до 90 секунд. Именно поэтому он очень быстро метаболизируется и инактивируется дипептидилпептидазой 4 (ДПП-4). Таким образом, вероятность, что действие ГПП-1 передастся через сенсорные нейроны в кишечнике и печени, экспрессирующие ГПП-1 рецептор, повышается. В связи с этим важно различать измерения интактного гормона (ответственного за эндокринные действия) и сумму интактного гормона и его метаболитов, отражающую полную секрецию L-клеток и, следовательно, возможные нейронные действия.
Доказано, что снижение секреции ГПП-1 может способствовать развитию ожирения [4].
Физиологические эффекты глюкагоноподобного пептида 1
Физиологические эффекты ГПП-1 реализуются после взаимодействия со специфическими рецепторами, которые экспрессируются во многих органах и тканях, включая поджелудочную железу, желудок, тонкую кишку, мозг, гипофиз, легкие, почки, сердце.
Основной орган-мишень ГПП-1 – островки Лангерганса. Инсулинотропная активность ГПП-1, которая зависит от уровня глюкозы в крови, реализуется через взаимодействие со специфическими рецепторами, расположенными на мембране бета-клетки. Необходимо отметить, что ГПП-1 активирует ген глюкокиназы и ген, кодирующий глюкозный транспортер 2-го типа, которые ответственны за внутриклеточный механизм секреции инсулина. Инфузия ГПП-1 приводит к снижению концентрации глюкозы в крови. Как только ее уровень приближается к нормальным значениям, влияние ГПП-1 на секрецию инсулина прекращается [5]. Это имеет важное клиническое значение – ГПП-1 не может вызывать выраженную гипогликемию.
ГПП-1 способствует адекватному секреторному ответу бета-клеток на глюкозу.
Существует обратная зависимость между секрецией ГПП-1 в ответ на прием пищи и ростом инсулинорезистентности.
Еще один важный эффект ГПП-1 – влияние на секрецию глюкагона. Пептид подавляет секрецию глюкагона альфа-клетками поджелудочной железы. При этом данный эффект также обусловлен уровнем глюкозы в крови.
Таким образом, ГПП-1 регулирует концентрацию глюкозы плазмы через модулирование секреции как инсулина, так и глюкагона. Он необходим для поддержания нормальной толерантности к глюкозе и адекватной постпрандиальной секреции инсулина.
На данный момент известны следующие эффекты ГПП-1:
- потенцирует глюкозозависимую секрецию инсулина;
- усиливает биосинтез инсулина;
- повышает экспрессию гена инсулина;
- повышает экспрессию генов, важных для функционирования бета-клеток поджелудочной железы (глюкокиназы, глюкозного транспортера 2-го типа и др.);
- оказывает митотическое действие на бета-клетки и способствует дифференцировке клеток-предшественников протоков;
- подавляет апоптоз бета-клеток;
- подавляет секрецию глюкагона.
Кроме того, ГПП-1 связывается с рецепторами в мозге и стимулирует парасимпатические нервы, что приводит к замедлению опорожнения желудка, снижению желудочной (стимулированной пентагастрином и пищей) и панкреатической секреции. Как следствие, уменьшается экскурсия глюкозы в постпрандиальном периоде [6].
Согласно последним данным, ГПП-1 является сильным анорексигенным гормоном (его действие аналогично действию лептина) и антагонистом орексигенных гормонов, таких как нейропептид гамма и кортиколиберин. Действуя через центральные механизмы, он регулирует пищевое поведение и способствует развитию чувства насыщения [7].
Инкретины в терапии сахарного диабета 2 типа
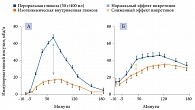
При СД 2 типа отмечается дефицит инкретинов (рис. 2) [8], поэтому усиление инкреторного эффекта можно считать новым принципом в лечении диабета.
Установлено, что введение ГПП-1 пациентам с СД 2 типа способствует нормализации чувствительности бета-клеток поджелудочной железы к глюкозе, а также частичному восстановлению первой фазы секреции инсулина и полному восстановлению второй фазы в условиях гипергликемического клэмп-теста.
В настоящее время препаратами, влияющими на модуляцию активности и уровень ГПП-1, являются аналоги и миметики ГПП-1 (экcенатид, лираглутид, CJC-1131). Наиболее изученный препарат этой группы – эксенатид [9, 10].
Экcенатид (Баета) – миметик ГПП-1, синтетическая форма эксендина 4.
Эксендин 4 – пептид, выделенный из слюнных желез ящерицы семейства ядозубов (лат. Heloderma suspectum), на 53% гомологичный с человеческим ГПП-1.
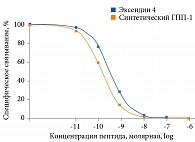
В условиях in vitro синтетический ГПП-1 продемонстрировал такую же способность связываться с рецептором ГПП-1, что и эксендин 4, что особенно важно для эффективной постпрандиальной стимуляции секреции инсулина (рис. 3) [11].
Из-за особенностей аминокислотной последовательности (глицин во второй позиции) синтезированный препарат в отличие от ГПП-1 устойчив к ДПП-4 [12–14].
Опыт применения препарата Баета в России насчитывает 11 лет. За эти годы получено достаточное количество данных о высокой эффективности и безопасности такой терапии у больных СД 2 типа.
Подкожное введение препарата Баета позволяет достичь метаболического контроля, увеличить чувствительность клеток к инсулину, уменьшить аппетит, массу тела, уровень глюкагона и свободных жирных кислот [7].
Несмотря на высокую эффективность эксенатида в отношении достижения целевых показателей углеводного обмена, регулирования аппетита и снижения массы тела, приверженность пациентов лечению остается невысокой.
Один из способов повышения приверженности лечению – снижение кратности приема препарата, тем более инъекционного. Так, в исследовании G. Derosa и соавт. (2017) таковая достоверно увеличилась при переводе пациентов с метформина быстрого высвобождения на метформин медленного высвобождения. Режим применения первого – два-три раза в день, второго – один раз в сутки [15].
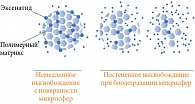
Для создания пролонгированной формы эксенатида была разработана уникальная система доставки – с помощью микросфер Medisorb. Микросферы состоят из полимера D,L-молочной и гликолевой кислот с биодеградируемым полимером, распадающимся до воды и углекислого газа (рис. 4) [16–19].
Эксенатид пролонгированного действия позволяет уменьшить кратность применения до одного раза в неделю.
Более 18 000 пациентов приняли участие в клинических исследованиях эксенатида пролонгированного действия [20].
В июне 2011 г. препарат одобрен к применению Европейским медицинским агентством и получил торговое наименование Bydureon, в 2012 г. под тем же наименованием одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США. Минздравом России он был одобрен и зарегистрирован под торговым наименованием Баета Лонг в марте 2017 г.
На данный момент клинический опыт применения эксенатида пролонгированного действия насчитывает семь лет.
Минимально эффективная концентрация составляет 50 пг/мл и достигается на второй неделе терапии эксенатидом в дозе 2 мг. Такая концентрация способна оказывать влияние на тощаковую гликемию [18].
Чтобы оценить возможность назначения эксенатида пролонгированного действия в дозе 2 мг пациентам с СД 2 типа на разных этапах его развития, была инициирована программа клинических исследований DURATION. Длительность терапии составила 24–30 недель, после чего следовал период наблюдения.
Первичной конечной точкой исследования стала динамика уровня гликированного гемоглобина (HbA1c), вторичными – изменение массы тела, артериального давления, маркеров сердечно-сосудистого риска, безопасность и переносимость.
В исследование включали пациентов с уровнем HbA1c от 7,1 до 11,0%.
В качестве препаратов сравнения использовали препарат Баета, ситаглиптин, пиоглитазон, лираглутид, инсулин гларгин.
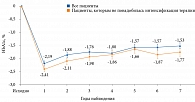
На фоне терапии препаратом Баета Лонг отмечено стойкое снижение значений HbA1c – в течение семи лет (рис. 5). При этом 53% пациентов не потребовалось интенсификации терапии [21].
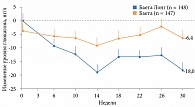
DURATION-1 – международное многоцентровое рандомизированное открытое исследование эффективности и безопасности препарата Баета Лонг и эксенатида короткого действия, применявшихся в дополнение к пероральным сахароснижающим препаратам. Это уникальное по длительности исследование агонистов рецепторов ГПП-1.
Пациенты с СД 2 типа были рандомизированы на две группы в зависимости от вида терапии: применявшие эксенатид короткого действия 10 мкг два раза в сутки и эксенатид пролонгированного действия 2 мг один раз в неделю. Через 30 недель терапии получавшие эксенатид короткого действия были переведены на эксенатид пролонгированного действия. 148 человек составили группу эксенатида 2 мг/нед, 147 человек – группу эксенатида 10 мкг два раза в день. 30-недельное наблюдение завершили 129 получавших препарат Баета Лонг и 130 применявших препарат Баета. Первый препарат превзошел второй в отношении контроля уровня глюкозы плазмы натощак, глюкагона и HbA1c (рис. 6 и 7) [19]. Эксенатид короткого действия оказывал лучшее влияние на постпрандиальную гликемию.
В группе пациентов, получавших эксенатид короткого действия и перешедших на препарат Баета Лонг, отмечалось дальнейшее снижение HbA1c, и в течение пяти лет наблюдения 88% больных не потребовалось назначения базального инсулина [22].
Кроме того, у пациентов, которым не потребовалось интенсификации сахароснижающей терапии, за семь лет наблюдения зафиксировано снижение массы тела на 6,45 кг (p < 0,05) [19].
Многие пациенты с СД 2 типа не достигают целевых значений на терапии пероральными сахароснижающими препаратами. Средний период времени до интенсификации терапии у получающих один, два или три пероральных сахароснижающих препарата составляет около семи лет. Установлено, что у пациентов с HbA1c > 7% в течение двух лет после установления диагноза при отсрочке интенсификации терапии на год риск развития сердечно-сосудистых заболеваний значимо выше, чем у пациентов с HbA1c < 7% [23].
Наиболее частая опция для интенсификации терапии – базальный инсулин. Однако барьером для его назначения являются риск развития гипогликемических состояний и увеличение массы тела.
Проведено трехлетнее открытое рандомизированное контролируемое исследование DURATION-3, в котором сравнивалась терапия эксенатидом пролонгированного действия и инсулином гларгин [24].
В 26-недельное исследование включено 456 пациентов с СД 2 типа в возрасте старше 18 лет с неадекватным гликемическим контролем на фоне монотерапии метформином или комбинированной терапии метформином и производными сульфонилмочевины не менее трех месяцев.
Критериями включения в исследование стали уровень HbA1c от 7,1 до 11,0%, индекс массы тела от 25 до 45 кг/м², стабильная масса тела три месяца и более, прием метформина ≥ 1500 мг не менее восьми недель до скрининга.
В зависимости от способа интенсификации терапии участники исследования были рандомизированы на две группы: группа Баета Лонг 2 мг/нед и группа инсулина гларгин в стартовой дозе 10 Ед с титрацией до целевых значений гликемии натощак от 4,0 до 5,5 ммоль/л.
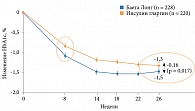
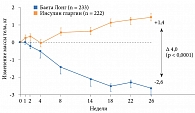
Терапия препаратом Баета Лонг ассоциировалась с достоверным снижением уровня HbA1c по сравнению с терапией инсулином гларгин (рис. 8). В группе Баета Лонг по сравнению с группой инсулина гларгин значимо больше пациентов достигли целевых значений HbA1c: < 7,0% – 60 и 48% (p < 0,01), < 6,5% – 35 и 23% соответственно. В группе Баета Лонг также отмечались менее выраженные подъемы постпрандиальной гликемии в течение суток. Преимуществом терапии препаратом Баета Лонг оказалось достоверное снижение массы тела (рис. 9). У получавших инсулин гларгин указанный показатель увеличился. По окончании 26 недель было принято решение продлить исследование DURATION-3 еще на три года.
Через три года в группе Баета Лонг по сравнению с группой инсулина гларгин зафиксировано значимое снижение HbA1c (p = 0,03). В группе Баета Лонг также отмечались менее выраженные подъемы постпрандиальной гликемии в течение суток (р = 0,001) и достоверно меньшие значения гликемии после завтрака и ужина (р = 0,033).
Терапия препаратом Баета Лонг сопровождалась более низкой частотой гипогликемий по сравнению с терапией инсулином гларгин. Самая частая нежелательная реакция – тошнота, которая была связана с началом терапии, а не с повышением концентрации эксенатида. Большинство таких случаев были транзиторными, редко приводили к отмене терапии [19].
Сердечно-сосудистые осложнения являются основной причиной смертельных исходов у больных СД 2 типа. Самым крупномасштабным исследованием по оценке сердечно-сосудистой безопасности агонистов рецепторов ГПП-1 стало исследование EXSCEL. Его длительность составила 7,5 года, медиана наблюдения – 3,2 года.
В исследование были включены 14 752 пациента с сердечно-сосудистыми рисками, включая сердечно-сосудистые заболевания в анамнезе (ишемическая болезнь сердца, цереброваскулярная болезнь, атеросклероз периферических артерий).
Прагматический дизайн и широкие критерии включения в исследование свидетельствуют о высокой репрезентативности изученной популяции к реальной практике [25].
Результаты исследования сердечно-сосудистой безопасности эксенатида пролонгированного действия продемонстрировали сопоставимую с плацебо частоту развития крупных сердечно-сосудистых событий, включая инфаркт миокарда, инсульт, смерть вследствие сердечно-сосудистых причин.
На сегодняшний день Баета Лонг является единственным зарегистрированным агонистом рецепторов ГПП-1 с доказанной сердечно-сосудистой безопасностью.
Кроме того, данные метаанализа четырех клинических исследований (n = 675) свидетельствуют о снижении артериального давления на 3,6/1,2 мм рт. ст. через 52 недели терапии препаратом Баета Лонг.
Еще одно преимущество Баета Лонг – уменьшение кратности применения. В месяц требуется от четырех до пяти инъекций Баета Лонг, в год – 52. Для сравнения – лираглутид необходимо вводить ежедневно, в месяц количество инъекций достигнет 30, в год – 365.
В связи с низкой частотой использования Баета Лонг следует ожидать повышения приверженности пациентов лечению.
Таким образом, Баета Лонг – это эффективное антидиабетическое средство для пациентов с СД 2 типа, имеющих высокий индекс массы тела (более 35 кг/м2) и не достигающих целевых показателей гликемии на терапии метформином или комбинации метформина с препаратами сульфонилмочевины.
A.M. Mkrtumyan
A.I. Evdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinical Research Center
Contact person: Ashot Musaelovich Mkrtumyan, vagrashot@mail.ru
The discovery of insulinotropic hormones (incretins) – glucagon-like peptide 1 (GLP-1) and glucose-dependent insulinotropic peptide (GIP) contributed to the change in the scientists and clinicians views on the strategy for the treatment of diabetes mellitus type 2 (DM). It has been found that almost 70% of postprandial insulin secretion in healthy individuals happens namely due to the effect of incretins, which is significantly decreased in patients with DM type 2 and glucose tolerance disorders. This discovery became the impetus for the creation of new drugs based on incretin effect: inhibitors of dipeptidyl peptidase 4 and agonists of GLP-1receptors.
The results of international controlled multicenter studies of GLP-1 receptors agonist exenatide demonstrated its high efficiency and safety in patients with DM type 2 with overweight and obesity. Clinically significant is the fact that therapy with exenatide does not lead to the development of pronounced hypoglycemia, as the effects of GLP-1 depend on blood glucose levels.
Despite the high effectiveness of exenatide in achieving of the target levels of carbohydrate metabolism and reducing appetite and body weight, adherence to the treatment of patients remains low. In order to increase adherence to treatment, the drug exenatide was developed with a regimen of application once a week. This is the first registered in the world GLP-1 receptor agonist of prolonged action. More than 18,000 patients have participated in clinical studies of this drug.
In June 2011, the drug exenatide of prolonged action was approved by the European Medical Agency under the trade name Bydureon; in 2012 by US Food and Drug Administration under the same trade name. In March 2017, this drug was approved and registered by the Russian Ministry of Health under the trade name Byetta Long.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.