Демпинг-синдром: современный взгляд на патогенез, диагностику и лечение
- Аннотация
- Статья
- Ссылки
- English
Введение
Демпинг-синдром – это патологическое состояние, возникающее после резекции желудка (по модификации Бильрот II, наиболее часто), гастрэктомии, ваготомии, пилоропластики вследствие быстрого поступления желудочного содержимого в тонкую кишку. Демпинг-синдром встречается примерно у 20% пациентов, перенесших ваготомию с пилоропластикой, у 40% пациентов после резекции желудка и у 50% пациентов, перенесших эзофагэктомию [1–5]. В литературе также описаны случаи демпинг-синдрома после фундопликации по Ниссену [6–8]. На сегодня нет установленных стандартов по диагностике и лечению демпинг-синдрома. Для разработки рекомендаций в помощь практикующим врачам, а также для определения направлений, нуждающихся в дальнейшем исследовании, в 2020 г. был проведен консенсус, посвященный диагностике и лечению демпинг-синдрома [9]. В данной статье приведен обзор литературы, а также ключевые положения указанного консенсуса.
Патогенез
Одним из основных механизмов формирования раннего демпинг-синдрома является быстрая эвакуация содержимого из культи желудка в тонкую кишку. Пусковой причиной служит удаление либо рассечение пилорического жома во время операции, а также выключение двенадцатиперстной кишки из акта пищеварения. По результатам исследования В.П. Акимова и соавт., выдвинута теория о перевозбуждении энтерохромаффинных клеток за счет ускоренного поступления пищи при разрушении пилорического жома. В пользу этой теории коллектив авторов привел пример положительного эффекта использования медикаментов антисеротонинового действия и производных соматостатина [10]. Ввиду гиперосмолярного содержимого тонкой кишки происходит перераспределение жидкости из сосудистого русла в просвет кишечника, что приводит к уменьшению циркулирующего объема плазмы, тахикардии, гипотонии, изменению ЭКГ и в редких случаях обморокам. Перераспределение жидкости в тонкую кишку также может вызвать вздутие двенадцатиперстной или тощей кишки и провоцировать появление абдоминальных симптомов: спастическиой боли, вздутия живота, диареи. Еще одним немаловажным механизмом раннего демпинг-синдрома является повышенное высвобождение нескольких гастроинтестинальных гормонов, таких как нейротензин, вазоинтестинальный пептид, энтероглюкагон, инсулин и глюкагон [6, 11–16].
В развитии синдрома позднего демпинга основную роль играет быстрое поступление непереваренных углеводов в тонкий кишечник, что способствует повышению концентрации глюкозы с последующим гиперинсулинемическим ответом и последующей гипогликемии.
Классификация
Выделяют ранний и поздний демпинг-синдром.
Ранний демпинг-синдром проявляется абдоминальным болевым синдромом, метеоризмом, урчанием в животе, тошнотой и диареей, а также вазомоторными симптомами: желанием лечь после еды, потливостью, тахикардией, гипотонией и в редких случаях обмороком. Возникает в течение первого часа после еды.
Поздний демпинг-синдром связан с нейрогликопенией (на что указывают утомляемость, слабость, спутанность сознания, голод и обмороки) и вегетативной и/или адренергической реактивностью (на что указывают потливость, учащенное сердцебиение, тремор и раздражительность).
Клиническая картина
Ведущими клиническими проявлениями демпинг-синдрома являются слабость после приема пищи, сонливость, головокружение, шум в ушах, тремор, метеоризм, тошнота, диарея, сердцебиение, повышенное потоотделение, спутанное сознание и обморочное состояние [6, 11]. Тяжесть проявлений демпинг-синдрома уменьшается в положении лежа, а пища, богатая углеводами, напротив, усиливает симптоматику.
Выделяют три степени тяжести демпинг-синдрома.
Первая степень (легкая). Провоцирующими факторами возникновения приступа являются сладкая пища и молоко. Клинические проявления (слабость, головокружение, потливость, бледность) слабо выражены и непродолжительны по времени (чаще 10–15 минут, не более получаса). Гемодинамика во время приступа, как правило, стабильная. При рентгенологическом исследовании верхних отделов ЖКТ эвакуация контрастного вещества из культи желудка проходит за 15–20 минут, а длительность пассажа по тонкой кишке – 3–4 часа.
Вторая степень (средней тяжести). Приступы могут возникать после приема любой пищи и длятся 30–60 минут. Клинические проявления (слабость, головокружение, потливость, бледность) имеют более выраженный характер, к ним могут присоединяться жалобы на шум в ушах, тошноту, парестезии, ощущение жара, тахикардии. Стул неустойчивый. Отмечается изменение гемодинамики: частота сердечных сокращений (ЧСС) возрастает на 15–20 уд/мин, систолическое артериальное давление (АД) снижается на 10 мм рт. ст. По данным рентгеноскопии, эвакуация сульфата бария занимает 10–15 минут, а пассаж по тонкой кишке проходит за 2,5–3 часа.
Третья степень (тяжелая форма заболевания). Расстройства возникают после каждого приема пищи, протекают по типу тяжелого вегетативного криза (ЧСС возрастает на 20–30 уд/мин, АД снижается на 15–20 мм рт. ст.) продолжительностью 1,5–2 часа. Боязнь приема пищи и резкие нарушения в процессе пищеварения и усвоения пищи приводят больных к истощению, характерен изнуряющий понос. Контраст из культи желудка эвакуируется за 5–10 минут, а его пассаж по тонкой кишке совершается за 2–2,5 часа.
Диагностика
Для определения предрасположенности к развитию демпинг-синдрома до операции применяют метод Фишера – Стаффорда: интраеюнально через дуоденальный зонд вводят 150 мл 50% раствора глюкозы, в последующем регистрируют в течение 60 минут жалобы больного, пульс, артериальное давление, электрокардиограмму и содержание глюкозы в крови [17].
В зависимости от времени появления симптомов и предполагаемой патофизиологии демпинг-синдром принято классифицировать на ранний и поздний [6, 11, 12]. В диагностике раннего и позднего демпинга выделяют следующие методы.
Провокационная проба. В настоящее время тест на толерантность к глюкозе является предпочтительным методом диагностики демпинг-синдрома [6, 11, 18]. При проведении данного теста пациент принимает внутрь 50 или 75 г глюкозы в растворе, далее с 30-минутными интервалами в течение трех часов измеряют концентрацию глюкозы в крови, уровень гематокрита, ЧСС и АД [19]. Тест считается положительным, если возникает поздняя (120–180 минут) гипогликемия или если происходит раннее (30 минут) повышение уровня гематокрита более чем на 3%. Наиболее чувствительным признаком раннего демпинг-синдрома является увеличение частоты пульса более чем на 10 уд/мин через 30 минут [6, 11, 12, 18, 20–22]. Большинство исследований рассматривают гликемию ниже 60 мг/дл, обычно возникающую между 90 и 180 минутами после приема глюкозы, как диагностику синдрома позднего демпинга. Гипогликемия является маркером позднего демпинг-синдрома и, следовательно, при наличии позволяет диагностировать демпинг-синдром. В то же время ее отсутствие не исключает диагноза демпинг-синдрома, так как ранний демпинг-синдром может присутствовать при отсутствии позднего демпинг-синдрома [11].
Рентгенологическое исследование с оценкой пассажа контрастного вещества из культи желудка и по кишечнику. Для демпинг-синдрома характерны быстрое опорожнение культи желудка от принятого контрастного вещества, значительное усиление перистальтики тонкой и толстой кишки, сменяющееся инертностью. Также характерен провал первой 1/3 или 1/2 порции контрастной взвеси из желудка в тощую кишку в течение 1–2 минут с более длительной эвакуацией оставшейся части контраста.
Дифференциальную диагностику демпинг-синдрома следует проводить пациентам с инсулиномой, нейроэндокринными опухолями, болезнью Крона, частичной кишечной непроходимостью, хроническим энтеритом, секреторной недостаточностью поджелудочной железы [17, 19, 23].
Лечение
Основополагающим этапом лечения демпинг-синдрома является изменение диеты. Пациентам показано частое дробное питание небольшими порциями, рекомендуется отложить прием жидкости как минимум на 30 минут после еды и исключить быстро усваиваемые углеводы, которые присутствуют во всех сладких продуктах и напитках. Рекомендуется придерживаться диеты, состоящей из продуктов с высоким содержанием клетчатки и белков. Кроме того, пациентам желательно принять горизонтальное положение в течение 30 минут после еды, чтобы задержать опорожнение желудка и уменьшить симптомы гиповолемии [24–28].
Фармакотерапия включает в себя применение акарбозы – ингибитора альфа-гликозидазы, который замедляет высвобождение моноглицеридов из пищевых углеводов. Большинство исследований демонстрируют, что акарбоза улучшает толерантность к глюкозе, снижает выработку гастроинтестинальных гормонов и частоту гипогликемии, которая является основным признаком синдрома позднего демпинга [29–36]. Обычно доза акарбозы составляет 50–100 мг три раза в день во время еды. Основными побочными эффектами являются метеоризм и связанное с ним вздутие живота из-за мальабсорбции углеводов.
Аналоги соматостатина способны замедлять скорость опорожнения желудка, транзит по тонкой кишке, подавлять высвобождение желудочно-кишечных гормонов и секрецию инсулина и снижать постпрандиальную вазодилатацию. Таким образом, аналоги соматостатина потенциально полезны как при раннем, так и при позднем демпинг-синдроме. Их эффективность при демпинг-синдроме была первоначально подтверждена серией случаев [37–43], а затем несколькими рандомизированными контролируемыми исследованиями [20, 44–47]. Исследования, проведенные в Нидерландах и Бельгии, показали, что аналоги соматостатина как короткого, так и длительного действия обеспечивают симптоматическое улучшение, но пациенты предпочитают препараты длительного действия из-за меньшего количества инъекций [12, 19, 45, 38, 43]. Вместе с тем J. Arts. и соавт. отметили, что лучший контроль симптомов был достигнут при применении октреотида короткого действия три раза в день, чем при применении октреотида длительного действия ежемесячно [12, 27, 45]. Данные тестов с провокацией глюкозой и оценкой уровня гематокрита и/или частоты пульса предоставляют объективные доказательства эффективности октреотида как при раннем, так и при позднем демпинг-синдроме
[12, 21].
Пациентам с тяжелой формой гипогликемии, не отвечающим на изменение диеты и фармакотерапию, показано рассмотрение возможности повторного хирургического вмешательства. Основной целью оперативного лечения является замедление пассажа из культи желудка и отводящей петли.
Реконструктивная гастроеюнодуоденопластика является наиболее распространенной операцией, посредством которой осуществляется замедление опорожнения оперированного желудка и/или пассажа по отводящей петле кишки, в ряде случае формируется искусственный резервуар (после гастрэктомии).
Международный консенсус по диагностике и лечению демпинг-синдрома
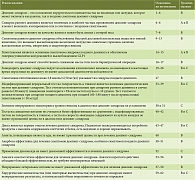
С учетом отсутствия четких критериев, алгоритмов диагностики и терапии демпинг-синдрома в 2020 г. был проведен консенсус, посвященный этим проблемам. На основе положений консенсуса дан ряд рекомендаций по ведению пациентов с демпинг-синдромом (таблица).
Группа экспертов достигла согласия по нескольким аспектам, включая определение, характер симптомов и предполагаемую патофизиологию. В дополнение к диетическим рекомендациям широко распространенными методами лечения являются аналоги акарбозы и соматостатина. В процессе работы над консенсусом также были выявлены области, нуждающиеся в дальнейших исследованиях, такие как разработка и оценка диагностических опросников, согласование пороговых уровней гликемии для достоверного диагноза, оценка терапевтической эффективности акарбозы при симптомах раннего демпинга и относительной эффективности аналогов соматостатина короткого действия по сравнению с аналогами соматостатина пролонгированного действия.
Заключение
Несмотря на то что демпинг-синдром является распространенным осложнением хирургических вмешательств, на сегодня нет установленных руководств по его критериям постановки диагноза и ведению пациентов. По итогам консенсуса были разработаны алгоритмы диагностики и лечения демпинг-синдрома:
- при наличии симптомов, указывающих на ранний или поздний демпинг-синдром, у пациента, перенесшего операцию на пищеводе или желудке, можно заподозрить демпинг-синдром;
- стандартная диагностика (например, с использованием эндоскопии) может потребоваться для исключения других причин симптомов (таких как послеоперационные стриктуры, спайки и инсулинома);
- тест на толерантность к глюкозе является предпочтительным диагностическим методом для подтверждения диагноза демпинг-синдрома. Диагностические параметры для раннего демпинг-синдрома хорошо известны: повышение гематокрита > 3% через 30 минут или увеличение частоты пульса > 10 уд/мин после 30 минут. Поздняя гипогликемия – еще один показатель демпинг-синдрома; существует соглашение о пороговом значении 50 мг/дл, а не 60 мг/дл;
- точно так же нет единого мнения о минимальном уровне спонтанной гликемии, который поддерживает диагноз демпинг-синдрома;
- коррекция диеты с упором на малые порции пищи, устранением быстроусвояемых углеводов и задержкой приема жидкости является первой ступенью в терапии;
- пациентам, которые не реагируют на изменение диеты, рекомендуется использование акарбозы, особенно при синдроме позднего демпинга, но с неясным влиянием на синдром раннего демпинга;
- у пациентов, которые не реагируют на диету и/или акарбозу, аналоги соматостатина могут контролировать симптомы как раннего, так и позднего демпинг-синдрома;
- у пациентов, которые не реагируют на лечение, ценность непрерывного энтерального питания и особенно повторного хирургического вмешательства, резекции поджелудочной железы является неоднозначной.
O.Yu. Gasieva, Yu.V. Embutnieks, PhD, O.I. Berezina, PhD, D.S. Bordin, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Tver State Medical University
Contact person: Olga Yu. Gasieva, o.gasieva@mknc.ru
The literature review summarizes modern ideas about the pathogenesis of dumping syndrome, a pathological condition that occurs after gastric resection. Presented the principles of detecting and correcting of the manifestations of dumping syndrome, which allow improving postoperative rehabilitation and ensuring the acceptable quality of life for patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.