Диагностика и лечение когнитивных нарушений после инсульта
- Аннотация
- Статья
- Ссылки
- English


Введение
Инсульт остается самой частой причиной стойкой инвалидизации среди взрослых людей в подавляющем большинстве стран мира [1–3]. К утрате работоспособности после перенесенного инсульта в первую очередь приводят двигательные и когнитивные нарушения. В последние годы проблеме когнитивных расстройств после инсульта уделяется особое внимание, так как интеллектуальная недостаточность существенно затрудняет ведение пациентов в восстановительном периоде, мешает проведению мероприятий по вторичной профилактике и нейрореабилитации. Поэтому перед лечащими врачами в восстановительном периоде инсульта стоит важная задача – улучшить когнитивные функции пациентов, для чего используются как лекарственные средства, так и немедикаментозные подходы.
Определение
Согласно общепринятой договоренности, под постинсультными когнитивными нарушениями (ПИКН) понимают снижение одной или нескольких когнитивных функций по сравнению с преморбидным состоянием, диагностированное впервые в жизни после перенесенного инсульта, независимо от непосредственной причины мнестико-интеллектуального снижения. В большинстве исследований нейропсихологический статус пациентов определялся через три – шесть месяцев после инсульта. Однако возможно и более раннее (через несколько дней или недель), и более позднее (до 15 лет) проведение нейропсихологического исследования. Выявленные при этом когнитивные симптомы формально могут быть классифицированы как ПИКН без учета их причинно-следственной связи с развившимся острым нарушением мозгового кровообращения [4–6].
Постинсультной деменцией называют снижение одной или нескольких когнитивных функций, которое впервые диагностировано после инсульта и приводит к существенным ограничениям в повседневной деятельности. Например, пациент не может продолжать работать, ему трудно самостоятельно осуществлять финансовые операции, он дезориентирован на местности. Следует обратить внимание, что современные руководства по диагностике и классификации когнитивных нарушений, в частности Диагностическое и статистическое руководство по психическим расстройствам 5-го пересмотра (Diagnostic and Statistical Manual of Mental Disorders – DSM-5), не настаивают на том, что когнитивные расстройства при деменции (по DSM-5 «большом нейрокогнитивном расстройстве») обязательно носят полифункциональный характер или затрагивают мнестическую сферу [7]. Таким образом, диагноз постинсультной деменции будет правомерен при значительном поражении одной когнитивной функции (не обязательно памяти), если пациент вследствие этого утрачивает самостоятельность в повседневной жизни. Как и в отношении ПИКН, диагноз постинсультной деменции не подразумевает облигатной причинно-следственной связи деменции с перенесенным инсультом, а свидетельствует только о связи по времени (деменция выявлена после инсульта). По мнению ведущих европейских экспертов, целесообразно проводить диагностику постинсультной деменции как минимум через шесть месяцев после церебрального сосудистого события [4].
Постинсультная деменция входит в состав ПИКН. Помимо нее в структуре ПИКН выделяют легкие и умеренные ПИКН, а также субъективное постинсультное когнитивное снижение. Легкие и умеренные ПИКН диагностируются, если впервые обнаруженные после инсульта и подтвержденные с помощью нейропсихологических методов исследования мнестико-интеллектуальные нарушения существенно не влияют на повседневную деятельность пациента. При субъективном когнитивном снижении больной предъявляет жалобы когнитивного характера, но результаты нейропсихологических тестов остаются в норме.
Очевидно, что наиболее частая причина ПИКН – цереброваскулярные заболевания. Однако анализ факторов риска развития когнитивных нарушений после инсульта и нейропсихологических особенностей ПИКН свидетельствует о вероятной роли сопутствующей патологии по меньшей мере в некоторых случаях ПИКН. Обычно речь идет о сопутствующей болезни Альцгеймера, поскольку она, безусловно, представляет собой самую распространенную причину когнитивных расстройств у взрослых в целом. Но инсульт может отмечаться и у пациентов с другими нейродегенеративными заболеваниями (болезнью диффузных телец Леви, лобно-височной дегенерацией и др.). На нейропсихологический статус пациентов после инсульта также негативно влияют сопутствующая соматическая патология, постинсультная депрессия, делирий или психотические расстройства, которые часто встречаются в раннем постинсультном периоде, особенно при правополушарной локализации сосудистого очага.
Взаимосвязь между ПИКН, постинсультной деменцией, сосудистыми, нейродегенеративными и иными когнитивными нарушениями после инсульта схематически показана на рисунке.
Распространенность
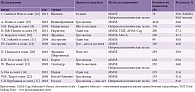
Показатели распространенности ПИКН значительно варьируются в зависимости от выборки пациентов (популяционные исследования или данные стационаров), методов исследования (клинические диагностические критерии, простые скрининговые тесты или более сложные нейропсихологические методики), подходов к оценке и исключению пациентов с когнитивными расстройствами после инсульта (табл. 1 и 2), первичного или повторного характера инсульта [8–22].
S.T. Pendlebury и P.M. Rothwell (2009) опубликовали метаанализ, в котором обобщили результаты 30 крупных международных исследований распространенности постинсультной деменции, в том числе восьми популяционных исследований и 22 исследований с данными, полученными из стационаров. В среднем частота постинсультной деменции составила 20%, причем реже она наблюдалась в популяционных исследованиях у пациентов с первым в жизни инсультом после исключения случаев с предположительной доинсультной деменцией (7,4%). Гораздо чаще (41,3%) постинсультная деменция отмечалась у больных в стационарах с повторным инсультом в тех исследованиях, в которых принимали участие пациенты с доинсультной деменцией. В целом, характер выборки пациентов, подход к исключению или оставлению случаев с доинсультной деменцией, а также тип инсульта (первичный или повторный) объясняли до 90% вариабельности распространенности постинсультной деменции. Доинсультная деменция в среднем встречалась в 9,1% случаев в общей популяции и в 14,4% случаев среди пациентов стационаров [23].
Ряд исследований был посвящен количественной оценке риска развития деменции после инсульта. Анализ результатов Фрамингемского исследования [13] и Американского исследования пациентов, длительно получавших медицинскую помощь [24], свидетельствует о том, что у пациентов после инсульта риск развития деменции был в 2–10 раз выше, чем у подобранных по возрасту и уровню образования лиц без инсульта в анамнезе. При этом повышенный риск развития деменции сохранялся в течение не менее трех – пяти лет после перенесенного острого нарушения мозгового кровообращения [25]. Закономерно, что наибольший риск развития деменции после инсульта отмечался у пациентов с недементными (легкими или умеренными) когнитивными расстройствами в доинсультном периоде [26].
Распространенность ПИКН, включая постинсультную деменцию и недементные (легкие и умеренные) когнитивные нарушения, может значительно превосходить таковую постинсультной деменции. Однако данные международных эпидемиологических исследований существенно варьируются в зависимости от страны и применяемой диагностической методики. При использовании в качестве критерия диагноза ПИКН результатов по краткой шкале оценки психического статуса (Mini-Mental State Examination – MMSE) (сумма баллов до 27) распространенность ПИКН в Великобритании составила 24% [19], в Швеции – 39% [18], Южной Корее [21] и Нидерландах [8] – 70%. В то же время при проведении углубленного нейропсихологического исследования частота когнитивных расстройств после инсульта может достигать 96% [18].
Некоторые работы посвящены изучению распространенности когнитивных нарушений при определенных подтипах инсульта. Так, V.C. Mok и соавт. (2004) оценивали частоту постинсультной деменции и ПИКН через три месяца после лакунарного ишемического инсульта, вызванного патологией малых сосудов. Из исследуемой выборки целенаправленно исключались пациенты со стенозом крупных интракраниальных или экстракраниальных артерий и пациенты с предполагаемой кардиоэмболической природой церебрального инсульта независимо от его размера. Кроме того, исключались пациенты с сопутствующей болезнью Альцгеймера, большой депрессией, другой значимой сопутствующей патологией. Было показано, что через три месяца после перенесенного лакунарного инсульта у 34,7% больных выявлялись недементные (легкие или умеренные) когнитивные нарушения, а у 13,3% – деменция. Согласно результатам анкетирования по опроснику родственников о когнитивном снижении у пожилого человека, предикторами развития постинсультной деменции стали доинсультные когнитивные нарушения и повторный характер инсульта [27].
В нашей стране распространенность когнитивных расстройств после инсульта изучали C.В. Вербицкая и соавт. (2018). У 350 пациентов, перенесших ишемический инсульт, в сроки от трех месяцев до семи лет проводилось нейропсихологическое исследование с помощью батареи достаточно чувствительных методик. Оказалось, что у 21% больных, вероятно, имеется деменция и еще у 62% – легкие или умеренные когнитивные нарушения [17].
Факторы риска
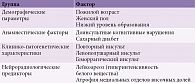
Серьезное внимание во всех эпидемиологических работах уделяется факторам риска развития когнитивных нарушений после инсульта. Доказанные факторы, ассоциированные с повышенным риском ПИКН, можно разделить на четыре основные группы: демографические, анамнестические, клинико-патогенетические характеристики инсульта и нейрорадиологические признаки (табл. 3).
Большинство из обсуждаемых демографических факторов риска ПИКН – факторы риска когнитивных расстройств в целом. К ним относятся в первую очередь пожилой возраст и низкий уровень образования.
Повторный характер инсульта в различных исследованиях неизменно называется в качестве одного из главных определяющих факторов риска ПИКН. По данным метаанализа S.T. Pendlebury и P.M. Rothwell (2009), приблизительно 10% пациентов, перенесших инсульт, страдают деменцией еще до острого нарушения мозгового кровообращения, а у других 10% пациентов она развивается вскоре после первого инсульта. В то же время при повторном инсульте риск постинсультной деменции составляет не менее 30% [23].
Несомненно, на риск развития когнитивных нарушений влияет локализация инсульта. L. Zhao и соавт. (2017) решили изучить справедливость этого положения, проанализировав данные 410 пациентов, перенесших первичный или повторный инсульт. С помощью монреальской шкалы оценки когнитивных функций (Montreal Cognitive Assessment – MoCA) они оценили нейропсихологический статус пациентов в целом. Использовались также отдельные специальные тесты для оценки памяти, внимания, речи, управляющих функций и конструктивного праксиса. Было показано, что риск общего когнитивного снижения (по MoCA) достоверно выше при локализации инсульта в области внутренней или наружной капсулы левого полушария, мозолистого тела, левого лучистого венца, левого хвостатого ядра, левой орбитофронтальной коры, левой средней височной извилины, левого таламуса, левой угловой извилины и некоторых других структур левого полушария. Поражение левого хвостатого ядра тоже ассоциировалось с большим поражением памяти, управляющих функций и конструктивного праксиса, левой угловой извилины – памяти и речи, левой цингулярной извилины – управляющих функций, левого островка – внимания и управляющих функций. В других работах также сообщается о левосторонней локализации церебрального поражения как более неблагоприятной в отношении риска когнитивных расстройств. Впрочем, это может быть вызвано тем, что левополушарные когнитивные симптомы лучше, чем правополушарные, объективизируются с помощью существующих нейропсихологических тестов [28].
Большой интерес представляет изучение нейрорадиологических предикторов ПИКН. Полученные данные о связи тех или иных нейрорадиологических признаков с риском ПИКН свидетельствуют о роли сосуществующей с инсультом сосудистой и несосудистой церебральной патологии. Например, доказанным предиктором развития ПИКН является атрофия медиальных отделов височных долей, которая традиционно рассматривается как признак болезни Альцгеймера [4, 29]. О вкладе сопутствующей болезни Альцгеймера в формирование ПИКН могут говорить также специфические особенности нарушения памяти и биомаркеры церебрального амилоидоза в спинномозговой жидкости. По данным М.А. Чердак и Н.Н. Яхно, признаки характерного для болезни Альцгеймера гиппокампального типа нарушений памяти в сочетании с нейрохимическими маркерами церебрального амилоидоза выявляются приблизительно у 30% пациентов с ПИКН [30].
Другой доказанный фактор риска развития ПИКН – распространенная гиперинтенсивность белого вещества (так называемый лейкоареоз), что свидетельствует о роли доинсультного сосудистого поражения головного мозга [31, 32]. Примечательно, что другие признаки хронического цереброваскулярного заболевания, в частности немые церебральные инфаркты, расширения периваскулярных пространств (криблюры) и микрокровоизлияния статистически достоверно не влияют на риск ПИКН в отличие от лейкоареоза [31]. По данным израильского исследования, прослеживается достоверная связь между выраженностью лейкоареоза, нарушениями памяти и зрительно-пространственных функций, а также нейропсихологическим статусом в целом [31]. Это согласуется с норвежской работой, где была продемонстрирована значимая связь между выраженностью лейкоареоза и показателями памяти и управляющих функций у пациентов с ПИКН [32].
Прогноз
Некоторые исследования посвящены долговременному наблюдению за пациентами с ПИКН.
T. Ser и соавт. наблюдали 193 пациентов с ПИКН в течение двух лет. В подавляющем большинстве случаев (78,2%) когнитивный дефект оставался стабильным на протяжении всего времени. У остальных пациентов когнитивные функции либо улучшились (7,8%), либо ухудшились (14%). Фактором риска прогрессирования когнитивных расстройств после инсульта, по данным цитируемых авторов, были пожилой возраст, когнитивные нарушения до инсульта и эпизоды артериальной гипотонии. Последнее может указывать на негативную роль снижения сердечного выброса и церебральной гипоперфузии в прогрессировании хронической цереброваскулярной недостаточности. Напротив, улучшение когнитивных функций ассоциировалось с левополушарной локализацией сосудистого очага, постинсультной депрессией, более выраженными речевыми расстройствами и геморрагическим характером инсульта. Вероятно, более значительные речевые расстройства и эмоционально-поведенческие нарушения негативно сказываются на оценке когнитивных способностей сразу после инсульта, но имеют определенную тенденцию к уменьшению выраженности в отдаленном восстановительном периоде инсульта. Интересно, что половине пациентов с регрессирующим течением ПИКН сразу после инсульта был поставлен диагноз «деменция», который в процессе динамического наблюдения поменялся на «недементные когнитивные нарушения». Таким образом, постинсультная деменция в ряде случаев может иметь обратимый характер [33].
Наиболее длительное наблюдение за пациентами с ПИКН происходило в рамках исследования South London Stroke Register, которое проводилось с 1995 по 2010 г. В рамках этой масштабной работы отслеживалось состояние 4212 пациентов в динамике. Когнитивные функции пациентов оценивались через 3 и 12 месяцев после инсульта и далее ежегодно в течение 14 лет с помощью MMSE или сокращенного варианта теста для оценки умственных способностей [19]. Через три месяца после инсульта когнитивные расстройства отмечались у 22% пациентов. Факторами повышенного риска ПИКН были пожилой возраст, низкий уровень образования, принадлежность к негроидной расе и физический характер труда. В дальнейшем, несмотря на достоверно более высокую смертность среди пациентов с ПИКН, распространенность когнитивных нарушений в наблюдаемой популяции оставалась почти неизменной: 22% – через пять лет после инсульта и 21% – через 14 лет. Это свидетельствует о появлении новых случаев когнитивных расстройств среди пациентов, не имевших диагноза ПИКН в начале наблюдения. Кроме того, прогрессирующее течение ПИКН статистически значимо ассоциировалось с лакунарным инсультом и патологией сосудов небольшого калибра. Следовательно, подкорковая сосудистая деменция прогрессирует чаще, чем другие патогенетические варианты сосудистой деменции (мультиинфарктная или стратегическая инфарктная деменция и др.) [19].
Таким образом, когнитивные расстройства после инсульта могут иметь и прогрессирующий, и регрессирующий, и стабильный характер течения в зависимости от демографических особенностей, патогенетических характеристик острого нарушения мозгового кровообращения и сопутствующей патологии.
Клиническое значение
Когнитивные нарушения у пациентов, перенесших инсульт, ассоциированы со статистически значимым увеличением смертности и негативно влияют на нейрореабилитацию.
Наблюдение за пациентами, перенесшими инсульт, в течение 15 лет в рамках исследования South London Stroke Register показало, что среди больных с ПИКН летальность была на 53% выше, чем среди пациентов с нормальными когнитивными функциями [19]. M. Patel и соавт. (2003) установили, что смертность у пациентов с ПИКН и пациентов, перенесших инсульт, но не имеющих когнитивных нарушений, составила 23 и 8% через год, 35 и 15% через два года, 45 и 24% через три года после инсульта (р < 0,01) [34]. О почти трехкратном повышении смертности среди пациентов с ПИКН по сравнению с подобранными по полу и возрасту пациентами без ПИКН сообщили также P. Hobson и J. Meara (2010) [35].
Через шесть месяцев после инсульта у пациентов с ПИКН достоверно чаще возникают сложности с пользованием бытовой техникой (так называемые нарушения инструментальной повседневной деятельности) [36]. Это свидетельствует о меньшей эффективности реабилитационных мероприятий у пациентов с ПИКН. При этом наиболее важным предиктором недостаточной эффективности нейрореабилитации является выраженность нарушений управляющих функций мозга и внимания [27]. В то же время связь ПИКН с общим показателем активности в повседневной жизни через шесть месяцев после инсульта не достигает статистической значимости, но достоверно влияет на этот показатель сразу после инсульта [36]. По данным S. Zinn и соавт. (2004), пациенты с ПИКН нуждаются в более длительной и интенсивной нейрореабилитации по сравнению с пациентами с сохранными когнитивными функциями [36].
Диагностика
Достоверное влияние постинсультных когнитивных расстройств на смертность и функциональный исход восстановительного периода инсульта, а также на эффективность нейрореабилитации обусловливает целесообразность оценки состояния когнитивных функций у всех пациентов, перенесших инсульт. Однако в настоящее время отсутствуют четкие рекомендации по тому, в какое время следует проводить нейропсихологическое исследование и какие методики использовать. Представляется обоснованной оценка когнитивных функций уже в конце первой-второй недели после инсульта при условии ясного сознания и стабильной гемодинамики ввиду того, что в раннем восстановительном периоде уже осуществляются активные реабилитационные мероприятия и когнитивные расстройства могут на них негативно сказываться. Поэтому диагностика и лечение ПИКН имеют большое значение уже в раннем восстановительном периоде инсульта. В то же время диагноз постинсультной деменции, как указывалось выше, может быть преждевременным в первые месяцы после инсульта, поскольку в некоторых случаях когнитивная симптоматика существенно регрессирует [4]. Одновременно с исследованием когнитивных функций международное научное сообщество рекомендует оценивать эмоционально-поведенческую сферу (наличие тревоги, депрессии, апатии, психотических симптомов), так как эмоционально-поведенческие расстройства несомненно негативно влияют на состояние высших психических функций [4].
Среди оптимальных для оценки когнитивных функций в раннем восстановительном периоде инсульта нейропсихологических методик разные авторы чаще всего называют MoCA – эта шкала характеризуется высокой чувствительностью (до 95% при сумме баллов ниже 26). В то же время уровень специфичности данной методики при сумме баллов менее 26 достаточно низкий (45%), то есть больше половины пациентов, у которых на основании тестирования выявляются ПИКН, на самом деле имеют нормальные когнитивные функции. Поэтому, по мнению ряда ведущих европейских экспертов, при работе с пациентами после инсульта целесообразно использовать в качестве критерия сумму баллов ниже 22. Это позволяет повысить специфичность методики до 75% при чувствительности 85%. Помимо МоCА для диагностики когнитивных нарушений после инсульта можно также использовать MMSE, тест рисования часов и другие методики [4].
Лечение
Самая очевидная рекомендация для всех пациентов, перенесших инсульт, – лечение базисного сосудистого заболевания и профилактика повторного инсульта. Однако данные о влиянии базисной терапии на когнитивные функции пациентов после инсульта противоречивы. Исследование PROGRESS показало, что на фоне антигипертензивной терапии комбинацией периндоприла и индапамида темпы прогрессирования ПИКН снижаются и риск развития деменции достоверно уменьшается [37]. Однако в других масштабных проспективных исследованиях антигипертензивных препаратов положительного эффекта антигипертензивной терапии в отношении когнитивных функций не выявлено [38–41]. Кроме того, на сегодняшний день отсутствуют доказательства благоприятного воздействия статинов на когнитивные функции, несмотря на их несомненно важную роль в профилактике повторного инсульта [42, 43].
К специфическим видам терапии когнитивных нарушений различной этиологии относится прием ингибиторов ацетилхолинэстеразы, мемантина, вазотропных и нейрометаболических лекарственных средств. Ингибиторы ацетилхолинэстеразы и мемантин используются в первую очередь при когнитивных расстройствах, достигающих выраженности деменции. В ряде исследований была показана положительная динамика когнитивных функций у пациентов с сосудистой деменцией на фоне приема донепезила. Похожие результаты были получены при использовании мемантина у пациентов с легкой сосудистой деменцией [44].
При когнитивных расстройствах после инсульта, которые не достигают выраженности деменции, предпочтение следует отдавать препаратам с выраженным нейропротективным эффектом. В частности есть интересный опыт практического применения винпоцетина (препарата Кавинтон) в восстановительном периоде ишемического инсульта. Винпоцетин (препарат Кавинтон) представляет собой полусинтетическое производное лекарственного растения барвинка малого, которое комплексно положительно влияет как на церебральную перфузию, так и на интранейрональные метаболические процессы. Винпоцетин зарегистрирован в качестве лекарственного средства в 45 странах мира и используется у пациентов с цереброваскулярными заболеваниями и когнитивными расстройствами другой природы на протяжении многих лет [45–47].
В последние годы проведен большой ряд экспериментальных и клинических исследований, которые существенно расширили представления о механизмах действия винпоцетина (препарата Кавинтон) [45–47]. Сегодня не вызывает сомнений, что ингибирование фосфодиэстеразы гладкомышечных клеток и форменных элементов крови, с чем связано вазодилатирующее и антиагрегантное действие Кавинтона, – только один и, вероятно, не самый главный фармакологический эффект этого препарата. Так, применение Кавинтона способствует повышению уровня специфического церебрального нейротрофического фактора – белка, играющего ключевую роль в управлении церебральными нейрорепаративными процессами [47]. Последний фармакологический эффект обусловливает клиническую целесообразность использования Кавинтона в восстановительном периоде инсульта, когда нейрорепаративные процессы протекают наиболее активно. Кроме того, Кавинтон, блокируя обратный захват аденозина, приводит к гиперполяризации нейрональных мембран, снижает их возбудимость, а следовательно, энергозатраты клетки, осуществляя нейропротекцию. По экспериментальным данным, Кавинтон обладает также антиоксидантным, противовоспалительным и легким противосудорожным эффектом [45–47].
Наиболее масштабный опыт использования Кавинтона в восстановительном периоде инсульта обобщен в Российской многоцентровой клинико-эпидемиологической программе СОКОЛ. В ней принимал участие 661 пациент в возрасте от 30 до 70 лет, перенесший ишемический инсульт. Всем больным проводилось лечение базисного сосудистого заболевания в соответствии с общепринятыми международными рекомендациями. Кроме того, 344 пациента начиная с 5–14-го дня после инсульта получали Кавинтон в виде инфузий внутривенно капельно по схеме: первые четыре дня 5 мл на 400 мл физиологического раствора, далее три дня 10 мл на 400 мл физиологического раствора. После этого пациенты переходили на пероральный прием препарата по 10 мг три раза в день в течение 90 дней. Было показано, что на фоне использования Кавинтона клинически значимые речевые, мнестические расстройства и нарушения внимания регрессировали достоверно в большей степени, чем в контрольной группе. Одновременно у пациентов, принимавших Кавинтон, отмечалось достоверно более выраженное увеличение самостоятельности [48].
В других не менее масштабных клинических исследованиях была продемонстрирована эффективность Кавинтона в отношении недементных сосудистых когнитивных нарушений при хронической ишемии головного мозга. Применение препарата способствовало регрессу системного и несистемного головокружения, нарушений равновесия, астенических и других субъективных неврологических расстройств [49–52].
Важно отметить, что Кавинтон безопасен и хорошо переносится, в том числе пожилыми пациентами с сердечно-сосудистыми заболеваниями. При использовании в рекомендуемых дозах и соблюдении общепринятых требований к скорости внутривенного введения (до 80 капель в минуту) препарат не оказывает клинически значимого аритмогенного действия.
Данные по эффективности немедикаментозных стратегий коррекции когнитивных нарушений у пациентов с ПИКН противоречивы. Так, по некоторым свидетельствам, систематические физические упражнения способствуют регрессу когнитивных нарушений у пациентов после инсульта [53]. В то же время исследования эффективности когнитивного тренинга и полимодального подхода (физические упражнения, когнитивный тренинг, оптимальное питание) не смогли подтвердить положительное влияние этих методов на когнитивные функции пациентов после инсульта [54, 55]. Вероятно, отсутствие доказательств обусловлено трудностями стандартизации немедикаментозного лечения и подбора соответствующих пациентов в контрольную группу.
Заключение
Следует подчеркнуть, что диагностика и лечение когнитивных нарушений – важная практическая задача при ведении пациентов в восстановительном периоде инсульта. Улучшение когнитивного состояния после инсульта способствует регрессу инвалидизации, повышению качества жизни пациентов и их родственников, благоприятно влияет на исход восстановительного периода инсульта.
N.V. Vakhnina, PhD
I.M. Sechenov First Moscow State Medical University
Contact person: Natalya V. Vakhnina, nvakhnina71@mail.ru
The article discusses the epidemiology, diagnosis and treatment of cognitive impairment after stroke. On the example of vinpocetin, the prospects for the use of drugs with obvious neuroprotective effect in patients with cognitive disorders not reaching the severity of dementia in ischemic stroke recovery period are discussed. It is noted that the improvement of the patients’ after stroke cognitive state of contributes to the regression of disability, improvement of the quality of life of patients and their relatives, favorably affects the outcome of the stroke recovery period.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.