Достижение контроля аллергического ринита с помощью ступенчатой терапии
- Аннотация
- Статья
- Ссылки
- English




Аллергический ринит (АР) не относится к тяжелым и угрожающим жизни заболеваниям, но его медико-социальное значение определяется:
-
высокой распространенностью среди детей, подростков и взрослых: АР страдают от 15 до 40% лиц всех возрастов [1];
-
существенным снижением качества жизни больных;
-
нарушением сна;
-
ограничением, связанным с обучением и профессиональной деятельностью.
Кроме того, АР связан с такими заболеваниями, как бронхиальная астма, острый и хронический риносинусит, аллергический конъюнктивит, экссудативный средний отит [1].
Этиология и патогенез аллергического ринита
Ингаляционные аллергены, как сезонные (пыльца растений, споры плесневых грибов), так и круглогодичные (клещи домашней пыли, аллергены домашних животных), являются главными факторами, запускающими аллергическую реакцию, лежащую в основе развития симптомов АР. Паттерн доминирующих аллергенов зависит от географического региона и степени урбанизации. Например, для средней полосы РФ наиболее значимы сезонные аллергены, такие как пыльца деревьев и луговых трав, для южных регионов – пыльца сорных трав. Как известно, распространенность АР среди жителей больших городов существенно выше, чем среди жителей сельской местности. Это обусловлено воздействием воздушных поллютантов – выхлопных газов, озона, оксида азота и диоксида серы, табачного дыма. Атмосферные поллютанты способны увеличивать аллергенные свойства пыльцы, нарушать барьерные функции слизистых оболочек дыхательных путей человека и усиливать симптомы АР за счет стимуляции механизмов назальной реактивности. Некоторые из них, в частности дизельный выхлопной газ, могут стимулировать синтез иммуноглобулина (Ig) E и аллергическое воспаление.
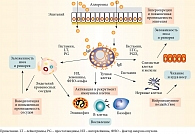
Механизм развития АР представляет собой классический пример немедленной IgE-обусловленной аллергической реакции (рис. 1) [2].
Главными участниками аллергического воспаления, развивающегося в слизистой оболочке носа в результате взаимодействия аллергена со специфическими IgE-антителами, являются эозинофилы, лимфоциты, тучные, эпителиальные и эндотелиальные клетки. Аллергенспецифические IgE-антитела, образующиеся в избытке при контакте с аллергеном у предрасположенных к атопии лиц, фиксируются на высокоаффинных рецепторах к ним (FcεRI), расположенных на тучных клетках. Это приводит к сенсибилизации слизистой оболочки носа. Следующий контакт с аллергеном и связывание последнего с фиксированными на тучных клетках IgE-антителами способствуют активации тучных клеток и секреции медиаторов аллергического воспаления: гистамина, триптазы, кининов, цистеиниловых лейкотриенов (С4, D4, E4), простагландина D2. Медиаторы воздействуют на эндотелиальные клетки сосудов и нейрорецепторы слизистой оболочки носа, вследствие чего развиваются клинические симптомы АР (рис. 1). На фоне воспаления слизистой оболочки носа назальные симптомы могут персистировать в течение нескольких часов после контакта с аллергеном, а слизистая оболочка становится более реактивной к провоцирующим аллергенам (эффект прайминга), равно как и к другим аллергенам и неаллергическим триггерам (например, резкому запаху или холодному воздуху) [3]. Развивается специфическая и неспецифическая гиперреактивность назальной слизистой оболочки. На рис. 2 представлены IgE-опосредованное высвобождение медиаторов воспаления при аллергическом рините и бронхиальной астме, развитие ранней и поздней фаз аллергической реакции и место основных классов лекарственных средств (антигистаминных, антилейкотриеновых препаратов и топических глюкокортикостероидов (ГКС)).
Классификация аллергического ринита
Выделяют следующие формы АР:
-
сезонный – возникает при сенсибилизации к пыльцевым и грибковым аллергенам: пыльце деревьев, злаковых и сорных трав, спорам грибов Cladosporium, Penicillium, Alternaria, Aspergillus и др.;
-
круглогодичный – развивается у пациентов с сенсибилизацией к аллергенам клещей домашней пыли, библиотечной пыли, эпидермальным аллергенам животных и птиц, инсектным аллергенам, аллергенам плесневых грибов, пищевых продуктов и лекарственных препаратов при их постоянном приеме, профессиональным аллергенам.
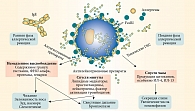
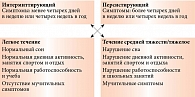
Современная классификация АР, основанная на длительности и тяжести симптомов, была предложена международными сообществами (EAACI/WAO (European Academy of Allergy and Clinical Immunology/World Allergy Organization – Европейская академия аллергологов и клинических иммунологов/Всемирная организация аллергологов), программа ARIA (Allergic Rhinitis and its Impact on Asthma – аллергический ринит и его влияние на астму) 2008, 2010) (рис. 3) [1]. Подразделение АР на интермиттирующий и персистирующий успешно применяется в нашей стране на протяжении многих лет.
Диагностика аллергического ринита
Перечислим основные составляющие диагностики АР и сопутствующего ему аллергического конъюнктивита:
-
анамнез: семейный анамнез, время появления симптомов, их сезонная вариабельность, профессиональный маршрут;
-
клиническая картина: описание симптомов (ринорея, чихание, зуд в носу, нарушение носового дыхания и нередко обоняния);
-
специфическое аллергологическое обследование: кожные пробы с аллергенами, определение аллергенспецифических IgE-антител, назальные и конъюнктивальные провокационные тесты с аллергенами.
Диагноз АР часто основывается на клинических симптомах и эмпирической эффективности антигистаминных препаратов и интраназальных ГКС (ИнГКС), однако верифицированный диагноз АР можно поставить только после специфического аллергологического обследования, которое служит и дифференциально-диагностическим приемом в отношении неаллергического ринита. Следует помнить, что существует много разных видов неаллергических/неинфекционных ринитов: гормональный, медикаментозный, неаллергический эозинофильный ринит, ринит, индуцированный пищей, ирритантный, атрофический, эмоциональный и идиопатический/вазомоторный.
Как показали результаты исследований последних лет, 47–62,5% пациентов с симптомами ринита, ранее диагностированного как неаллергический или идиопатический, имеют локальную (в назальной слизистой оболочке) гиперпродукцию аллергенспецифических IgE и положительный назальный провокационный тест с такими аллергенами, как клещ домашней пыли, Alternaria alternata, пыльца злаковых трав и оливы [4–8]. Эта форма АР называется локальной.
Пациенты с локальным АР характеризуются клиническим фенотипом круглогодичного или сезонного АР (обычно среднетяжелого/тяжелого течения), Th2-профилем воспаления в слизистой оболочке носа. При этом у них выявляются отрицательные кожные пробы с аллергенами и отсутствие аллергенспецифических IgE в сыворотке крови. Диагностику локального АР проводят с помощью назальных провокационных тестов с аллергенами [4–8].
Ступенчатая терапия аллергического ринита
Основные принципы терапии аллергического ринита заключаются в следующем:
-
предотвращение или сокращение контакта с аллергенами и триггерами;
-
использование лекарственных средств;
-
проведение специфической иммунотерапии аллергенами;
-
обучение пациента.
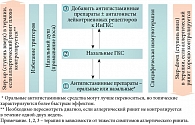
Ступенчатая терапия АР, предложенная в документе ARIA 2008, получила дальнейшее развитие в недавно опубликованной позиционной статье EAACI, посвященной ринитам у детей [9]. В статье представлен алгоритм терапии АР у детей, который вполне применим и у взрослых (рис. 4).
Новая концепция лечения АР, основанная на контроле симптомов, была предложена недавно в документе PRACTALL [10]. В таблице 1 представлены критерии контроля ринита, основанные на оценке симптомов, качества жизни пациентов и данных объективного обследования. В настоящее время нет единого определения контроля ринита, равно как и инструмента для его оценки. Однако несколько вопросников активно изучаются для этой цели (CARAT, RCAT, VAS и др.) [11–14]. Большинство разработанных вопросников основаны на определении дневных и ночных симптомов, степени их влияния на работоспособность, способность к обучению и сон, а также требуемой терапии и необходимости в ее увеличении. Временной период оценки контроля симптомов АР колеблется от одной до четырех недель, предшествующих консультации [11, 12]. Критерии (симптомы и качество жизни), представленные в табл. 1, предлагается оценивать за последние четыре недели. Любое отклонение от этих критериев указывает на утрату контроля, и может быть рассмотрена терапия step-up, равно как и при увеличении потребности в препаратах «спасения» (деконгестантах, оральных ГКС). Безусловно полезны объективные тесты для определения назального дыхания: измерение назальной пиковой скорости вдоха, риноманометрия и очень простой для применения в обычной клинической практике тест «дыхание с закрытым ртом» (табл. 1). Следует помнить, что сопутствующие АР заболевания способны влиять на контроль симптомов. От 10 до 40% больных АР страдают бронхиальной астмой [1], многие имеют синдром обструктивного апноэ/гипопноэ сна [15].
Для достижения контроля предлагается терапия, состоящая из четырех ступеней. Каждая из них включает различные варианты фармакологической терапии в зависимости от выраженности симптомов АР (рис. 5) [10]. Принцип ступенчатого подхода к лечению АР, равно как и бронхиальной астмы, заключается в увеличении объема терапии/переходе на ступень вверх (step-up) при отсутствии контроля симптомов АР и снижении объема терапии/переходе на ступень вниз (step-down) в случае достижения и поддержания контроля симптомов АР.
Фармакологические препараты для контроля симптомов аллергического ринита
Оральные антигистаминные препараты первого поколения не рекомендуются для лечения АР в силу их хорошо известных нежелательных побочных эффектов (выраженное седативное действие, тахифилаксия, сухость слизистых оболочек, задержка мочи, тахикардия, повышение аппетита и др.). Антигистаминные препараты второго поколения (АГП II) лишены недостатков своих предшественников и имеют доказанную эффективность при АР: при легких симптомах в виде монотерапии, при среднетяжелых/тяжелых в комбинации с ИнГКС (рис. 5). Они, как правило, являются препаратами первого выбора у пациентов с легкими симптомами сезонного и круглогодичного АР как интермиттирующего, так и персистирующего течения.
Назначение оральных АГП II обусловлено их влиянием не только на назальные симптомы, но и на конъюнктивальные проявления, которые отмечаются у 71,4% взрослых больных АР, проживающих в Европе [16].
Большое проспективное мультицентровое исследование по установлению главных критериев, определяющих выбор АГП II для терапии АР у 1080 пациентов, было недавно проведено во Франции. Как оказалось, основной причиной выбора какого-либо АГП II была его ожидаемая эффективность, а сопутствующий конъюнктивит был связан с более быстрым ответом на лечение АГП II [17].
Интраназальные антигистаминные препараты проявляют быстрый эффект в отношении назальных симптомов, но имеют ограниченное влияние на глазные симптомы.
Существование системной связи между АР и бронхиальной астмой обусловливает рациональность применения единой системной терапии этих заболеваний. Среди фармакологических препаратов наиболее полно удовлетворяют этому требованию антагонисты лейкотриеновых рецепторов.
Как известно, в основе бронхиальной астмы и АР лежит аллергическое воспаление, в формировании которого помимо гистамина и цитокинов участвуют цистеиниловые лейкотриены (цис-LT) (LТС4, LТD4, LТЕ4 и LТВ4). Большинство фармакологических эффектов цис-LТ, имеющих отношение к патофизиологии АР и бронхиальной астмы, осуществляются через активацию специфических цис-LТ1-рецепторов, расположенных на тучных клетках, моноцитах и макрофагах, эозинофилах, базофилах, нейтрофилах, Т- и В-лимфоцитах, гладкомышечных клетках, бронхиальных фибробластах и эндотелиальных клетках. Поэтому фармакологические препараты – антагонисты цис-LТ1-рецепторов (монтелукаст, зафирлукаст и пранлукаст) давно одобрены во многих странах мира и хорошо зарекомендовали себя в лечении бронхиальной астмы и АР у взрослых и детей. Монтелукаст – препарат, наиболее часто применяемый в Европе, в том числе в нашей стране, и Северной Америке. Антагонисты LТ-рецепторов принимают перорально. Это означает, что они оказывают системный эффект на аллергическое воспаление, тем самым обеспечивая целесообразность назначения при сочетании АР и бронхиальной астмы. В ряде исследований доказана эффективность подобной терапии, особенно у пациентов с АР и бронхиальной астмой.
В пункте 16 международных рекомендаций ARIA 2010 [18], составленных европейскими экспертами с позиции GRADE [19] – качества доказательств и силы рекомендаций, предлагается применение оральных антагонистов LT-рецепторов у взрослых и детей с сезонным АР и у детей дошкольного возраста с персистирующим АР. Кроме того, комбинация монтелукаста с ИнГКС рекомендуется при тяжелых симптомах АР (рис. 5). Таким образом, терапия антагонистами LТ-рецепторов (монтелукаст) у больных АР и сопутствующей бронхиальной астмой приводит к лучшему контролю обоих заболеваний.
ИнГКС – самые эффективные препараты в терапии АР. Они используются для лечения АР с 1973 г. Именно тогда появился первый препарат этой группы – беклометазона дипропионат.
В настоящее время на отечественном фармацевтическом рынке доступно много молекул ИнГКС: беклометазона дипропионат, будесонид, флутиказона пропионат, мометазона фуроат и флутиказона фуроат (табл. 2). Высокая эффективность ИнГКС при АР обусловлена их выраженным противовоспалительным действием и эффективным влиянием на все этапы патогенеза болезни. Эти препараты уменьшают количество тучных клеток и секрецию ими медиаторов аллергии, сокращают количество эозинофилов, Т-лимфоцитов, клеток Лангерганса в слизистой оболочке носа, ингибируют синтез простагландинов и лейкотриенов, подавляют экспрессию молекул адгезии. Указанные эффекты приводят к редукции тканевого отека и нормализации носового дыхания, уменьшению секреции слизистых желез, чувствительности рецепторов слизистой оболочки носа и прекращению ринореи и чихания, подавлению специфической и неспецифической назальной гиперреактивности. Современные формы ИнГКС хорошо переносятся пациентами и могут использоваться в качестве базисной терапии среднетяжелых/тяжелых форм АР без риска угнетения мукоцилиарного транспорта и развития атрофии слизистой оболочки. ИнГКС иногда вызывают местные побочные эффекты: сухость в носу, образование корочек, непродолжительные носовые кровотечения. Но эти осложнения не опасны и чаще связаны с неправильной техникой использования препарата, когда струя из пульверизатора направляется в сторону перегородки носа, а не на латеральную стенку полости носа.
Кроме того, необходимо соблюдать правило противоположной руки: инсуффляция в правую ноздрю осуществляется левой рукой, а в левую – правой.
Современные назальные ГКС практически лишены системного эффекта, что обусловлено их низкой системной биодоступностью, связанной с минимальной абсорбцией из желудочно-кишечного тракта и практически полной трансформацией в неактивные метаболиты при первом пассаже через печень. Например, у мометазона фуроата системная биодоступность всего 0,1%. Это означает, что современные ИнГКС могут длительно (в течение нескольких лет) использоваться в качестве базисной терапии персистирующего АР при очень незначительном риске развития системных побочных эффектов: угнетения гипоталамо-гипофизарно-надпочечниковой системы, замедлении роста у детей.
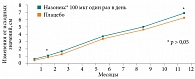
В рандомизированном двойном слепом плацебоконтролируемом исследовании с участием пациентов в возрасте от трех до девяти лет с круглогодичным АР применение мометазона фуроата (Назонекс®) в сравнении с плацебо в течение 12 месяцев не влияло на рост детей (рис. 6) [20]. В то же время применение флутиказона фуроата – назального спрея в дозе 110 мкг/сут в течение 52 недель привело к небольшому (на 0,27 см в год по сравнению с плацебо (95%-ный доверительный интервал, 0,48–0,06 cм/год)), но статистически значимому снижению темпов роста у детей препубертатного возраста [21]. При этом следует подчеркнуть, что оба препарата – мометазона фуроат и флутиказона фуроат – высокоэффективные ИнГКС в отношении симптомов АР. Это было продемонстрировано в восьминедельном рандомизированном слепом прямом сравнительном исследовании у пациентов с персистирующим аллергическим риноконъюнктивитом (рис. 7) [22].
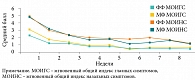
Как уже отмечалось, АР часто, особенно у пациентов с сезонными проявлениями, сопровождается симптомами конъюнктивита. Результаты клинических исследований и реальная практика свидетельствуют об эффективности ИнГКС в отношении симптомов не только ринита, но и конъюнктивита, обусловленной подавлением назоокулярного рефлекса [22, 23]. На рис. 8 представлены результаты метаанализа четырех исследований мометазона фуроата в отношении влияния на глазные симптомы у пациентов с сезонным АР [23]. Назонекс® достоверно уменьшал все глазные симптомы у больных сезонным АР (зуд/жжение, слезотечение и покраснение/гиперемия) (р ≤ 0,05). Эффективность Назонекса при окулярных симптомах АР связана с подавлением назально-окулярного рефлекса в результате выраженного противовоспалительного эффекта в слизистой оболочке носа.
Эффективность Назонекса изучали при синдроме обструктивного апноэ сна у пациентов с АР. 80 участников исследования в возрасте 30–50 лет со средним индексом массы тела 34 кг/м2 в течение шести недель получали мометазона фуроат 200 мкг/сут, дезлоратадин 10 мг/сут, их комбинацию или плацебо [15]. Отмечалось достоверное уменьшение индекса «апноэ – гипопноэ» и улучшение эффективности сна у пациентов, получавших мометазона фуроат + плацебо и мометазона фуроат + антигистаминный препарат (р < 0,05). При этом значимой разницы между группами мометазона фуроата и мометазона фуроата + антигистаминный препарат не выявлено (р > 0,05). У пациентов, принимавших мометазона фуроат, наблюдались значительное уменьшение сонливости (р < 0,05), повышение дневной активности и улучшение насыщения крови кислородом. Добавление антигистаминного препарата или плацебо результат не улучшало [15].
Многие пациенты, страдающие персистирующей бронхиальной астмой, имеют сезонные проявления АР, которые существенно влияют на течение астмы и снижают качество жизни больных. Таким пациентам следует назначать антигистаминные или антилейкотриеновые препараты либо ИнГКС по крайней мере за две недели до ожидаемого сезона пыления, что обусловлено наличием так называемого минимального персистирующего воспаления, развивающегося в слизистой оболочке носа в ответ на минимальный субклинический контакт с аллергеном [24].
Эффективность стратегии предсезонной профилактики продемонстрирована во многих клинических исследованиях и рекомендуется международным руководством ARIA [1].
Целесообразность стратегии предсезонной профилактики ИнГКС – мометазона фуроатом (Назонекс®) убедительно показана в двойном слепом плацебоконтролируемом исследовании [25]. Пациенты, применявшие интраназально мометазона фуроат за три недели до клинически значимой концентрации пыльцы японского кедра в воздухе, имели меньшую выраженность симптомов поллиноза и не отмечали обострения ринита и конъюнктивита в дни максимальной концентрации пыльцы по сравнению с больными, получавшими плацебо, и пациентами, начавшими лечение мометазона фуроатом с момента появления клинических симптомов. ИнГКС и другие препараты, используемые при сезонном АР (антигистаминные, антилейкотриеновые), целесообразно отменять спустя две – четыре недели после окончания сезона пыления. Это связано, во-первых, с наличием аллергического воспаления в слизистой оболочке носа в течение этого периода и, во-вторых, с наличием другого феномена – эффекта прайминга. Последний описан J.T. Connell еще в 1968 г. и по сути заключается в формировании специфической и неспецифической назальной гиперреактивности в результате множественных повторных контактов с аллергеном и развития аллергического воспаления [26].
Мометазона фуроат назальный спрей (Назонекс®) имеет самые широкие показания среди всех препаратов ИнГКС, зарегистрированных в нашей стране [27]:
-
сезонный и круглогодичный АР у взрослых, подростков и детей c двухлетнего возраста;
-
острый синусит или обострение хронического синусита у взрослых (в том числе пожилого возраста) и подростков с 12 лет – в качестве вспомогательного терапевтического средства при лечении антибиотиками;
-
профилактическое лечение сезонного АР среднетяжелого/тяжелого течения у взрослых и подростков с 12 лет (рекомендуется за две – четыре недели до предполагаемого начала сезона пыления);
-
полипоз носа, сопровождаемый нарушением носового дыхания и обоняния, у взрослых (от 18 лет);
-
острый риносинусит с легкими и умеренно выраженными симптомами без признаков тяжелой бактериальной инфекции у пациентов в возрасте 12 лет и старше.
Таким образом, современные ИнГКС эффективно контролируют симптомы среднетяжелого/тяжелого АР и способствуют оптимизации контроля сопутствующей бронхиальной астмы.
Отметим, что безусловным приоритетом в качестве системной терапии АР признана аллергенспецифическая иммунотерапия. Это метод, позволяющий модифицировать естественное течение заболевания и сократить потребность и объем фармакотерапии, превентирующий развитие бронхиальной астмы и обеспечивающий длительный эффект после окончания 3–5-летнего курса. Этот уникальный метод лечения аллергических IgE-обусловленных заболеваний может успешно сочетаться с фармакотерапией, впоследствии приводя к ее сокращению или отмене.
Заключение
Аллергический ринит – одно из самых распространенных аллергических заболеваний, встречающихся у пациентов всех возрастов.
Патогенетическую основу АР составляет эозинофильное воспаление в слизистой оболочке носа, что обусловливает высокую эффективность ИнГКС в контроле симптомов АР. В настоящее время международными сообществами предложена новая концепция ступенчатой терапии АР на основании контроля симптомов заболевания. ИнГКС являются самыми эффективными противовоспалительными препаратами для длительного контроля АР, особенно среднетяжелого/тяжелого течения.
В целях безопасного применения ИнГКС предпочтение следует отдавать современным молекулам ИнГКС, имеющим высокую эффективность, широкий спектр показаний и благоприятный профиль безопасности у взрослых и детей. Примером такого ИнГКС может служить мометазона фуроат (Назонекс®).
N.M. Nenasheva
Russian Medical Academy of Postgraduate Education
Contact person: Natalya Mikhaylovna Nenasheva, 144403@gmail.com
High incidence rate of allergic rhinitis, its impact on patients’ quality of life and relationship with bronchial asthma, chronic rhinosinusitis, otitis media underlie an important socio-medical relevance of the disease. Here we discuss etiology, pathogenesis, classification and the main stages used for diagnostics of allergic rhinitis. At the same time, a special attention is paid to the concept of a stepwise pharmacotherapy of allergic rhinitis viewed in terms of controlling disease symptoms. Modern molecules of intranasal glucocorticosteroids such as mometasone furoate are the most efficacious pharmacological drugs in reaching and maintaining control over symptoms of allergic rhinitis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.