Роль респираторных вирусов в развитии бронхиальной астмы и ее обострений: возможные пути терапевтического вмешательства
- Аннотация
- Статья
- Ссылки
- English
Введение
Бронхиальная астма (БА) является хроническим воспалительным заболеванием дыхательных путей, которое имеет высокую распространенность среди всех возрастных групп пациентов. Результаты эпидемиологических исследований свидетельствуют, что распространенность заболевания в нашей стране не отличается от таковой в других европейских странах. Частота текущих признаков БА (свистящее затрудненное дыхание за последние 12 месяцев) в популяции школьников 13–14 лет составляет в среднем 9,7%, варьируя в разных регионах РФ более чем в два раза [1]. У взрослых диагноз БА отмечается в 6,9% случаев [2].
Воспаление дыхательных путей и бронхиальная гиперреактивность (БГР) являются отличительными признаками БА. Но, как известно, тип воспаления при астме различен (эозинофильный, нейтрофильный или малогранулоцитарный), что в свою очередь может влиять на эффективность фармакотерапии. Тем не менее даже с учетом гетерогенности биологических и клинических фенотипов БА большинство пациентов достигают контроля заболевания на фоне применения ингаляционных глюкокортикостероидов (ИГКС) и бета-2-агонистов [3]. В то же время у пациентов с контролируемой БА респираторные вирусные инфекции (РВИ) способны привести к потере контроля над заболеванием и развитию обострения [4].
Роль респираторных вирусов в развитии бронхиальной астмы
В последнее время достигнут значительный прогресс в понимании роли вирусных инфекций в развитии БА. Вирусные инфекции, вызванные респираторными вирусами (рино-, метапневмо- и респираторно-синцитиальный (РС) вирус, вирус гриппа и парагриппа), относятся к наиболее частым провоцирующим факторам бронхообструктивного синдрома (БОС) у детей.
В одном из популяционных исследований показано, что наличие в анамнезе перенесенных в раннем детстве бронхиолитов или крупа, связанных с вирусной инфекцией, служит предиктором повышенной БГР и атопии впоследствии [5].
В проспективном исследовании с участием детей, рожденных от родителей-аллергиков, отмечались инфекции верхних дыхательных путей за один-два месяца до начала аллергического заболевания [6].
У детей, перенесших инфекции нижних дыхательных путей, вызванные РС-вирусом, риск развития синдрома свистящего дыхания (wheezing) в течение младшего школьного возраста выше по крайней мере в три-четыре раза [7–9]. Взаимосвязь между РС-инфекцией и последующим развитием БА меняется с возрастом и зависит от тяжести перенесенного РС-заболевания дыхательных путей.
Согласно результатам метаанализа, относительный риск развития астмы после РС-инфекции составляет 13–22% у детей в возрасте до пяти лет, 11–27% у детей в возрасте от пяти до 11 лет и 32% у детей 12 лет и старше [10]. Намного чаще БА развивается у детей с тяжелой, требующей госпитализации РС-инфекцией. Показано, что наличие риновирусов в период эпизодов свистящего дыхания является еще более сильным предиктором развития последующей астмы [11, 12].
Вероятность развития БА при индуцированных вирусом свистящих хрипах у детей в возрасте до трех лет, коррелирующих с наличием БА к шести годам, при риновирусной инфекции почти в четыре раза выше, чем при РС-вирусе (отношение шансов (ОШ) 9,8 и 2,6 соответственно), и достигает ОШ 10 для обоих вирусов, обнаруживаемых одновременно. То есть этиологическая роль риновирусов более значима [10, 13, 14].
Некоторые авторы считают, что ассоциация между вирусным заболеванием дыхательных путей и последующей БА зависит от сопутствующего атопического заболевания, предполагая, что на ранних этапах развития БА взаимосвязь между атопией и вирусной инфекцией нижних дыхательных путей может иметь решающее значение [11].
Вместе с тем противоречивые данные когортных исследований, посвященных изучению связи между фенотипом свистящего дыхания в раннем детском возрасте и развитием астмы, осложняют понимание взаимосвязи между свистящим дыханием в результате вирусного заболевания нижних дыхательных путей и последующей БА.
Дети, у которых БОС развивается в возрасте до трех лет, имеют эти проявления и к шести годам. Однако не у всех детей развивается персистирующий БОС. Кроме того, у ряда детей БОС возникает к шести годам и отсутствует в трехлетнем возрасте. Сказанное означает, что склонность к свистящему дыханию может быть преходящей и причины в разные возрастные периоды различны [15]. Например, к факторам, связанным с развитием БОС в возрасте до трех лет, относят маленький калибр дыхательных путей и курение матери. В то же время со свистящим дыханием, возникшим после трехлетнего возраста, ассоциированы повышенный уровень IgE в сыворотке крови и отягощенный анамнез по БА у матери [16]. Возможно, что вирусные инфекции нижних дыхательных путей не индуцируют собственно развитие БА, а скорее демаскируют предрасположенность к Тh2-иммунному ответу, который уже присутствует в период инфекции и позже манифестирует в виде БА [17, 18].
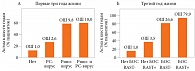
Наличие свистящего дыхания на фоне РВИ (РС-вирус и риновирус, особенно их сочетание) у детей первых трех лет жизни существенно повышает риск развития детской БА в последующие годы (рис. 1А) [19]. Сказанное относится и к сенсибилизации к аэроаллергенам у детей первых трех лет жизни. Сенсибилизация значимо повышает риск развития детской БА, который становится особенно высоким (ОШ 80) при сочетании с БОС в результате острых респираторных вирусных инфекций (рис. 1Б) [12, 20].
Респираторные вирусные инфекции – триггеры обострений астмы
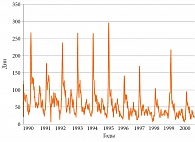
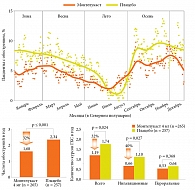
Существует множество неопровержимых доказательств связи обострений БА с РВИ. В исследовании N.W. Johnston и соавт. [21] с помощью метода полимеразной цепной реакции (ПЦР) доказана связь обострений БА с вирусной инфекцией у школьников, страдающих астмой. Пики обострений астмы, требующие стационарного лечения, чаще наблюдаются в сентябре – начало занятий в школе после летних каникул (рис. 2), что совпадает с пиком риновирусной инфекции. Как известно, пиковые периоды для риновирусной инфекции значительно отличаются от таковых для вируса гриппа [22] и имеют место в начале осени, в меньшей степени весной. Увеличение частоты риновирусной инфекции зарегистрировано в сентябре, спустя несколько дней после начала занятий в школе [22].
В Канадском исследовании респираторные вирусы выделены в 62% случаев, пикорнавирусы – в 52% случаев обострений БА. Эти же показатели в контрольной группе, в которую входили дети аналогичного возраста с БА такой же степени тяжести, но без обострения, требовавшего госпитализации, составили 41 и 29% соответственно. Риновирусы преобладали в группе пикорнавирусов. На их долю приходилось свыше 80% [21].
В более раннем исследовании, проведенном во Франции, изучали назальные аспираты от 75 детей, госпитализированных по поводу острого приступа астмы [23]. Вирусы, бактерии Chlamydia pneumoniae или Mycoplasma pneumoniae обнаружены в 71,9% случаев. Наиболее распространенным патогеном оказался риновирус (46,9%), за ним следовал РС-вирус (21,2%).
У взрослых обострения БА также часто связаны с респираторными вирусными инфекциями. В одних исследованиях эта частота достигает 80% [24], в других частота обнаружения вирусов существенно меньше при обострении БА у взрослых. 37% взрослых пациентов с обострением БА, потребовавших госпитализации, имели доказанные с помощью серологических методов респираторные инфекции. При этом риновирусы и вирусы гриппа встречались чаще [25].
В исследовании R.L. Atmar и соавт. частота ассоциации РВИ (применяли ПЦР для определения вирусов) и обострений БА у взрослых составила 55% [26].
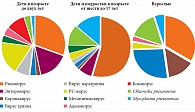
На рисунке 3 представлена частота ассоциаций различных видов вирусов и бактерий с обострениями БА у детей, подростков и взрослых [27].
Риновирусная инфекция у больных БА индуцирует снижение легочной функции, ухудшение симптомов, повышение БГР и увеличение эозинофильного воспаления, то есть основных признаков обострения БА. Причем выраженность этих проявлений зависит от иммунологических нарушений – дефицита интерферона (ИФН) гамма и интерлейкина (ИЛ) 10, повышения ИЛ-4, ИЛ-5 и ИЛ-13 [28]. Аллергены и вирусы действуют как синергисты в отношении развития обострения БА, что было показано в исследовании R.M. Green и соавт. [29] с участием 60 пациентов с БА в возрасте 17–50 лет, госпитализированных по поводу обострения БА в течение года. В контрольную группу входили пациенты со стабильной БА, наблюдавшиеся в поликлиническом отделении. Зафиксирован высокий риск развития обострения БА, что требовало госпитализации в случае сочетания высокой экспозиции аллергена и выявления респираторных вирусов.
Еще одно убедительное доказательство центральной роли респираторных вирусов в развитии обострений аллергической IgE-обусловленной детской, подростковой БА и астмы у молодых взрослых основано на результатах исследования эффективности моноклональных антител к IgE (омализумаб).
Например, в двойном слепом плацебоконтролируемом мультицентровом исследовании с участием 419 городских жителей в возрасте от шести до 20 лет, страдавших персистирующей аллергической БА, сравнивали эффективность омализумаба с таковой плацебо [30]. Показано, что у пациентов, получавших омализумаб, значительно реже развивались обострения БА, особенно в период сезонных пиков РВИ (осенью и весной). Улучшение течения БА на фоне терапии омализумабом проявлялось, несмотря на редукцию дозы ИГКС и бета-2-агонистов длительного действия (ДДБА).
Таким образом, несмотря на разный дизайн, все исследования показывают, что вирусные инфекции участвуют примерно в 50% обострений астмы у взрослых и почти в 80% обострений у детей. Чаще в обострения БА вовлечены риновирусы.
Бактериальные инфекции, действуя независимо от вирусов [31] или в качестве кофакторов [32], также могут быть связаны с развитием свистящего дыхания у детей и обострениями БА. Атипичные бактерии, например Mycoplasma pneumoniae и Chlamydia pneumoniae, а также грибы в случае аллергического бронхолегочного аспергиллеза могут играть определенную роль в индукции БА и ее обострений. В то же время Lactobacillus и Helicobacter pylori играют протективную роль в отношении БА [33].
В исследовании H. Bisgaard и соавт. подтверждена связь между неонатальной гипофарингеальной колонизацией Haemophilus influenzae, Streptococcus pneumoniae и Moraxella catarrhalis и последующим повышением риска развития свистящего дыхания и детской БА [31]. Авторами продемонстрирована аналогичная частота свистящего дыхания у дошкольников, связанная как с бактериальными патогенами, так и с респираторными вирусами.
Проспективный мониторинг назального секрета детей c астмой и без нее в осенний период показал, что риновирусная инфекция связана с повышенным обнаружением бактериальных патогенов [32]. Более того, выявление S. pneumoniae или M. catarrhalis вместе с риновирусами обусловлено большей тяжестью заболевания и повышенным риском развития индуцированного вирусом обострения астмы по сравнению с изолированной риновирусной инфекцией.
Вероятные пути развития астмы и ее обострений вследствие респираторных вирусных инфекций
В настоящее время бытует мнение, что развитие астмы в детском возрасте является многофакторным процессом, включающим генетическую предрасположенность и воздействие факторов окружающей среды в критические моменты времени, в период развития ребенка. Такими факторами являются вирусные респираторные инфекции, задержка созревания иммунной системы [34] и аллергическая сенсибилизация [12]. На сегодняшний день временная связь между этими факторами не установлена. Возможно развитие свистящего дыхания и БА в результате вирусной респираторной инфекции и влияния сопутствующих/отягощающих факторов (сниженная функция легких, узкий просвет дыхательных путей, экспозиция с табачным дымом, нарушенная противовирусная защита (снижение синтеза ИФН), отягощенная наследственность).
Одна из гипотез, объясняющих взаимосвязь респираторных вирусных инфекций с атопическими заболеваниями, в том числе БА, заключается в том, что в ответ на респираторные вирусы, в частности РС-вирусы, синтезируются вирус-специфические и неспецифические IgE [35, 36], которые способны стимулировать экспрессию высокоаффинных IgE-рецепторов (FcεRI) на легочных дендритных клетках [37]. Связывание молекулой IgE двух FcεRI на дендритной клетке приводит к продукции ССL28, хемокина, который антиген-неспецифическим образом рекрутирует ИЛ-13 продуцирующие Тh2-клетки, участвующие в формировании поствирусного атопического заболевания [38–40].
В ряде исследований показано, что экспозиция с аллергеном в период вирусной инфекции приводит к повышенной сенсибилизации к данному аллергену и увеличению бронхиальной гиперреактивности [41].
Кроме того, эпителиальные клетки дыхательных путей рассматриваются как активные стражи и координаторы антивирусного ответа в легких. Они являются основными клетками, продуцирующими ИФН, и экспрессируют сотни ИФН-стимулированных генов в ответ на вирусную инфекцию. ИФН-гены кодируют белки, которые ингибируют вирусную продукцию прямо или косвенно путем активации иммунных клеток, убивая пораженные вирусом клетки, а транскрипционный фактор STAT1 является ключевым регулятором экспрессии этих генов [42]. Функциональный уровень антивирусного ответа коррелирует со степенью защиты организма. Возможно, поэтому дефицит в интерфероновом ответе делает некоторых людей восприимчивыми к вирусиндуцированному дебюту БА и/или вирусиндуцированному обострению уже существующей астмы.
Данные, полученные в экспериментальных исследованиях на животных, и результаты эпидемиологических исследований свидетельствуют, что более тяжелые вирусные инфекции с высокой долей вероятности приводят к формированию БА [43].
В некоторых исследованиях показан дефицит в продукции ИФН-бета и ИФН-лямбда эпителиальными клетками больных БА в ответ на риновирусную инфекцию дыхательных путей [44, 45]. Несмотря на это, пока нельзя определенно сказать, что дефект в ИФН-зависимом контроле вирусной репликации является механизмом, запускающим БА или инициирующим ее обострение [42, 46].
Может ли традиционная фармакотерапия бронхиальной астмы предотвращать вирусиндуцированное обострение?
Результаты крупных рандомизированных клинических исследований и реальная клиническая практика свидетельствуют, что даже низкие дозы ИГКС снижают число обострений и риск смертельных исходов БА [47]. Например, в исследовании OPTIMA низкие дозы будесонида (100 мкг дважды в день) способствовали 60%-ному снижению числа тяжелых обострений БА по сравнению с отсутствием терапии ИГКС [48]. Добавление к ИГКС ДДБА еще больше снижает частоту обострений БА [49].
В большинстве исследований не изучалась причина обострений БА. Учитывая, что по крайней мере половина из них провоцируются респираторными вирусами, можно предположить снижение частоты вирусиндуцированных обострений на фоне адекватной терапии ИГКС и ИГКС/ДДБА. Вместе с тем вирусиндуцированные обострения БА могут развиваться и на фоне лечения ИГКС [4].
В проспективном мультицентровом исследовании с участием 413 больных БА определяли факторы, способные предсказать потерю контроля заболевания вследствие РВИ [50]. В результате не установлено связи потери контроля с терапией ИГКС или ИГКС/ДДБА, с предшествующими простудными заболеваниями, их частотой и тяжестью, но выявлена связь с тяжестью симптомов настоящей простуды в первые два дня. Это очень важный факт, свидетельствующий прежде всего о том, что респираторные вирусы различаются патогенностью. Даже серотипы одного вируса могут вызывать абсолютно разный врожденный иммунный ответ in vitro [51]. Показано, что серотип С риновируса вызывает более тяжелую инфекцию у детей [52], а значит, с большей долей вероятности может привести к развитию или обострению БА. Кроме того, видимо, имеет значение гипотеза «гены – вирусы» [53], когда взаимодействие специфического вируса и генетически детерминированный иммунный ответ пациента будут определять, произойдет обострение БА или нет.
Результаты ряда исследований in vitro показали, что ГКС подавляют высвобождение цитокинов, вызванное риновирусами и РС-вирусами [54, 55]. Это подтверждает концепцию, что применение ГКС in vivo подавляет вирусиндуцированное воспаление. Следовательно, у пациентов с низкой приверженностью лечению ИГКС будет худший прогноз относительно исхода БА, в том числе вследствие вирусиндуцированных обострений БА. Вместе с тем относительная ГКС-резистентность, то есть снижение эффективности ГКС, может развиваться в условиях вирусной инфекции и участвовать в формировании обострений БА.
В исследовании H. Reddel и соавт. [4] показано, что, несмотря на хороший контроль БА с помощью ИГКС, обострения, связанные с простудой, все-таки развиваются.
В недавнем исследовании in vitro выявлен молекулярный механизм развития ГКС-резистентности в пораженных риновирусом эпителиальных клетках дыхательных путей [56]. Речь идет о нарушении экспрессии стероид-зависимых генов, связи ГКС с ГКС-рецептором, транслокации этого комплекса в ядро и процессов трансактивации/трансрепрессии. Если обратиться к экспериментальным моделям вирусной инфекции на эпителиальных клетках больных БА, то уменьшения риновирусиндуцированного воспаления на фоне применения фиксированных доз ИГКС не отмечается [57, 58]. Даже применение перорального преднизолона оказывается неэффективным в контроле риновирусиндуцированных симптомов БА [59] и, напротив, повышает титр вирусов [60].
В клинических исследованиях также показаны отсутствие эффекта от увеличения в два раза дозы ИГКС при первых признаках обострения БА [61, 62] и скромный эффект от увеличения дозы ИГКС в четыре раза [63].
Безусловно, относительную ГКС-резистентность можно преодолеть за счет повышения дозы ГКС. Высокие дозы ИГКС (флутиказона пропионата 750 мкг дважды в день) оказались эффективными в предотвращении развития тяжелого вирусиндуцированного бронхообструктивного синдрома у детей, требовавшего применения системных ГКС [64]. Однако такие дозы ИГКС характеризуются рядом нежелательных побочных эффектов и влияют на рост детей.
Таким образом, ИГКС, будучи самыми эффективными препаратами в достижении и поддержании контроля БА, не всегда способны в полной мере повлиять на предотвращение вирусиндуцированных обострений БА.
Помимо возможного снижения эффективности ИГКС в период РВИ отмечается снижение эффекта основных бронхолитических препаратов – бета-2-агонистов.
В исследовании H. Reddel и соавт. [4] получено первое объективное свидетельство снижения эффективности бета-2-агонистов у пациентов с БА в период РВИ. Авторы проводили мониторинг пиковой скорости выдоха (ПСВ) до и после терапии ИГКС будесонидом. Зафиксированы высокая вариабельность ПСВ до начала лечения, ее уменьшение после терапии ИГКС, сопровождавшееся повышением показателей ПСВ и лучшим контролем БА. Несмотря на достижение хорошего контроля БА на фоне терапии ИГКС, зарегистрировано 39 обострений БА, связанных с простудными заболеваниями верхних дыхательных путей (РВИ). В таких случаях отмечалось снижение ПСВ, восстановление которой происходило в течение 7–14 дней. В этот период значения вечерней ПСВ и ПСВ, измеренной после применения бета-2-агонистов, не превышали показатели утренней ПСВ и ПСВ до применения бета-2-агонистов, что свидетельствовало о нарушенном ответе на бета-2-агонисты. При этом в период вирусных обострений БА дневная вариабельность ПСВ у пациентов не отличалась значимо от вариабельности ПСВ, полученной в период хорошего контроля БА. Результаты данного наблюдения говорят о том, что патофизиологический механизм вирусных обострений БА отличается от такового нелеченой или плохо контролируемой БА [65].
Потенциальных механизмов, с помощью которых вирусные инфекции ограничивают эффективность бета-2-агонистов, несколько. Первый из них – избыточная продукция слизи [66], затрудняющая достижение бета-2-рецепторов препаратом бета-2-агониста. Не в пользу данного механизма свидетельствует достаточно высокая эффективность бета-2-агонистов при таких заболеваниях, как хроническая обструктивная болезнь легких и муковисцидоз, характеризующихся высокой продукцией слизи в нижних дыхательных путях. Второй предполагаемый механизм снижения эффективности бета-2-агонистов при РВИ – развитие толерантности. Третий механизм связан с обструкцией в результате вирусного воспаления, проявляющегося повышенной проницаемостью сосудов бронхиальной стенки и развитием отека слизистой оболочки дыхательных путей [65]. Однако наиболее вероятный механизм предложен в экспериментальной работе D. van Ly и соавт. [67], показавших развитие десенситизации бета-2-адренорецепторов в результате РВИ, в частности обусловленной риновирусами и РС-вирусами. Как известно, риновирусы достигают, заражают и реплицируются в эпителиальных клетках не только верхних, но и нижних дыхательных путей человека [68]. Этим объясняется использование in vitro модели системы совместного культивирования, в которой эпителиальные клетки, зараженные риновирусом, и кондиционированная среда применялись для обработки гладкомышечных клеток дыхательных путей человека перед оценкой функции бета-2-адренорецепторов. Снижение бета-2-агонист-индуцированного циклического аденозинмонофосфата в обработанных гладкомышечных клетках расценивалось как результат репликации вируса. С использованием проточной цитометрии оценивали мембранный и общий уровень бета-2-адренорецепторов в гладкомышечных клетках. Показано снижение мембранной экспрессии рецепторов после обработки клеток, что подтверждало развитие десенситизации [68]. Вирусная РНК стимулировала синтез простагландинов (ПГ) эпителиальными, гладкомышечными клетками и фибробластами, среди которых ПГE2, ПГF2-альфа и ПГI2 обладали способностью вызывать десенситизацию бета-2-адренорецепторов гладкомышечных клеток дыхательных путей. Механизм развития десенситизации бета-2-адренорецепторов гладкомышечных клеток дыхательных путей вследствие РВИ предполагает:
- заражение и репликацию риновирусом эпителиальных клеток дыхательных путей;
- высвобождение вирионов и вирусной РНК;
- обнаружение вирусной РНК в гладкомышечных клетках дыхательных путей;
- стимулирование синтеза ПГ.
Далее ПГ действуют аутокринным путем и вызывают десенситизацию бета-2-адренорецепторов [65].
Таким образом, механизм развития обострения БА в результате РВИ включает:
- активацию воспаления в слизистой оболочке нижних дыхательных путей;
- повышение парасимпатического тонуса вследствие снижения вирусами экспрессии М2-рецепторов;
- повышение бронхиальной гиперреактивности;
- повышение синтеза цистеиниловых лейкотриенов (цис-ЛТ) в слизистой оболочке верхних и нижних дыхательных путей;
- снижение эффективности ИГКС (возможно развитие относительной ГКС-резистентности);
- развитие десенситизации бета-2-адренорецепторов в результате избыточного синтеза простагландинов.
Роль антагонистов лейкотриеновых рецепторов в терапии и профилактике вирусиндуцированных обострений бронхиальной астмы
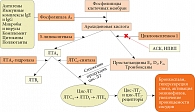
В основе БА, равно как и аллергического ринита (АР), лежит аллергическое воспаление. Его формируют множество клеток и медиаторов, в том числе цис-ЛТ, к которым относятся ЛТС4, ЛТD4, ЛТЕ4 и ЛТВ4. Эти липидные медиаторы, образуемые из арахидоновой кислоты под действием 5-липоксигеназы (рис. 4):
- являются мощными провоспалительными медиаторами, вызывающими бронхоконстрикцию, гиперсекрецию слизи и нарушение ее клиренса;
- усиливают приток эозинофилов и других воспалительных клеток;
- повышают проницаемость кровеносных сосудов в 100 раз эффективнее гистамина;
- стимулируют пролиферацию и дифференцировку миофибробластов, тем самым способствуя развитию субэпителиального фиброза [69–72].
Цис-ЛТ являются важными медиаторами в развитии вирусиндуцированных обострений БА [73]. Однако исследований in vitro и in vivo, посвященных этой проблеме, немного.
Респираторные вирусные инфекции активируют 5-липоксигеназу в слизистой оболочке бронхов, что было показано у здоровых субъектов в период легкой риновирусной инфекции [74]. Таким образом обеспечивается повышенный синтез цис-ЛТ в нижних дыхательных путях. Увеличение концентрации цис-ЛТ, в частности ЛТС4, отмечалось в назальном секрете взрослых пациентов в период риновирусной, РС-вирусной инфекции и гриппа А [75], что свидетельствовало о повышенном синтезе цис-ЛТ в дыхательных путях в период острых респираторных вирусных инфекций.
В исследованиях на животных также было показано повышение цис-ЛТ в легочной ткани мышей и крыс, зараженных РС-вирусом [76]. У детей с РС-вирусиндуцированным бронхиолитом и синдромом свистящего дыхания наблюдался повышенный уровень цис-ЛТ в назофарингеальном секрете [77].
Цис-ЛТ усиливают вирусиндуцированное воспаление в дыхательных путях, активируя легочные дендритные клетки [76], потенцируя эффекты воспалительных нейропептидов [78] и проявляя собственную фармакологическую активность.
Кроме того, респираторные вирусы повышают синтез ИФН-гамма [77], который в свою очередь способствует экспрессии рецепторов 1-го типа к цис-ЛТ [79], усиливая активность этих медиаторов. Подавляющее большинство фармакологических эффектов цис-ЛТ, имеющих отношение к патофизиологии БА и аллергического ринита, реализуется через активацию специфических цис-ЛТ1-рецепторов, расположенных на тучных клетках, моноцитах и макрофагах, эозинофилах, базофилах, нейтрофилах, Т- и В-лимфоцитах, гладкомышечных клетках, бронхиальных фибробластах и эндотелиальных клетках. Поэтому применение фармакологических препаратов – антагонистов цис-ЛТ1-рецепторов (монтелукаст, зафирлукаст и пранлукаст) является эффективной и хорошо известной фармакотерапией БА и АР у взрослых и детей.
В нашей стране зарегистрирован и успешно применяется монтелукаст, доступный как в виде оригинального препарата, так и нескольких дженерических аналогов. Одним из дженериков монтелукаста с доказанной биоэквивалентностью оригинальному препарату является Монтелар® [80].
В открытом исследовании, проведенном с участием 40 взрослых здоровых субъектов, фармакокинетический профиль и биодоступность Монтелара соответствовали таковым оригинального препарата Сингуляр®. Авторы сделали заключение, что эти два препарата можно считать взаимозаменяемыми в клинической практике [80].
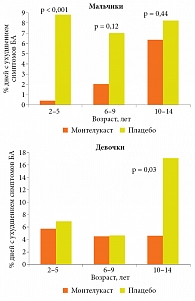
Антагонисты лейкотриеновых рецепторов способны эффективно предотвращать развитие обострений у больных с легкой БА [81, 82]. В двойном слепом плацебоконтролируемом исследовании N.W. Johnston и соавт. [82] изучали эффективность монтелукаста, добавленного к обычной терапии БА, в отношении сокращения дней с ухудшением симптомов астмы и незапланированных визитов к врачу в течение осеннего пика (с 1 сентября по 15 октября 2005 г.) у детей разных возрастных групп. Как показали результаты исследования (рис. 5) [81], в группе терапии монтелукастом имела место 53%-ная редукция дней с ухудшением симптомов в отличие от группы плацебо (3,9 и 8,3% соответственно) и 78%-ное сокращение незапланированных визитов к врачу по поводу БА (4 и 18 соответственно). Примечательно, что монтелукаст был эффективен у детей, получавших регулярную терапию ИГКС, и у тех, кто не получал ее, а также у пациентов с проявлениями РВИ во время исследования, и у тех, кто не отметил таких проявлений. Выявлена некая разница в эффективности в зависимости от возраста и пола. У мальчиков в возрасте от двух до пяти лет эффективность монтелукаста была выше, чем у более старших мальчиков (0,4% по сравнению с 8,8% дней с ухудшением симптомов БА). Среди девочек более значимый эффект имел место в возрасте от десяти до 14 лет (4,6% – в группе монтелукаста, 17,0% – в группе плацебо).
В исследовании H. Bisgaard и соавт. [83] изучалась эффективность монтелукаста в предотвращении вирусиндуцированных обострений БА у детей в возрасте от двух до пяти лет с интермиттирующей БА. Это было 12-месячное двойное слепое плацебоконтролируемое исследование, в котором участвовали пациенты с вирусиндуцированными обострениями БА и минимальными проявлениями вне этих обострений в анамнезе. Пациенты получали 4 мг монтелукаста или плацебо однократно на протяжении 12 месяцев. Применение монтелукаста способствовало значительному (на 31,9%) снижению числа обострений БА и увеличению времени до первого обострения БА на два месяца по сравнению с плацебо (р = 0,024). Кроме того, у детей, получавших монтелукаст, отмечалось сокращение курсов ИГКС по сравнению с плацебо (р = 0,027) (рис. 6).
Метаанализ клинических исследований влияния монтелукаста на БОС, развивающийся в результате РС-вирусного бронхиолита у маленьких детей, показал, что препарат способен снижать частоту БОС без развития каких-либо значимых побочных эффектов [84].
В небольшом пилотном исследовании с участием взрослых пациентов продемонстрирована эффективность добавления антагониста ЛТ-рецепторов (пранлукаста) к пероральному преднизолону при вирусиндуцированном (РС-вирус или вирус гриппа был определен в назофарингеальном смыве большинства больных) обострении БА [85]. Добавление пранлукаста способствовало уменьшению кумулятивной дозы преднизолона и времени, необходимого для купирования обострения.
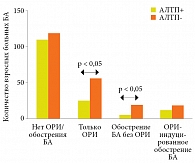
Теми же авторами выполнено ретроспективное когортное исследование эффективности терапии антагонистами лейкотриеновых рецепторов для предотвращения индуцированных респираторными инфекциями верхних дыхательных путей обострений БА у взрослых пациентов [86]. В исследовании участвовал 321 пациент (средний возраст – 56,3 ± 17,2 года). 137 пациентов принимали антилейкотриеновые препараты (АЛТП) один раз в день в качестве постоянной противоастматической терапии, 184 пациента не принимали АЛТП. Период наблюдения составил один год. Согласно полученным данным, АЛТП значимо снижали частоту острых респираторных инфекций (ОРИ) верхних дыхательных путей и обострений БА, не связанных с ОРИ, а на частоту ОРИ-индуцированных обострений БА АЛТП не оказали существенного влияния (рис. 7). При этом АЛТП способствовали сокращению длительности, но не тяжести ОРИ, которые отмечались у 79 пациентов.
Итак, РВИ часто вызывают обострения БА не только у детей, но и у взрослых, причем эти обострения могут быть редуцированы с помощью регулярной терапии ИГКС [87]. Повысить эффективность ИГКС и одновременно снизить их дозу можно за счет добавления ДДБА или АЛТП.
Как уже отмечалось, уровень цис-ЛТ повышается при вирусиндуцированном обострении БА [75, 88], ГКС практически не влияют на их продукцию [89], что делает вполне обоснованным назначение АЛТП пациентам с частыми вирусиндуцированными обострениями БА. Кроме того, высокая распространенность курения, ожирения и избыточной массы тела среди взрослых пациентов с БА не позволяет достичь оптимального уровня контроля заболевания при использовании монотерапии ИГКС и нередко приводит к формированию относительной ГКС-резистентности [90, 91]. Аспириновая БА является еще одним фенотипом астмы, при котором можно наблюдать максимальную эффективность АЛТП [92].
Правомерность данного подхода демонстрирует исследование, проведенное в реальной клинической практике. Реальная клиническая практика отличается от рандомизированных клинических исследований, включающих, как правило, «рафинированных» пациентов с БА. Критерии включения в эти исследования не позволяют участвовать в них курящим пациентам с БА, пациентам со значимыми сопутствующими заболеваниями и коморбидными состояниями, пациентам с недостаточной обратимостью обструкции бронхов, а также пожилым пациентам.
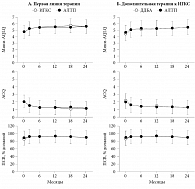
D. Price и соавт. [93] в условиях реальной клинической практики провели два исследования продолжительностью два года каждое. В первом (326 пациентов) сравнили эффективность антагонистов ЛТ-рецепторов (монтелукаст, зафирлукаст) и ИГКС в качестве начальной терапии БА у пациентов, не получавших ранее лечение для контроля симптомов. Во втором (361 пациент) сравнили антагонисты ЛТ-рецепторов (монтелукаст, зафирлукаст) и ДДБА в качестве дополнительной терапии у пациентов с БА, не контролируемой на монотерапии ИГКС. Основным критерием оценки служил мини-вопросник о качестве жизни с БА (мини-AQLQ). Еще одним критерием был вопросник о контроле БА – ACQ. Кроме того, в исследовании оценивали частоту обострений БА (назначение пероральных ГКС или госпитализация). Результаты этих исследований, оцениваемые по избранным критериям, представлены на рис. 8.
В данных исследованиях антагонисты ЛТ-рецепторов по эффективности оказались эквивалентны ИГКС в качестве базисной терапии первой линии для лечения БА и ДДБА, в качестве дополнительной терапии у пациентов, уже получавших ИГКС. По крайней мере эта эквивалентность была достоверно показана через два месяца терапии. Эквивалентность, оцененная через два года терапии, была недостоверной по главному критерию мини-AQLQ, но динамика второстепенных критериев (ACQ и ПСВ) оказалась одинаковой в группах сравнения. Исследования продолжались два года, поэтому их результаты отражают реальную клиническую практику со всеми ее преимуществами (разнообразие пациентов) и недостатками (отсутствие объективного плацебо-контроля).
В этих исследованиях зарегистрирована высокая приверженность больных лечению антагонистами ЛТ-рецепторов: в первом исследовании – 65% (ИГКС – 41%), во втором – 74% (ДДБА – 46%).
Таким образом, монтелукаст может быть использован в качестве эффективной монотерапии БА или в качестве дополнительной терапии к ИГКС. Преимуществами препарата являются безопасность при длительном применении, низкий риск побочных эффектов, быстрое начало действия и достижение максимального эффекта.
Пероральная форма монтелукаста и однократное применение в день, что особенно важно для детей, повышают приверженность лечению и способствуют удовлетворенности пациентов от терапии.
Заключение
Респираторные вирусные инфекции (риновирус и РС-вирус, особенно их сочетание) являются наиболее частой причиной развития бронхообструктивного синдрома у маленьких детей и наиболее частыми триггерами обострений бронхиальной астмы у детей, подростков и взрослых с уже установленным диагнозом заболевания.
Цистеиниловые лейкотриены, в избытке образующиеся при РВИ, усиливают вирусиндуцированное воспаление в дыхательных путях, участвуя наравне с другими медиаторами в формировании вирусиндуцированных обострений БА.
Антилейкотриеновый препарат монтелукаст характеризуется доказанной эффективностью в отношении профилактики вирусиндуцированных обострений БА у детей и подростков. В реальной клинической практике эффективность монтелукаста сопоставима с ИГКС в качестве монотерапии и с ДДБА в качестве дополнительной терапии к ИГКС. Монтелукаст может стать альтернативой для детей с астмой, чьи родители боятся применять ГКС-препараты.
Применение монтелукаста способствует улучшению контроля астмы и аллергического ринита, сокращает потребность в ГКС-препаратах, число незапланированных визитов к врачу и пропуски рабочих и учебных дней. Взрослые больные БА, особенно курильщики, пациенты с аспириновой БА и выраженным постнагрузочным бронхоспазмом, могут получить дополнительную пользу в результате применения монтелукаста в виде монотерапии или комбинированной с ИГКС терапии.
N.M. Nenasheva
Russian Medical Academy of Postgraduate Education
Contact person: Natalya Mikhaylovna Nenasheva, 144031@gmail.com
Respiratory viral infections are the most common cause resulting in development of bronchial obstructive syndrome (BOS) in early children, and in children, adolescents and adults most frequently trigger exacerbations of bronchial asthma (BA). Moreover, BOS in children sick with respiratory viral infections, especially caused by rhinoviruses or RSV, is associated with elevated risk of developing BA in the future.
The majority of patients suffering from BA well respond to treatment with inhaled glucocorticosteroids and beta-2-agonists; however, such agents may exhibit insufficient efficacy in therapy of virus-induced exacerbations of BA. Here, an interaction between respiratory viruses, allergens and BA, causes of developing virus-induced BA exacerbations as well as a role of anti-leukotriene drugs in BA therapy of and prevention of virus-induced exacerbations are discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.