Дулаглутид – новое в лечении сахарного диабета 2 типа
- Аннотация
- Статья
- Ссылки
- English
В статье представлены результаты программы международных клинических исследований AWARD агониста рецепторов глюкагоноподобного пептида 1 дулаглутида.
В статье представлены результаты программы международных клинических исследований AWARD агониста рецепторов глюкагоноподобного пептида 1 дулаглутида.






Введение
Возрастание популяции больных сахарным диабетом (СД) и частоты развития хронических осложнений, особенно сердечно-сосудистых и почечных, стало одной из актуальных проблем мирового сообщества. Так, с 70-х гг. прошлого века распространенность сахарного диабета 2 типа стремительно увеличивается. Согласно данным экспертов Всемирной организации здравоохранения (ВОЗ), с 1980 по 2017 г. количество таких больных повысилось с 108 до 425 млн [1]. Кроме того, по прогнозам экспертов ВОЗ, в 2030 г. патология будет занимать седьмое место среди причин смерти [2].
За последние несколько лет открыты новые патофизиологические механизмы СД 2 типа. В результате существенно изменились методы его диагностики, профилактики и лечения. Речь, в частности, идет о появлении новых аналогов инсулина, классов сахароснижающих препаратов, средств постоянной подкожной инфузии инсулина (помпах), приборов для непрерывного мониторинга гликемии.
В то же время до сих пор не дан ответ в отношении приоритетного препарата, который следует добавлять при неудовлетворительной компенсации СД 2 типа на фоне монотерапии метформином (либо назначить в качестве первого при невозможности приема метформина). Ясно одно – предпочтение должно быть отдано препаратам с минимальными побочными эффектами.
Необходимо отметить, что агонисты рецепторов глюкагоноподобного пептида 1 (ГПП-1) и ингибиторы дипептидилпептидазы 4 (ДПП-4) в силу ряда преимуществ (усиление глюкозозависимой активности β-клеток, низкий риск гипогликемий, подавление повышенной секреции глюкагона, контроль массы тела) заняли достойное место в сахароснижающей терапии СД 2 типа.
Предположение о роли инкретинов в метаболизме впервые было выдвинуто W. Bayliss и E. Starling в 1902 г. [3]. Британские ученые обнаружили, что введение соляной кислоты в желудочно-кишечный тракт стимулирует экзокринную функцию поджелудочной железы за счет гормона, содержащегося в кишечной слизи, и назвали этот гормон «секретин». C.J. Martin описал данное открытие так: «Я случайно присутствовал на их открытии. У анестезированной собаки петля тощей кишки была перевязана с обоих концов, и нервы, иннервирующие ее, были рассечены так, что тощая кишка была связана с остальной частью тела только кровеносными сосудами. При введении небольшого количества слабой соляной кислоты в двенадцатиперстную кишку отмечалась секреция поджелудочной железы, которая продолжалась в течение нескольких минут. К нашему удивлению, повторное введение соляной кислоты аналогично влияло на секрецию поджелудочной железы. Я помню, как Starling говорил: „Скорее всего это химический рефлекс“. Быстро отрезав еще один участок тощей кишки, он протер ее слизистую оболочку слабым раствором соляной кислоты, отфильтровал и ввел в яремную вену животного. Через несколько мгновений поджелудочная железа ответила гораздо большей секрецией, чем раньше. Это был отличный день» [4].
Через четыре года, в 1906 г., B. Moore и соавт. опубликовали статью «Лечение сахарного диабета при помощи экстракта слизистой двенадцатиперстной кишки» [5]. Ее авторы предположили, что секретины могут воздействовать не только на экзокринную, но и на эндокринную часть поджелудочной железы. Ученые выделили экстракт слизистой оболочки двенадцатиперстной кишки и назначали его пациентам с глюкозурией. На фоне такого лечения отмечалось снижение глюкозурии, улучшение самочувствия и набор сниженной массы тела. Данный препарат стал предшественником нового класса препаратов – инкретинов.
Термин «инкретин» для обозначения экстракта слизистой оболочки верхнего отдела кишечника, вызывающего снижение гликемии, но не влияющего на экзокринную функцию поджелудочной железы, был введен лишь в 1932 г. J. La Barre. Только через 30 лет H. Elrick и соавт. (1964 г.) и M. Perley и соавт. (1967 г.) доказали, что при одинаковом уровне гликемии секреция инсулина в ответ на пероральную нагрузку глюкозой в полтора – два раза превышает таковую в ответ на внутривенную инфузию [6, 7]. Так был открыт инкретиновый эффект. Инкретиновая активность – это суммарный эффект активации энтериновой системы, в результате которой повышается стимуляция секреции инсулина при пероральном применении глюкозы по сравнению с внутривенным ее введением.
Инкретины желудочно-кишечного тракта и их антигипергликемические эффекты
В настоящее время выделяют два вида инкретинов: глюкозозависимый инсулинотропный полипептид (ГИП) и ГПП.
ГИП – это первый гормон с инкретиновой активностью. Он был выделен в 1973 г. из экстракта дуоденальной слизи свиньи. Позднее, в 1983 г., из проглюкагона хомяка выделили последовательность двух ГПП – ГПП-1 и ГПП-2. Однако было доказано, что только ГПП-1 стимулирует секрецию инсулина, следовательно, обладает инкретиновой активностью.
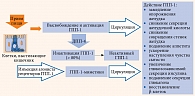
Антигипергликемический эффект ГПП-1 достигается за счет нескольких механизмов действия (рис. 1) [8]:
- глюкозозависимая стимуляция секреции инсулина и подавление секреции глюкагона (механизм защиты от развития гипогликемических состояний);
- снижение моторики желудка и всасывания глюкозы после еды (механизм регуляции постпрандиальной гликемии);
- устранение инсулинорезистентности периферических тканей (мышц, жировой ткани) и снижение продукции глюкозы печенью;
- воздействие на ядра гипоталамуса, что обеспечивает быстрое насыщение и снижение аппетита;
- благоприятное влияние на сердечно-сосудистую систему (снижение артериального давления, увеличение сердечного выброса и улучшение коронарного кровотока).
ГПП-1 оказывает эффекты менее двух минут вследствие быстрой дегидратации и потери инсулинотропного действия под влиянием сериновой протеазы – дипептидилпептидазы 4. Последняя присутствует во многих органах и тканях [9].
В ряде исследований установлено, что в патогенезе СД 2 типа важную роль играют не только инсулинорезистентность и относительная/абсолютная недостаточность инсулина, но и нарушения, связанные с системой инкретинов. У пациентов с СД 2 типа при проведении глюкозотолерантных тестов инкретиновый эффект отсутствовал или был снижен на 20–30%. Именно поэтому наиболее перспективными для коррекции углеводного обмена у пациентов с СД 2 типа признаются препараты, эффекты которых связаны с действием инсулинотропного гормона ГПП-1. Это резистентные к действию ДПП-4 миметики и аналоги ГПП-1 (с 2006 г.), а также ингибиторы ДПП-4 (с 2007 г.).
Агонисты рецепторов глюкагоноподобного пептида 1
В настоящее время в России зарегистрировано четыре препарата из группы агонистов рецепторов ГПП-1: эксенатид, лираглутид, ликсисенатид, дулаглутид.
В 2006 г. на российский фармацевтический рынок был выведен первый агонист рецепторов ГПП-1 эксенатид (Баета). Согласно результатам исследований, эксенатид устойчив к воздействию ДПП-4, но период его действия составляет 12 часов, поэтому требуется две инъекции в сутки.
В мае 2010 г. на отечественном фармрынке появился второй препарат данной группы – лираглутид (Виктоза). Это первый человеческий аналог ГПП-1, на 97% гомологичный человеческому ГПП-1. Период действия лираглутида составляет 24 часа, что позволяет вводить его один раз в день [10].
В феврале 2013 г. Еврокомиссия одобрила еще один препарат – ликсисенатид (Ликсумия). Он способен воздействовать как на глюкозу плазмы натощак, так и на постпрандиальную гликемию. Однако наибольший эффект продемонстрирован в снижении уровня постпрандиальной гликемии [11]. Ликсисенатид также вводится один раз в сутки.
Дулаглутид – четвертый препарат из группы агонистов рецепторов ГПП-1, зарегистрированный в России в 2016 г.
Дулаглутид
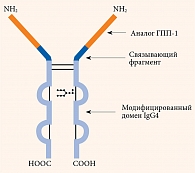
Дулаглутид (Трулисити) представляет собой гибридный белок, состоящий из двух идентичных цепей, связанных дисульфидными связями. Каждая цепь содержит аналог модифицированного человеческого ГПП-1, который на 90% гомологичен человеческому ГПП-1, связывающий фрагмент, фрагмент тяжелой цепи (Fc) модифицированного человеческого иммуноглобулина G4 (IgG4) (рис. 2) [12].
В молекуле дулаглутида в отличие от молекулы нативного ГПП-1 аланин заменен на глицин в восьмой позиции, вследствие чего достигнута резистентность к ДПП-4. Кроме того, молекула имеет большой размер, что замедляет абсорбцию и снижает почечный клиренс.
Особенности строения молекулы обеспечивают растворимость формы и увеличивают период полужизни препарата до 4,7 дня. Как следствие, препарат можно вводить один раз в неделю [13].
В России доступны две дозы Трулисити – 0,75 и 1,50 мг/нед. Первая рекомендуется для монотерапии, а также для лечения пациентов старше 75 лет, вторая – в составе комбинированной терапии СД 2 типа.
Исследование эффективности и безопасности
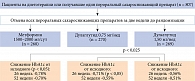
Эффективность и безопасность молекулы дулаглутида оценивались в программе рандомизированных исследований фазы III AWARD (Assessment of Weekly Administration of LY2189265 [dulaglutide] in Diabetes – Оценка еженедельного применения LY2189265 [дулаглутида] при сахарном диабете). Данная программа состоит из семи клинических исследований (1–6 и 10), в которых препарат применяли как в виде монотерапии, так и в комбинации с другими сахароснижающими препаратами у пациентов с СД 2 типа. Длительность AWARD составила от 26 до 104 недель (таблица).
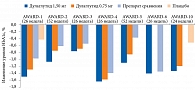
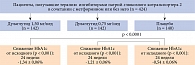
Основным критерием эффективности терапии во всех исследованиях AWARD 1–6, 10 было изменение уровня гликированного гемоглобина (HbA1c) относительно исходного. В исследованиях AWARD 1–5 дулаглутид продемонстрировал дозозависимую, статистически значимо большую эффективность в отличие от препаратов сравнения и плацебо. Однако в исследовании AWARD-6 дулаглутид не уступал по эффективности агонисту рецепторов ГПП-1 (p < 0,0001) (рис. 3).
АWARD-1
AWARD-1 – рандомизированное многоцентровое двойное слепое плацебоконтролируемое открытое исследование фазы III в параллельных группах. В нем в течение 52 недель сравнивали эффективность и безопасность дулаглутида, эксенатида и плацебо [14]. На момент включения в исследование 86,2% пациентов, к 52-й неделе 82,9% получали пиоглитазон в дозе 45 мг и метформин в дозе не менее 2500 мг. В исследовании приняли участие 978 пациентов старше 18 лет с индексом массы тела (ИМТ) 23–45 кг/м² и уровнем HbA1c от 7 до 11% на фоне монотерапии (любой пероральный сахароснижающий препарат) или от 7 до 10% на фоне комбинированной терапии. До включения в исследование в течение 12 недель пероральные сахароснижающие препараты были заменены на метформин и пиоглитазон в вышеуказанных дозах. После этого пациенты были рандомизированы на четыре группы: дулаглутид 0,75 мг/нед, дулаглутид 1,50 мг/нед, эксенатид 10 мкг два раза в день, плацебо (рис. 4).
Доля достигших целевого показателя HbA1c в группах дулаглутида была значимо больше, чем в группах плацебо и эксенатида. К 26-й неделе наблюдения уровня HbA1c менее 7,0% достигли 78 и 66% получавших дулаглутид 1,50 и 0,75 мг соответственно, 52% – эксенатид и 43% – плацебо, уровня HbA1c ≤ 6,5% – 63, 53, 38 и 24% пациентов соответствующих групп. К 52-й неделе исследования у 52% больных в группе дулаглутида 1,50 мг, 48% – в группе дулаглутида 0,75 мг и 35% в группе эксенатида зафиксировано снижение HbA1c ≤ 6,5% (p < 0,001).
На фоне терапии дулаглутидом и эксенатидом также зафиксировано достоверное уменьшение массы тела, гликемии натощак и постпрандиальной гликемии. Однако дулаглутид в дозе 1,50 мг вызывал более значимое снижение постпрандиальной гликемии, чем эксенатид (p = 0,047).
AWARD-2
AWARD-2 – открытое исследование не меньшей эффективности в параллельных группах, в котором оценивали эффективность и безопасность дулаглутида у пациентов с СД 2 типа, получавших комбинированную терапию метформином и глимепиридом [15]. В качестве препарата сравнения использовали инсулин гларгин. Продолжительность исследования составила 78 недель.
В исследование было включено 807 пациентов, не достигших оптимального контроля гликемии (уровень HbA1c ≥ 7% и ≤ 11%) при приеме одного, двух или трех пероральных сахароснижающих препаратов, одним из которых был метформин или производные сульфонилмочевины. Период до включения в исследование составил 12 недель. В течение первых двух-трех недель прием пероральных сахароснижающих препаратов был прекращен, начата терапия метформином и глимепиридом с титрацией доз до > 1500 мг/сут для метформина и ≥ 4 мг/сут для глимепирида.
После включения в исследование пациенты были рандомизированы на три группы: дулаглутид 0,75 мг/нед, дулаглутид 1,50 мг/нед, инсулин гларгин ежедневно (рис. 5).
В группе комбинированной терапии с инсулином гларгин титрация доз последнего проводилась до достижения целевого значения глюкозы плазмы натощак < 5,6 ммоль/л.
К 52-й неделе наблюдения уровень HbA1c менее 7,0% отмечен у 53 и 37% пациентов, получавших дулаглутид 1,50 и 0,75 мг соответственно, а также у 31% применявших инсулин гларгин, уровень HbA1c ≤ 6,5% – у 27, 23 и 14% на комбинированной терапии с дулаглутидом 1,50 мг, дулаглутидом 0,75 мг и инсулином гларгин соответственно.
К концу исследования (78-я неделя) HbA1c снизился до ≤ 6,5% у 28 и 22% пациентов из групп дулаглутида 1,50 и 0,75 мг, у 17% – из группы инсулинотерапии (p < 0,001).
Согласно результатам, полученным на 52-й и 78-й неделе, дулаглутид в дозе 1,50 мг превосходил инсулин гларгин не только в отношении снижения HbA1c, но и массы тела. Так, масса тела в группе дулаглутида уменьшилась на 1,96 кг, в группе инсулинотерапии – увеличилась на 1,28 кг (p < 0,001).
AWARD-3
AWARD-3 – многоцентровое рандомизированное двойное слепое открытое исследование фазы III, проведенное в параллельных группах. В нем оценивалась монотерапия дулаглутидом в дозах 1,50 и 0,75 мг и метформином в дозах 1500–2000 мг/сут у пациентов на ранних стадиях СД 2 типа. Ранее эти больные находились на диетотерапии или получали один пероральный сахароснижающий препарат в дозе меньшей или равной 50% от максимальной рекомендованной [16].
За две недели до начала исследования прием всех пероральных сахароснижающих препаратов был прекращен.
В исследование было включено 807 пациентов старше 18 лет с уровнем HbA1c от 6,5 до 9,5%. Их рандомизировали на три группы: дулаглутид 0,75 мг/нед, дулаглутид 1,50 мг/нед, метформин 1500–2000 мг/сут (рис. 6).
В конце исследования уровень HbAlc в группах дулаглутида снизился более выраженно, чем в группе метформина. Доля достигших целевых показателей HbAlc (< 7,0 и ≤ 6,5%) также была больше в группах дулаглутида.
Снижение массы тела в группах дулаглутида 1,50 мг и метформина оказалось сопоставимым – -1,9 и -2,2 кг соответственно. В группе дулаглутида 0,75 мг эффект в отношении массы тела был достоверно меньше – -1,1 кг (p < 0,05 по сравнению с терапией метформином).
AWARD-4
AWARD-4 – открытое исследование фазы III продолжительностью 52 недели. В нем эффективность и безопасность дулаглутида (1,50 или 0,75 мг), вводимого один раз в неделю, сравнивали с таковыми базального инсулина гларгин. Оба вида терапии комбинировали с прандиальным инсулином лизпро с или без метформина [17].
В исследование было включено 884 пациента старше 18 лет, не достигших оптимального контроля гликемии (уровень HbA1c ≥ 7% и ≤ 11%) на фоне инсулина лизпро с или без приема пероральных сахароснижающих препаратов.
Прием всех пероральных сахароснижающих препаратов прекращался до начала исследования за исключением метформина в минимальной дозе 1500 мг/сут.
После включения в исследование пациенты были рандомизированы на три группы: дулаглутид 0,75 мг/нед, дулаглутид 1,50 мг/нед, инсулин гларгин ежедневно (рис. 7).
К 26-й неделе наблюдения уровень HbA1c менее 7,0% был достигнут у 68 и 69% пациентов, получавших комбинированную терапию с дулаглутидом 1,50 и 0,75 мг, и у 57% больных на инсулинотерапии с метформином. К этому моменту времени HbA1c ≤ 6,5% зафиксирован у 48, 43 и 38% пациентов из групп дулаглутида 1,50 мг, дулаглутида 0,75 мг и инсулина гларгин соответственно. К 52-й неделе исследования у 37% пациентов группы дулаглутида 1,50 мг, 35% – группы дулаглутида 0,75 мг и 30% – группы инсулина гларгин HbA1c снизился до 6,5% и менее.
Анализ результатов 26-й и 52-й недели терапии показал, что дулаглутид в дозе 1,50 мг/нед превосходил инсулин гларгин не только в отношении снижения уровня HbA1c, но и массы тела. У пациентов на комбинированной терапии с дулаглутидом 1,50 мг масса тела уменьшилась на 0,35 кг. В группе инсулина гларгин наблюдалась противоположная тенденция – увеличение массы тела на 2,89 кг (p < 0,001).
AWARD-5
AWARD-5 – многоцентровое рандомизированное двойное слепое исследование продолжительностью 104 недели, в котором оценивали эффективность и безопасность дулаглутида 1,50 или 0,75 мг, вводимого один раз в неделю, ситаглиптина 100 мг и плацебо у пациентов с СД 2 типа с недостаточным контролем гликемии на терапии метформином (как в виде монотерапии, так и в комбинации с другим пероральными сахароснижающими препаратами) [18].
В исследование было включено 1098 пациентов старше 18 лет с ИМТ 25–40 кг/м² и уровнем HbA1c от 8,0 до 9,5%, не получавших терапии пероральными сахароснижающими препаратами, и уровнем НbA1c от 7,0 и до 9,5% на монотерапии метформином или в комбинации с другими пероральными сахароснижающими препаратами.
Исследование состояло из вводного периода длительностью до 11 недель, в течение которых суточную дозу метформина титровали до ≥ 1500 мг с отменой других пероральных сахароснижающих препаратов минимум за шесть недель до рандомизации.
После включения пациентов в исследование их рандомизировали на четыре группы: дулаглутид 0,75 мг/нед, дулаглутид 1,50 мг/нед, ситаглиптин 100 мг ежедневно и плацебо (рис. 8).
Пациентов группы плацебо через 26 недель переводили на терапию ситаглиптином в слепом режиме [19].
К 52-й неделе наблюдения уровень HbA1c менее 7,0% был достигнут у 58 и 49% пациентов групп дулаглутида 1,50 и 0,75 мг, у 33% пациентов группы ситаглиптина. Достоверное снижение HbA1c ≤ 6,5% было выявлено у 42, 29 и 19% получавших комбинированную терапию метформином с дулаглутидом 1,50 мг, с дулаглутидом 0,75 мг и ситаглиптином соответственно (p < 0,001). Достигнутые результаты по HbA1c ≤ 6,5% сохранялись до конца исследования (до 104-й недели) у 39% пациентов из группы дулаглутида 1,50 мг, 24% – группы дулаглутида 0,75 мг и 14% больных группы ситаглиптина. Полученные результаты свидетельствовали о долгосрочной эффективности препарата дулаглутид.
На фоне терапии дулаглутидом выявлено более выраженное и достоверное снижение средней массы тела, чем на фоне применения ситаглиптина. Так, у получавших дулаглутид 1,50 мг масса тела уменьшилась на 2,88 кг, дулаглутид 0,75 мг – на 2,39 кг, ситаглиптин – на 1,75 кг.
AWARD-6
AWARD-6 – рандомизированное открытое исследование продолжительностью 26 недель, проведенное для доказательства не меньшей эффективности терапии дулаглутидом, вводимым один раз в неделю подкожно в дозе 1,5 мг, чем терапия лираглутидом, вводимым подкожно один раз в день в дозе 1,8 мг, у пациентов, которые не достигали оптимального гликемического контроля на фоне терапии метформином [20].
В исследование было включено 599 пациентов старше 18 лет. ИМТ – ≤ 45 кг/м², уровень HbA1c – от ≥ 7 до ≤ 10%.
Участников исследования рандомизировали на две группы: дулаглутид 1,5 мг/нед, лираглутид 1,8 мг/сут (рис. 9).
По истечении 26 недель зафиксировано сопоставимое снижение как глюкозы плазмы натощак (-1,8 ммоль/л в группе дулаглутида и -2,4 ммоль/л в группе лираглутида), так и постпрандиальной гликемии (-2,56 ммоль/л в группе дулаглутида и -2,43 ммоль/л в группе лираглутида). Количество пациентов, достигших целевых показателей HbAlc < 7,0 и ≤ 6,5%, было сопоставимым в двух группах. В обеих группах наблюдалось снижение массы тела. На терапии метформином с дулаглутидом таковая уменьшилась на 2,90 кг, с лираглутидом – на 3,61 кг (р < 0,0001).
AWARD-10
Одно из самых последних исследований по оценке эффективности и безопасности дулаглутида – исследование AWARD-10.
AWARD-10 – двойное слепое рандомизированное плацебоконтролируемое исследование фазы III продолжительностью 24 недели. В нем сравнивали дулаглутид в дозе 1,50 или 0,75 мг, вводимый один раз в неделю, с плацебо у пациентов, у которых терапия ингибиторами натрий-глюкозного котранспортера 2 в сочетании с метформином (n = 403) или без него (n = 21) не обеспечивала достаточного контроля гликемии [21].
В исследование было включено 424 пациента с СД 2 типа старше 18 лет. ИМТ – ≤ 45 кг/м², уровень HbA1c – от ≥ 7,0 до ≤ 9,5%.
Больных рандомизировали на три группы: дулаглутид 0,75 мг/нед, дулаглутид 1,50 мг/нед, плацебо (рис. 10).
К 24-й неделе наблюдения уровень HbA1c менее 7,0% отмечен у 71 и 60% пациентов, получавших дулаглутид 1,50 и 0,75 мг, у 32% пациентов, получавших плацебо. При этом уровень HbA1c ≤ 6,5% зафиксирован у 50, 38 и 14% больных соответственно (p < 0,0001).
К 24-й неделе среднее снижение массы тела относительно исходных значений в группе дулаглутида 1,50 мг было больше, чем в группе плацебо – -3,1 против -2,1 кг (p = 0,028). Значимых различий в изменении массы тела у пациентов, получавших дулаглутид в дозе 0,75 мг и плацебо, не отмечено.
В данном исследовании также изучалось изменение концентрации глюкагона натощак. Применение дулаглутида в обеих дозах приводило к снижению секреции глюкагона – -2,1 пмоль/л в группе дулаглутида 1,50 мг и -1,5 пмоль/л в группе дулаглутида 0,75 мг (р < 0,001). Однако по сравнению с плацебо оно было более значительным в группе дулаглутида 1,50 мг (p < 0,05).
Наиболее частые нежелательные явления в программе клинических исследований AWARD были со стороны желудочно-кишечного тракта – тошнота, рвота и диарея. Они были преимущественно легкой или средней степени тяжести и носили временный характер.
Безопасность препарата в отношении гипогликемии также доказана в AWARD. Так, по безопасности применение дулаглутида сравнимо с использованием метформина, ситаглиптина, лираглутида, ингибитора натрий-глюкозного котранспортера 2 и более безопасно по сравнению с лечением базальным инсулином в составе разных схем терапии.
Заключение
Эффективность и безопасность дулаглутида были доказаны в программе клинических исследований AWARD как в монотерапии, так и в составе наиболее часто используемых комбинаций сахароснижающих препаратов. Преимуществом данного препарата является режим введения – один раз в неделю, что позволяет улучшить качество жизни пациентов. Терапия дулаглутидом сопровождается клинически значимым снижением массы тела. Кроме того, такое лечение характеризуется низким риском развития гипогликемических состояний.
N.E. Khachaturyan, L.V. Yegshatyan, PhD, A.M. Mkrtumyan, MD, PhD, Prof.
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinic Scientific Center
Contact person: Nane E. Khachaturyan, nane18@yandex.ru
Type 2 diabetes is one of the most common non-infectious diseases. Therefore, it continues the search for antidiabetic drugs with adverse events minimal risk, such as hypoglycemia and weight gains. In 2006, new groups of hypoglycemic drugs appeared on the Russian market – dipeptidyl peptidase 4 inhibitors and glucagon-like peptide 1 receptor agonists. Evaluation of clinical efficacy and safety in the form of mono- and combination therapy shows their additional benefits.
The article presents the results of the AWARD program of international clinical research of glucagon-like peptide 1 agonist receptor – dulaglutide.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.