Двойная терапия у пациентов с сахарным диабетом 2 типа: что добавить к метформину
- Аннотация
- Статья
- Ссылки
- English
В статье проанализированы разные классы лекарственных средств второй линии с точки зрения эффективности, безопасности и стоимости. Показано, что применение сульфонилмочевины (СМ) более эффективно и экономически оправданно по сравнению с использованием других классов ПССП. Комбинация метформина с сульфонилмочевиной позволяет воздействовать на основные звенья патогенеза и не ассоциируется с увеличением массы тела, характерным для монотерапии СМ. Основной побочный эффект СМ – риск гипогликемии – может быть снижен при применении фиксированной комбинации метформина и СМ вследствие уменьшения их доз. Использование фиксированной комбинации повышает эффективность и безопасность терапии, а также приверженность пациентов лечению. Кроме того, снижается стоимость последнего.
Дана характеристика препаратов, представляющих собой комбинацию 2,5 мг глибенкламида и 400 мг метформина в одной таблетке.
В статье проанализированы разные классы лекарственных средств второй линии с точки зрения эффективности, безопасности и стоимости. Показано, что применение сульфонилмочевины (СМ) более эффективно и экономически оправданно по сравнению с использованием других классов ПССП. Комбинация метформина с сульфонилмочевиной позволяет воздействовать на основные звенья патогенеза и не ассоциируется с увеличением массы тела, характерным для монотерапии СМ. Основной побочный эффект СМ – риск гипогликемии – может быть снижен при применении фиксированной комбинации метформина и СМ вследствие уменьшения их доз. Использование фиксированной комбинации повышает эффективность и безопасность терапии, а также приверженность пациентов лечению. Кроме того, снижается стоимость последнего.
Дана характеристика препаратов, представляющих собой комбинацию 2,5 мг глибенкламида и 400 мг метформина в одной таблетке.
Распространенность сахарного диабета (СД) 2 типа в мире превышает все прогнозы. По данным Международной диабетической федерации (International Diabetes Federation – IDF), в 2015 г. количество больных СД достигло 415 млн. По прогнозам экспертов Всемирной организации здравоохранения (ВОЗ), к 2040 г. их число составит уже 642 млн [1].
По данным IDF, смертность среди пациентов с СД в 2015 г. превысила суммарную смертность от таких инфекционных заболеваний, как СПИД, туберкулез и малярия (5 млн против 1,5 млн, 1,5 млн и 0,6 млн случаев соответственно), что дает основание говорить о неинфекционной эпидемии.
Сахарный диабет – хроническое, неизлечимое и прогрессирующее заболевание, течение которого ассоциируется с развитием специфических осложнений. Это приводит к прогрессированию микро- и макроангиопатий.
Известно, что пациенты с СД 2 типа подвергаются значительно более высокому риску развития инфаркта миокарда (ИМ) и инсульта, чем пациенты без СД. В исследовании S.M. Haffner и соавт. [2] семилетний риск ИМ у пациентов с диабетом без предшествующего ИМ был таким же высоким, как и у пациентов без СД, но перенесших ИМ. Таким образом, СД 2 типа может рассматриваться как фактор риска развития сердечно-сосудистых заболеваний (ССЗ).
Несмотря на явные успехи в профилактике и лечении CСЗ, влияние СД 2 типа на их прогноз остается значительным и продолжает эскалацию вследствие эпидемии ожирения [3].
Данные за последние десять лет свидетельствуют, что риск развития макрососудистых осложнений увеличивается с повышением уровня глюкозы, что указывает на то, что связь между метаболическими нарушениями и повреждением сосудов практически линейная [4, 5]. Установлено, что при увеличении гликированного гемоглобина (HbA1c) на 1% относительный риск ССЗ возрастает примерно на 16%.
Учитывая представленные выше данные, можно постулировать, что подходы, направленные на снижение гипергликемии, должны привести к явному сокращению сосудистых событий в популяции больных СД, подобно подходам, направленным на лечение гипертензии и гиперхолестеринемии. Однако соотношение между уровнем глюкозы и ССЗ намного сложнее. При успехе стратегии снижения уровня глюкозы результат не может быть предсказуем из-за изменений в суррогатных конечных точках (таких как уровни глюкозы в плазме или HbA1c) [6]. HbA1c является достоверным маркером гликемического контроля, однако им можно объяснить менее 25% риска развития диабетических микрососудистых осложнений [7]. HbA1c не коррелирует с вариабельностью гликемии при корректировке на средний уровень глюкозы в крови, и оценка стратегии снижения уровня глюкозы только по уровню HbA1c может не учитывать значительные колебания уровня глюкозы в течение дня (от чрезвычайно высоких до чрезвычайно низких (гипогликемические спады)).
Патофизиология
На протяжении многих десятилетий основными причинами развития СД 2 типа считались инсулинорезистентность периферических тканей и недостаточность инсулярного аппарата для ее преодоления [8]. Действительно, недостаточность бета-клеток островков Лангерганса поджелудочной железы отмечается еще до диагностики СД [9, 10].
Ожирение, малоподвижный образ жизни и генетическая предрасположенность являются факторами риска развития СД 2 типа [11]. Генетически детерминированная инсулинорезистентность компенсируется за счет гиперинсулинемии, усугубляющей ожирение и истощение инсулярного аппарата [12]. С течением времени это приводит к нарушению толерантности к углеводам, а затем, при прогрессирующей потере бета-клеток, – к манифестации СД 2 типа [13]. При снижении секреции инсулина продукция глюкозы печенью не подавляется даже после приема пищи, что усугубляет гипергликемию. Секреция глюкагона альфа-клетками также остается повышенной, даже после углеводной нагрузки [14], что способствует гипергликемии. Кроме того, нарушается эффект кишечных инкретинов (глюкагоноподобного пептида 1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП)), которые регулируют секрецию инсулина и глюкагона [15]. Почки также поддерживают гипергликемию, поскольку 90% фильтруемой глюкозы реабсорбируется в проксимальных канальцах при помощи натрий-глюкозного котранспортера 2-го типа (НГЛТ-2) и 10% – в дистальных канальцах при помощи натрий-глюкозного котранспортера 1-го типа (НГЛТ-1). Активизация липолиза при СД 2 типа способствует повышенному выходу свободных жирных кислот в плазму. Последние используются как альтернативный источник энергии, индуцируют глюконеогенез, ухудшают секрецию инсулина и повышают инсулинорезистентность. Нарушение регуляции мозга в подавлении аппетита после приема глюкозы, особенно у лиц с ожирением, также может способствовать гипергликемии [10].
Перечисленные изменения привели к новому пониманию патогенеза заболевания. Теперь он рассматривается как зловещий октет. К патофизиологическим механизмам помимо инсулиновой недостаточности и инсулинорезистентности отнесены повышение продукции глюкозы печенью за счет альфа-клеток поджелудочной железы, инкретинового дефекта, жировой ткани, канальцев почек и мозга. Это объясняет сохранение риска ССЗ даже в условиях достижения целевого уровня HbA1c.
Алгоритм лечения и место в нем сахароснижающих препаратов разных классов
Изменение представлений о патогенезе СД 2 типа стало основанием для пересмотра и обновления алгоритмов лечения, изменения показаний к назначению новых классов пероральных сахароснижающих препаратов (ПССП).
Тем не менее все международные и отечественные алгоритмы рекомендуют в качестве препарата первого выбора метформин ввиду его длительной эффективности и безопасности, в первую очередь в отношении ССЗ, при относительной дешевизне [16–18]. Метформин назначается, если отсутствует поражение почек (хроническая болезнь почек четвертой стадии и выше). В качестве резервных средств при противопоказаниях к назначению метформина современные алгоритмы предлагают ингибиторы дипептидилпептидазы 4 (иДПП-4), агонисты рецепторов ГПП-1 (аГПП-1) либо ингибиторы НГЛТ-2 (иНГЛТ-2).
При недостижении целевого уровня HbA1c в течение трех – шести месяцев необходимо добавить второй препарат.
При большом арсенале современных ПССП перед врачом встает проблема выбора наиболее эффективного и безопасного с точки зрения риска гипогликемических состояний, сердечно-сосудистой смертности, прибавки массы тела и др.
Новейший класс ПССП – иНГЛТ-2 оказывает сахароснижающий эффект за счет снижения реабсорбции глюкозы в почечных канальцах, независимо от действия инсулина. Исследования безопасности препаратов этой группы продолжаются, прежде всего в отношении возможных рисков развития рака мочевого пузыря и молочной железы, а также кетонурии. Тем не менее и Американская диабетическая ассоциация (American Diabetes Association – ADA), и Российская ассоциация эндокринологов (РАЭ) рекомендуют иНГЛТ-2 в качестве препаратов второй линии [16, 18].
Как один из вариантов терапии – аГПП-1. Механизм действия препаратов данной группы направлен на подавление продукции глюкозы печенью за счет глюкозозависимого снижения секреции глюкагона и стимуляцию секреции собственного инсулина. На фоне такой терапии эффективно снижается масса тела и контролируется гликемия. Однако широкое применение этих средств лимитируется необходимостью парентерального введения, в связи с чем они уступают по распространенности иДПП-4. Последние действуют аналогичным образом за счет блокады ДПП-4, инактивирующей собственные ГПП-1 и ГИП.
В некоторых работах отмечалась связь между применением аГПП-1 и развитием панкреатита, гиперплазии поджелудочной железы и раком щитовидной железы, однако представленные данные оказались неубедительными [19–21]. Кроме того, Y. Zhang и соавт. продемонстрировали, что аГПП-1 наиболее дорогостоящие лекарственные средства по сравнению с СМ, инсулином и иДПП-4 [22].
Препаратами выбора после метформина признаны препараты сульфонилмочевины (ПСМ), поскольку они недороги и имеют долгосрочную эффективность и историю безопасности [23].
Комбинация метформина с ПСМ влияет на резистентность к инсулину и инсулиновую недостаточность – ключевые патогенетические дефекты СД 2 типа [9]. ПСМ, которые стимулируют секрецию инсулина, при добавлении к метформину уменьшали HbA1c дополнительно на 0,8%. Как следствие, увеличилось количество больных, достигших целевой гликемии [20, 24].
Результаты исследований показали, что сочетание ПСМ и метформина было самым экономичным вариантом терапии по сравнению с сочетанием метформина с иДПП-4, аГПП-1, инсулином и тиазолидиндионами [22, 25]. Кроме того, добавление ПСМ к метформину ассоциировалось с самой длительной независимостью от инсулина, следовательно, этот вариант терапии может быть оптимальным для тех, кто не хочет переходить на инсулинотерапию [22].
В отличие от комбинированной терапии монотерапия глибенкламидом характеризуется меньшей долгосрочной эффективностью и более ранней потребностью в инсулине (по сравнению с метформином и розиглитазоном) [26].
Различий в частоте тяжелых гипогликемий между комбинацией ПСМ с метформином и комбинацией метформина с аГПП-1 или монотерапией метформином не отмечалось, хотя известно, что применение ПСМ повышает риск гипогликемии и увеличения массы тела [20].
Другие данные о безопасности ПСМ, в частности в отношении риска сердечно-сосудистых событий, смерти, а также развития рака, не поддаются оценке из-за противоречивости [27, 28].
Ингибиторы ДПП-4 снижали уровень HbA1c примерно на 0,7%, что было менее эффективно по сравнению с ПСМ [29]. Однако препараты данной группы при добавлении к метформину характеризовались нейтральным влиянием на массу тела и риск гипогликемии [20]. Сердечно-сосудистых событий при лечении иДПП-4 было меньше, чем на фоне терапии ПСМ [30]. Однако недавнее исследование сердечно-сосудистых исходов при применении саксаглиптина продемонстрировало увеличение частоты госпитализаций по поводу сердечной недостаточности [31]. Кроме того, подтверждено влияние терапии иДПП-4 на панкреатит. В исследовании «случай – контроль» установлено, что эксенатид и ситаглиптин удвоили риск госпитализаций по поводу панкреатита [23]. В то же время в ходе ретроспективного когортного исследования не обнаружено ассоциации применения эксенатида или ситаглиптина с риском острого панкреатита по сравнению с использованием метформина или глибенкламида [32].
Добавление иДПП-4 к метформину приводит к удорожанию лечения, менее эффективно в отношении влияния на качество жизни (скорректированный на качество жизни год (Quality Adjusted Life Years – QALY)) и требует более раннего назначения инсулина [22]. Таким образом, иДПП-4 могут быть препаратами выбора в качестве второй линии терапии у пациентов, страдающих ожирением или склонных к гипогликемии.
Инсулин при добавлении к метформину дополнительно уменьшает HbA1c на 0,8%, что так же эффективно, как и добавление к метформину ПСМ [33, 20]. Аналогично ПСМ инсулин повышает риск гипогликемических состояний и увеличения массы тела. Однако инсулин дороже и не имеет преимуществ в отношении QALY по сравнению с ПСМ [22].
Кроме того, многие пациенты отказываются от инсулина из-за страха перед инъекцией и отсутствия знаний о важности такой терапии [34, 35].
Таким образом, ПСМ можно расценивать как лучший агент второй линии терапии при неадекватном диабетическом контроле на фоне метформина. В настоящее время сочетание сульфонилмочевины и метформина доступно в виде фиксированной дозы глибенкламида и метформина, глимепирида и метформина, гликлазида и метформина.
Стратификация лечебной тактики в зависимости от уровня HbA1c
Согласно официальному заявлению Американской диабетической ассоциации/Европейской ассоциации по изучению диабета (ADA/EASD) [36] выбор препарата второй линии зависит:
- от прогнозируемого снижения HbA1c и его целевого значения;
- риска тяжелой гипогликемии и выраженных побочных явлений;
- риска увеличения массы тела;
- цены и ее доступности.
Какая комбинация предпочтительнее у пациентов с исходным уровнем HbA1c от 6,5 до 7,5%?
Если исходить из критериев переносимости и безопасности, возможный риск гипогликемии при применении секретагогов (ПСМ и меглитинидов) у больных с исходно невысоким уровнем HbA1c превышает риск побочных эффектов со стороны желудочно-кишечного тракта и мочевого синдрома на фоне применения инкретинов (иДПП-4 и аГПП-1) и иНГЛТ-2 соответственно. Именно поэтому современные алгоритмы [18] в качестве наиболее рациональных комбинаций предлагают в первую очередь сочетать метформин с иДПП-4, аГПП-1 или иНГЛТ-2. Молодым пациентам с исходным уровнем HbA1c 7,5% без тяжелых осложнений и риска гипогликемий для достижения целевого уровня < 6,5% рекомендуется более эффективная комбинация – метформин и секретагоги (ПСМ или глиниды).
Если модификация образа жизни, метформин и второй препарат не привели к достижению целевых значений, следует инициировать или интенсифицировать инсулинотерапию. Однако при уровне HbA1c, близком к целевому (< 7,5%), можно добавить третий пероральный сахароснижающий препарат. Такой подход более дорогостоящий и не всегда более эффективный [37].
Тактика ведения пациентов с HbA1c от 7,6 до 9,0%. Подавляющее большинство больных СД 2 типа уже на момент диагностики заболевания имеют уровень HbA1c > 7,6%.
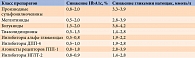
К сожалению, на сегодняшний день не существует препаратов, способных обеспечить достижение целевого уровня на монотерапии в течение трех – шести месяцев (таблица) [18, 36]. Именно поэтому современный алгоритм лечения уже на старте терапии рекомендует использовать два препарата. Результаты многочисленных исследований доказали, что одновременное назначение препаратов с разными точками приложения обеспечивает более значимое снижение HbA1c за более короткие сроки при значительно меньших дозах, чем монотерапия метформином с последующим добавлением второго препарата [38, 39].
Метформин является основой всех комбинаций. Наиболее безопасная из них – метформин и инкретиновые миметики вследствие отсутствия риска гипогликемических состояний и прибавки массы тела, эффективная – метформин и ПСМ, поскольку эти препараты по отдельности наиболее значимо снижают уровень HbA1c, а их комбинация не только обеспечивает хороший контроль гликемии, но и положительно влияет на уровень холестерина и липидный спектр крови [40].
В случае неэффективности двойной терапии следует добавить третий препарат, опять-таки исходя из принципов эффективности и безопасности. Наиболее безопасной с точки зрения риска развития гипогликемических состояний признана комбинация метформина, инкретинового миметика и иНГЛТ-2, эффективной – добавление к первым двум ПСМ. Таким образом, пациентам с уровнем HbA1c, близким к 7,5%, целесообразно назначать комбинацию метформина с инкретиновыми миметиками и иНГЛТ-2, пациентам с более высоким уровнем HbA1c – комбинацию метформина с ПСМ и инкретиновыми миметиками. Следующим этапом в достижении целевого уровня глюкозы при неэффективности тройной комбинации является назначение инсулина, сначала в фоновом, затем фоново-болюсном режиме. При переходе на инсулин необходимо отменить препараты, так или иначе стимулирующие его секрецию.
HbA1c > 9%. В клинической практике нередки случаи, когда при диагностике СД 2 типа у пациентов отмечается значительная гипергликемия – уровень HbA1c превышает 9%, однако отсутствует клиническая симптоматика заболевания. Это свидетельствует о достаточной секреторной активности инсулярного аппарата.
В данной ситуации вместо интенсивной инсулинотерапии, которая считается абсолютным показанием при HbA1c > 10% и выраженной клинической симптоматике, может быть рекомендована комбинация трех ПССП. Наиболее эффективной признана комбинация метформина с ПСМ и инкретиновыми миметиками, наиболее безопасной с точки зрения риска гипогликемий – комбинация метформина с инкретиновыми миметиками и иНГЛТ-2.
Фиксированная доза в одной таблетке или одновременный прием двух препаратов?
Хорошо известно, что сложные схемы сахароснижающей терапии затрудняют следование ей. Об этом свидетельствуют и результаты исследования DARTS: только 30% пациентов твердо придерживаются терапии одним лекарственным средством и менее 13% – большим количеством препаратов и в больших дозах (одновременное применение) [41]. Именно этим объясняется появление комбинированных сахароснижающих препаратов, в состав которых обязательно входит метформин.
Установлено, что более низкие дозы активных веществ в фиксированной комбинации глибенкламида и метформина значительнее снижают HbA1c, чем одновременное назначение метформина с глибенкламидом, глимепиридом или гликлазидом [38, 42, 43].
Фиксированная комбинация обеспечивает дополнительные преимущества, такие как низкий риск гипогликемий, ассоциированных с глибенкламидом [42], желудочно-кишечных расстройств, обусловленных метформином, возможность повышать титрование доз, что отсрочивает введение тройной терапии.
Основной проблемой при применении ПСМ является гипогликемия. В многоцентровом ретроспективном исследовании с участием 72 пациентов только у трех зафиксированы гипогликемии при совместном приеме метформина и глибенкламида. При переходе на фиксированную комбинацию глибенкламида и метформина таковая отмечалась у восьми больных [38]. Трое из них одновременно получали инсулин. После уменьшения дозы инсулина эпизоды гипогликемии не фиксировались.
Поскольку большинство пациентов с СД 2 типа имеют избыточную массу тела либо ожирение, еще одна проблема сахароснижающей терапии – увеличение массы тела. Следовательно, предпочтение надо отдавать препаратам, которые уменьшают или оказывают нейтральное воздействие на массу тела. Как было сказано ранее, одним из побочных эффектов ПСМ является повышение массы тела. Однако метформин может противодействовать влиянию глибенкламида на массу тела. L.S. Hermann и соавт. установили, что разница в массе тела между пациентами, принимавшими комбинацию «глибенкламид + метформин» и только метформин, отсутствует [39].
Фиксированная комбинация, содержащая по меньшей мере два препарата в одной таблетке, удобна в применении и снижает нагрузку в отношении количества принимаемых таблеток, как следствие улучшается приверженность лечению и состояние пациентов [44, 45].
Установлено, что режим терапии фиксированными комбинациями глибенкламида и метформина, а также глипизида и метформина соблюдался лучше, чем режим лечения двумя препаратами одновременно [42, 44, 46]. Переход с метформина и глибенкламида на фиксированную их комбинацию повышал приверженность лечению на 16%.
Более низкая стоимость фиксированной дозы глибенкламида и метформина в одной таблетке (за счет снижения дозы каждого препарата в отдельности) также может улучшить комплаентность пациентов [44].
C. Cheong и соавт. сообщили о значительно более низкой стоимости комбинированных таблеток по сравнению с двойной терапией, независимо от того, используется оригинальный препарат или дженерик [44]. Другие исследователи установили, что стоимость лечения снижалась на 44% при переходе с совместного применения гликлазида и метформина на фиксированную их комбинацию [43].
Комбинация фиксированных малых доз глибенкламида и метформина
Наиболее оптимальной считается комбинация фиксированных малых доз глибенкламида (2,5 мг/таб) и метформина (400 мг/таб). Сочетание стимулятора секреции инсулина глибенкламида и метформина, повышающего чувствительность тканей к действию гормона, обеспечивает воздействие на основные патофизиологические механизмы СД 2 типа.
Глибенкламид – препарат сульфонилмочевины второй генерации – остается золотым стандартом сравнения для новых классов пероральных сахароснижающих препаратов. Это обусловлено тем, что глибенкламид обладает самой высокой константой сродства с субъединицей SUR-1 КАТФ-канала бета-клетки, связываясь с ней как сульфонилмочевинной, так и бензамидной группировкой.
Глибенкламид входит в список жизненно важных лекарственных средств ВОЗ (16-я редакция от марта 2010 г.) и РФ и является единственным представителем группы ПСМ, включенным в перечень основных лекарственных средств ВОЗ.
В 2010 г. препарату была присуждена премия лекарственных средств им. Г.Г. Крейтцфельдта (Германия). Данная награда свидетельствует о признании центральной роли препарата в оптимизации фармакотерапии. Особое значение имеют эффективность, профиль безопасности и возможные долгосрочные благоприятные эффекты.
Метформин также входит в перечень жизненно важных лекарственных средств ВОЗ и РФ, его эффективность и безопасность доказаны многочисленными исследованиями.
Фармакокинетические параметры позволяют применять оба препарата два раза в день.
Фиксированная комбинация 2,5 мг/400 мг в одной таблетке не уступает по эффективности раздельному применению глибенкламида и метформина в больших дозах [36].
Используя такую оптимальную комбинацию в терапии СД 2 типа, можно достичь целевого уровня гликемии как у пациентов с неэффективностью высоких доз метформина, так и у больных, которым изначально показана двойная либо тройная терапия.
Фиксированная комбинация глибенкламида и метформина вследствие снижения доз обоих препаратов ассоциируется с меньшим риском побочных эффектов. Кроме того, ее применение способствует повышению комплаентности пациентов [36].
Данная комбинация может быть использована в любой когорте пациентов с СД 2 типа вне зависимости от исходного уровня HbA1c, разумеется, с учетом индивидуальных целей лечения, риска развития гипогликемических состояний, тяжелых сосудистых осложнений, возраста и ожидаемой продолжительности жизни.
Заключение
При неэффективности монотерапии метформином в достижении гликемической цели сульфонилмочевина была бы лучшим препаратом второй линии с учетом ее высокой эффективности, относительной безопасности и низкой стоимости. Фиксированная комбинация этих двух лекарственных средств позволяет повысить эффективность и безопасность терапии, улучшить приверженность пациентов лечению. Дополнительным преимуществом является снижение стоимости лечения.
L.V. Nedosugova
I.M. Sechenov First Moscow State Medical University
Contact person: Lyudmila Victorovna Nedosugova, profmila@mail.ru
In recent decades, the pathophysiology of type 2 diabetes mellitus has been considered in terms of two major defects-insulin resistance and insulin deficiency. Currently, ideas about the pathogenesis of the disease have expanded to a ‘ominous octet’ and the treatment algorithms have been updated in connection with the emergence of new classes of hypoglycemic agents. Although all recommendations suggest metformin as a first-line drug, there is no definite consensus regarding second-line drugs. In the review, classes of drugs of the second line of therapy were assessed in terms of their effectiveness, safety and cost. It is shown that the use of sulfonylurea (SM) in this situation is more efficient and cheaper, compared with other classes. The combination of metformin with sulfonylurea allows to influence the main links of pathogenesis, without affecting the weight gain. The main side effect is the risk of hypoglycemia can be reduced by using a fixed combination of metformin and SM in a single tablet that showed greater efficacy and safety at lower doses. The use of a fixed combination increases patient adherence to therapy and reduces the cost of treatment. The use of a fixed combination increases patient adherence to therapy and reduces the cost of treatment. Showing the characteristic the combination of 2.5 mg of glibenclamide and 400 mg of metformin in one tablet.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.