Введение
Сахарный диабет (СД) 2 типа является глобальной проблемой здравоохранения, которая достигла масштабов эпидемии как в развитых, так и развивающихся странах. Согласно данным за 2013 г., в мире зафиксировано 381 млн 800 тыс. пациентов с СД 2 типа [1]. Рост популяции пациентов с СД 2 типа и частоты его хронических осложнений, особенно сердечно-сосудистых заболеваний и болезни почек, – одна из наиболее актуальных проблем, с которой сегодня сталкивается мировое сообщество.
Гипергликемия при СД 2 типа вызвана сочетанием прогрессирующей дисфункции бета-клеток и резистентности мышц, печени и адипоцитов к инсулину. Гипергликемия в свою очередь способствует дальнейшему снижению функции бета-клеток и увеличению инсулинорезистентности за счет так называемой глюкозотоксичности [2].
Лечение СД 2 типа направлено на минимизацию риска развития микро- и макрососудистых осложнений. Изменение образа жизни остается краеугольным камнем терапии больных СД 2 типа. Однако многие пациенты не достигают индивидуальной терапевтической цели, в связи с чем требуется фармакологическое вмешательство.
Существует целый арсенал противодиабетических препаратов, но их терапевтическая эффективность нередко сочетается с такими побочными эффектами, как увеличение массы тела или уровня гипогликемии [3]. Более того, действие всех препаратов опосредовано через инсулин, и эффективность большинства из них зависит от функции бета-клеток. При прогрессировании заболевания и снижении функции бета-клеток эти методы лечения становятся менее эффективными [4–6]. Таким образом, возникает потребность в новых препаратах с инсулиннезависимым механизмом действия и эффективностью, не зависящей от функции бета-клеток поджелудочной железы. Ингибиторы натрий-глюкозного котранспортера 2-го типа (SGLT2) – это новый класс пероральных противодиабетических препаратов, позволяющих уменьшить уровень гликемии независимо от инсулина и функции бета-клеток.
Роль почек в гомеостазе глюкозы
До недавнего времени почки в контексте СД рассматривались в качестве органа-мишени. В течение последнего десятилетия все больше внимания уделяется роли почек в гомеостазе глюкозы.
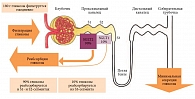
У здоровых людей суточная фильтрация глюкозы в клубочках почек составляет около 180 г. Из-за активной системы реабсорбции эта глюкоза практически полностью реабсорбируется в проксимальном канальце нефрона. Моча, поступающая в петлю Генле, свободна от глюкозы. Повышение концентрации глюкозы в плазме крови приводит (в линейной зависимости) к увеличению ее фильтрации в клубочках. При увеличении скорости поступления глюкозы в проксимальный каналец выше 260–350 мг/мин/1,73 м2, например у пациентов с СД, избыток глюкозы превышает реабсорбтивный потенциал, и она выделяется с мочой. У здорового взрослого человека это соответствует концентрации глюкозы в крови около 10–11 ммоль/л (180–200 мг/дл). 90% профильтрованной глюкозы реабсорбируется в начальной части проксимального канальца (S1-сегмент), а остальные 10% – в конечной (S2- и S3-сегменты) (рис. 1) [7–9].
Поскольку глюкоза не способна свободно проникать через клеточную мембрану, во всасывании ее в кишечнике и реабсорбции в почках участвуют натрий-зависимые переносчики глюкозы (SGLT), кодируемые геном SLC5A [10]. Семейство генов SLC5A выявлено в различных тканях и детально исследовано. К настоящему моменту выделены, клонированы и расшифрованы молекулярные структуры двух натрий-глюкозных котранспортеров глюкозы – SGLT1 и SGLT2. Оба переносчика глюкозы идентичны по аминокислотному составу и состоят из 672 аминокислот [8].
SGLT1 – транспортер с высокой аффинностью, но малой способностью транспортировать глюкозу через клеточную мембрану, экспрессируется преимущественно в клетках тонкой кишки, меньше в клетках почек (в дистальных сегментах S2 и S3 проксимального канальца, где реабсорбируются примерно 10% глюкозы, не подвергшейся обратному всасыванию в сегменте S1), а также сердца, скелетных мышц, трахеи и легких. Низкие уровни данного белка зафиксированы в половых органах (шейка матки, яичники, предстательная железа, семявыносящие протоки). Мутации SGLT1 приводят к мальабсорбции глюкозы и галактозы.
SGLT2 – транспортер с низкой аффинностью, но высокой способностью транспортировать глюкозу. SGLT2 почти всегда располагается в эпителиальных клетках начального отдела проксимального канальца нефрона, в S1-сегменте, где реабсорбируется большая часть глюкозы [11, 12]. Показано, что SGLT2 селективно экспрессируются в почках и не экспрессируются в более чем 70 других тканях, в том числе печени, скелетной мускулатуре, жировой ткани, молочной железе, мочевом пузыре и головном мозге (см. таблицу) [11]. SGLT2 считается основным транспортным белком, задействованным в реабсорбции глюкозы из клубочкового ультрафильтрата обратно в кровеносное русло [13, 14].
Реабсорбция глюкозы эпителиальными клетками почечных канальцев требует ковалентной реабсорбции натрия. Обратный захват натрия осуществляется с помощью аденозинтрифосфатазного насоса через базолатеральную мембрану клетки. Реабсорбция клетками глюкозы и натрия происходит в соотношении 1:1. Выделение глюкозы в кровь из клеток почечных канальцев осуществляется с помощью глюкозных транспортеров семейства GLUT.
Как показали результаты генетических исследований лиц с семейной почечной глюкозурией, в 90% случаев обнаруживается инактивирующая мутация гена SCL5A2, кодирующего именно SGLT2. Тем самым доказано, что у человека SGLT2 является основным механизмом реабсорбции глюкозы в почках [15]. При этом у пациентов с семейной почечной глюкозурией не наблюдаются гипогликемии или другие клинические последствия сниженной реабсорбции глюкозы, хотя они имеют выраженную глюкозурию [16, 17]. Это, а также то, что у пациентов с СД 2 типа парадоксально возрастает реабсорбция глюкозы в почках вследствие повышения экспрессии и функциональной активности SGLT2, послужило отправной точкой для дальнейших исследований в отношении ингибирования SGLT2 как терапевтической мишени при СД 2 типа. Ингибирование SGLT1 неразумно, поскольку кишечная мальабсорбция глюкозы и галактозы приводит к изнурительной осмотической диарее.
Ингибиторы SGLT2
Первой субстанцией, тормозящей активность транспортеров глюкозы в почках, был флоризин. Он был выделен из коры яблони в 1835 г. Флоризин, обладающий эффектами хинина, изначально изучали в качестве жаропонижающего средства и использовали при малярии. Его антидиабетические свойства исследовали в 1980-х гг. Было установлено, что глюкозурия обусловлена ингибированием как SGLT1, так и SGLT2. Из-за его неселективности и блокирующего эффекта SGLT1 флоризин не подходил для использования у человека. Однако результаты исследований у животных были многообещающими. У крыс с удаленной поджелудочной железой (до 90% массы) флоризин вызывал глюкозурию, что сопровождалось снижением уровня гликемии и резистентности к инсулину, а также улучшение функции бета-клеток поджелудочной железы [18, 19]. Данные результаты послужили основанием для разработки лекарственных средств с высокой селективностью по отношению к SGLT2.
Ингибиторы SGLT2, разработанные для преодоления недостатков флоризина, представляют новый класс противодиабетических препаратов, отличающихся влиянием на механизм регуляции гипергликемии, не зависящий от инсулина и гликемического статуса пациентов. Особенностью данного класса препаратов является их влияние на снижение массы тела и, что важно, минимальный риск гипогликемий.
Многочисленные фармацевтические фирмы исследовали синтетические производные флоризина. Результаты экспериментальных и клинических исследований показали, что синтезированные ингибиторы SGLT2 приводят к уменьшению гиперинсулинемии, резистентности к инсулину и уровня HbA1c, а также к нормализации синтеза глюкозы и ее утилизации в печени.
Ингибиторы SGLT2 вследствие уникального механизма действия [20, 21], не зависящего от выраженности резистентности к инсулину и недостаточности бета-клеток, одинаково эффективны как у пациентов с СД 2 типа с длительностью заболевания менее одного года, так и у пациентов с СД 2 типа длительного течения (более десяти лет) [22]. Все ингибиторы обладают высокой селективностью к SGLT2 по отношению к SGLT1 [23].
Дапаглифлозин (Форсига)
Дапаглифлозин – активный и высокоселективный ингибитор SGLT2 обратимого действия. Его сахароснижающий эффект дозозависимый [24]. Основной гипогликемический эффект дапаглифлозина не зависит от секреции инсулина и его активности. Тем не менее в доклинических исследованиях отмечалось улучшение функции бета-клеток [25].
Дапаглифлозин обладает высокой (75%) биодоступностью при введении внутрь, быстро всасывается из желудочно-кишечного тракта. Максимальная концентрация препарата в крови достигается спустя 1–2 часа после приема. Прочно связан с белком и в крайне незначительных количествах выделяется с мочой (2%), метаболизируется с помощью глюкуронозилтрансферазы с образованием неактивных метаболитов (глюкуронидат и дапаглифлозин 3-О-глюкуронид, выделяющиеся с мочой). Дапаглифлозин имеет линейную фармакокинетику и достаточно длительный период полувыведения (13,8 ± 9,4 часа), позволяющий применять его один раз в сутки [26, 27].
В исследовании у животных и в клинических исследованиях у пациентов с СД 2 типа показано, что дапаглифлозин снижает уровень гликемии как натощак, так и после еды за счет стимуляции выведения избыточного количества глюкозы с мочой [24, 28]. Важный момент: Форсига снижает только повышенный уровень гликемии и не влияет на нормальную концентрацию глюкозы в крови. Частота гипогликемий на фоне применения дапаглифлозина не отличается от таковой при использовании плацебо [29–31].
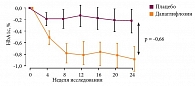
Монотерапия препаратом Форсига эффективно снижает уровень гликемии у пациентов с СД 2 типа по сравнению с плацебо (рис. 2) [29–31].
По сравнению с плацебо выявлено и достоверное снижение массы тела в среднем на 2–3 кг [20, 25, 27]. Эффект снижения массы тела связан с потерей глюкозы и отрицательным энергетическим балансом. На основании количественного определения глюкозурии установлено, что суточная потеря составляет примерно 70 г глюкозы, что соответствует 280 ккал.
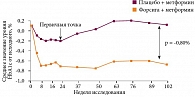
Комбинированная терапия с метформином продемонстрировала лучший эффект по сравнению с монотерапией метформином. Добавление дапаглифлозина в дозе 10 мг к метформину не только сопровождалось более выраженной динамикой HbA1c через 24 недели, но и позволяло добиться устойчивого гликемического контроля. Через 102 недели применения данной комбинации динамика HbA1c в группе метформина и дапаглифлозина составляла -0,78%, тогда как в группе метформина и плацебо данный показатель увеличился на 0,02% (рис. 3) [32].
В целом препарат продемонстрировал благоприятный профиль побочных реакций. Однако, учитывая способность ингибиторов SGLT2 вызывать глюкозурию, можно было ожидать увеличения частоты мочеполовых инфекций.
СД 2 типа – заболевание, которое связано с повышенным риском инфекций мочевыводящих путей (ИМП) и половых инфекций, таких как вульвовагинит и баланит у женщин и грибковая генитальная инфекция у мужчин [33, 34]. Риск инфекций только частично обусловлен глюкозурией. Имеют значение и такие факторы, как дисфункция иммунной системы, гликозилирование уроэпителиальных клеток [35].
Данные 12 рандомизированных плацебоконтролируемых исследований [36, 37] показали, что встречаемость ИМП была выше в группе дапаглифлозина – 5,7 и 4,3% для 5 и 10 мг препарата соответственно (3,7% в группе плацебо). Эти результаты были значимы только в отношении дапаглифлозина 5 мг. Первое событие ИМП обычно имело место на относительно ранней стадии лечения, чаще у женщин. Большинство ИМП были легкими и умеренными по тяжести, в большинстве случаев хорошо купировались первичным курсом стандартной терапии и редко приводили к исключению пациентов из исследования (0,2% в группе дапаглифлозина 10 мг против 0% в группе плацебо). Встречаемость пиелонефрита была редкой. Пиелонефрит развивался с одинаковой частотой в группе плацебо и дапаглифлозина (0,1%) [36]. Встречаемость генитальных инфекций в той же популяции составила 5,7 и 4,8% для дапаглифлозина 5 и 10 мг соответственно по сравнению с 0,9% в группе плацебо. Эти инфекции чаще фиксировались у женщин и, как правило, в начале лечения, хорошо купировались стандартной терапией и не приводили к исключению пациентов из исследования [37].
По данным объединенного анализа 12 клинических рандомизированных плацебоконтролируемых исследований фазы 2b/3 с включением более чем 4000 пациентов и продолжительностью наблюдения от 12 до 102 недель, применение дапаглифлозина было связано с транзиторным снижением расчетной скорости клубочковой фильтрации (рСКФ) на первой неделе терапии и последующим увеличением показателя до исходных значений (82,53 мл/мин/1,73 м2) или выше. Показатель рСКФ оставался стабильным в течение двух лет. На 102-й неделе в обеих группах наблюдалось увеличение рСКФ – +2,02 мл/мин/1,73 м2 в группе дапаглифлозина и +0,66 мл/мин/1,73 м2 в группе плацебо. Через 24 недели у сопоставимого числа пациентов в группе дапаглифлозина и плацебо отмечались нежелательные явления, связанные с почками: 1,2% в группе дапаглифлозина и 0,9% в группе плацебо. В большинстве случаев все события были связаны с изменением лабораторных показателей, были нетяжелыми и носили обратимый характер. Серьезных нежелательных явлений не зафиксировано. Через 102 недели частота нежелательных явлений, связанных с почками, составила 2% в группе дапаглифлозина и 1,6% в группе плацебо. Дисбаланса между группами в отношении серьезных нежелательных явлений, включая появление почечной недостаточности или ухудшение функции почек, прогрессирование нефропатии, случаи острой нефропатии, связанной с приемом препарата, не наблюдалось [38]. В целом при наблюдении в течение двух лет не выявлено повышения риска переломов костей в сравнении с плацебо.
При анализе данных об онкологической безопасности отмечался дисбаланс в частоте случаев развития рака мочевого пузыря и молочной железы между группами дапаглифлозина и плацебо. Обратите внимание: ни по одному виду опухоли не получено достоверной разницы между группами. Анализ по онкологической безопасности включал 5501 пациента из группы дапаглифлозина и 3184 пациента из группы плацебо.
У 9 (0,16%) пациентов группы дапаглифлозина (все мужчины) был диагностирован рак мочевого пузыря. В группе плацебо зафиксирован 1 (0,03%) подобный случай (р = 0,15). При анализе выявлено, что все случаи рака зарегистрированы в первые два года (43–727 дней) лечения. Большинство пациентов имели гематурию исходно. У троих она развилась в течение первых шести месяцев лечения. Это позволяет предположить, что дапаглифлозин не является причиной опухолей и зарегистрированные случаи просто манифестировали при наблюдении. Частота рака молочной железы среди 2531 женщины группы дапаглифлозина (n = 10; 0,4%) также оказалась несколько выше, чем среди 1359 женщин контрольной группы (n = 3; 0,22%). Данная разница носила недостоверный характер (р = 0,27). Двум из десяти больных раком молочной железы диагноз поставили в первые шесть недель терапии. Все случаи диагностированы в течение первого года исследования. Следует также отметить, что в соответствующей возрастной группе заболеваемость раком молочной железы составляет 0,25%, пациенты с СД имеют более высокую частоту.
Дополнительные данные и наблюдение до четырех лет в клинических исследованиях показали, что общая доля пациентов со злокачественными и неуточненными опухолями была одинаковой в популяции, получавшей дапаглифлозин и плацебо. Не выявлено также признаков наличия канцерогенности или мутагенности при применении ингибиторов SGLT2. Кроме того, SGLT2 не экспрессируется в мочевом пузыре и молочной железе человека [11].
Исходя из этих данных дапаглифлозин был одобрен FDA после того, как его одобрило Европейское агентство по лекарственным препаратам (ЕМЕА) [16, 39].
Препарат Форсига был зарегистрирован в России в августе 2014 г. Он может назначаться как в монотерапии, так и в комбинации с метформином. Форсига применяется в дозе 10 мг/сут независимо от приема пищи. Препарат может применяться у пациентов с легким нарушением функции почек и любыми нарушениями функции печени.
Коррекция дозы необходима только при тяжелой печеночной недостаточности: начальная доза 5 мг при хорошей переносимости может быть увеличена до 10 мг в сутки. Поскольку эффективность дапаглифлозина зависит от СКФ, его применение не рекомендовано у пациентов с СКФ менее 60 мл/мин. При низких значениях СКФ использование препарата может не приводить к значимому снижению уровня гликемии.
Заключение
Проведенные экспериментальные и клинические исследования свидетельствуют о благоприятном спектре действия ингибиторов SGLT2. Данный класс препаратов предлагает новые инсулиннезависимые механизмы для коррекции гликемии при СД 2 типа при хорошей переносимости, отсутствии негативного влияния на массу тела, риска гипогликемий и других тяжелых побочных эффектов. Безопасность этих препаратов обусловлена крайне узким спектром действия – ингибированием специфического белка, представленного практически только в эпителиальных клетках проксимальных канальцев нефрона.
Определить место нового класса сахароснижающих препаратов в терапии СД 2 типа, а также соотношение «польза/риск» в отдаленном периоде должны результаты новых клинических и эпидемиологических исследований.
Препарат Форсига (дапаглифлозин) в исследованиях продолжительностью 104 недели продемонстрировал долговременную гликемическую эффективность, стабильное снижение массы тела преимущественно за счет жировой массы и низкий риск гипогликемических состояний. Форсига является потенциальной альтернативой препаратам сульфонилмочевины у пациентов, не достигших цели на фоне монотерапии метформином.