Эффективность и безопасность устекинумаба у пациентов с воспалительными заболеваниями кишечника в реальной клинической практике
- Аннотация
- Статья
- Ссылки
- English
Цель – ретроспективная оценка эффективности и переносимости терапии устекинумабом (УСТ) пациентов с БК и ЯК средней и тяжелой степеней тяжести в реальной клинической практике.
Материал и методы. Для оценки эффективности и безопасности УСТ мы включили в исследование 54 пациента с ВЗК (42 – БК, 12 – ЯК), получивших хотя бы одну инъекцию УСТ с декабря 2019 г. по ноябрь 2021 г. в Московском клиническом научно-практическом центре (МКНЦ) им. А.С. Логинова. Средний возраст – 35,5 лет. Анамнез заболевания – от 1 до 26 лет – 9,5 (95% ДИ 7,9–11,1). Подавляющее большинство (92,6%) из них получали предшествующую терапию генно-инженерными биологическими препаратами (ГИБП).
Результаты. Быстрый клинический ответ на третий день лечения, характеризующийся урежением частоты стула, уменьшением интенсивности абдоминального болевого синдрома и улучшением общего самочувствия, был отмечен у 46 (85,2%) из 54 пациентов. Через четыре месяца после первой инъекции УСТ 19 пациентов (БК – 16, ЯК – 3) прошли полное обследование в МКНЦ им. А.С. Логинова. Впоследствии троим из них терапия была отменена по причинам: первичной неэффективности, вторичной неэффективности, неизвестной. У всех пациентов на фоне терапии отмечено снижение активности заболевания: исходные значения индексов всех пациентов – от 8 до 11 баллов, через четыре месяца только у двух пациентов с БК индекс Беста был равен 9, у остальных – находился в интервале от 2 до 5, у трех пациентов с ЯК индекс Мейо был равен 4 баллам. Среднее исходное значение индекса активности БК снизилось через четыре месяца по сравнению с исходным с 9,31 (95% ДИ 8,52–10,11) до 3,81 (95% ДИ 2,66–4,97) балла (p < 0,001), индекса Мейо – с 9,33 (95% ДИ 3,6–15,07) до 3,33 (95% ДИ 0,46–6,2) балла (p = 0,11) соответственно. Ни в одном случае не отмечено нежелательных явлений, которые могли бы послужить причиной отмены препарата.
Заключение. Клиническое наблюдение за группой больных БК и ЯК, как и предшествовавшие многоцентровые исследования, продемонстрировало высокую эффективность УСТ в индукционной и поддерживающей терапии когорты больных тяжелыми и среднетяжелыми формами БК и ЯК, резистентными к базисным препаратам и ГИБП.
Цель – ретроспективная оценка эффективности и переносимости терапии устекинумабом (УСТ) пациентов с БК и ЯК средней и тяжелой степеней тяжести в реальной клинической практике.
Материал и методы. Для оценки эффективности и безопасности УСТ мы включили в исследование 54 пациента с ВЗК (42 – БК, 12 – ЯК), получивших хотя бы одну инъекцию УСТ с декабря 2019 г. по ноябрь 2021 г. в Московском клиническом научно-практическом центре (МКНЦ) им. А.С. Логинова. Средний возраст – 35,5 лет. Анамнез заболевания – от 1 до 26 лет – 9,5 (95% ДИ 7,9–11,1). Подавляющее большинство (92,6%) из них получали предшествующую терапию генно-инженерными биологическими препаратами (ГИБП).
Результаты. Быстрый клинический ответ на третий день лечения, характеризующийся урежением частоты стула, уменьшением интенсивности абдоминального болевого синдрома и улучшением общего самочувствия, был отмечен у 46 (85,2%) из 54 пациентов. Через четыре месяца после первой инъекции УСТ 19 пациентов (БК – 16, ЯК – 3) прошли полное обследование в МКНЦ им. А.С. Логинова. Впоследствии троим из них терапия была отменена по причинам: первичной неэффективности, вторичной неэффективности, неизвестной. У всех пациентов на фоне терапии отмечено снижение активности заболевания: исходные значения индексов всех пациентов – от 8 до 11 баллов, через четыре месяца только у двух пациентов с БК индекс Беста был равен 9, у остальных – находился в интервале от 2 до 5, у трех пациентов с ЯК индекс Мейо был равен 4 баллам. Среднее исходное значение индекса активности БК снизилось через четыре месяца по сравнению с исходным с 9,31 (95% ДИ 8,52–10,11) до 3,81 (95% ДИ 2,66–4,97) балла (p < 0,001), индекса Мейо – с 9,33 (95% ДИ 3,6–15,07) до 3,33 (95% ДИ 0,46–6,2) балла (p = 0,11) соответственно. Ни в одном случае не отмечено нежелательных явлений, которые могли бы послужить причиной отмены препарата.
Заключение. Клиническое наблюдение за группой больных БК и ЯК, как и предшествовавшие многоцентровые исследования, продемонстрировало высокую эффективность УСТ в индукционной и поддерживающей терапии когорты больных тяжелыми и среднетяжелыми формами БК и ЯК, резистентными к базисным препаратам и ГИБП.




Введение
Терапия болезни Крона (БК) и язвенного колита (ЯК) представляет одну из сложных задач современной гастроэнтерологии по причине прогрессирующего характера обоих заболеваний и риска инвалидизации пациентов социально активного возраста.
БК – хроническое, рецидивирующее заболевание желудочно-кишечного тракта неясной этиологии, характеризующееся трансмуральным сегментарным гранулематозным воспалением с развитием местных и системных осложнений [1].
ЯК – хроническое заболевание, которое поражает только толстую кишку и никогда не распространяется на тонкую кишку. Исключение составляет состояние, обозначенное термином «ретроградный илеит», однако это воспаление носит временный характер и не является истинным проявлением ЯК [2].
Базисная терапия обоих заболеваний, включающая топические и системные глюкокортикостероиды (ГКС) и иммуносупрессоры, несколько ограничена в возможностях индукции и поддержания длительной ремиссии у больных воспалительными заболеваниями кишечника (ВЗК). Поэтому терапия инновационными генно-инженерными биологическими препаратами (ГИБП) зачастую остается единственным способом предотвратить последствия тяжелых осложнений, требующих проведения серьезных хирургических вмешательств. Терапия ГИБП значительно повлияла на длительность ремиссии, частоту рецидивов и развитие осложнений ВЗК. Внедрение их в лечебную практику позволило эффективнее преодолевать гормонорезистентность и гормонозависимость ВЗК, снизить риск развития рецидива, уменьшить частоту оперативных вмешательств, а также повысить качество жизни больных [3]. У части пациентов с ВЗК отсутствует первичный ответ на терапию блокаторами фактора некроза опухолей альфа (ФНО-α), что расценивается как первичная неэффективность терапии, которая достигает 10–20% [4, 5]. Кроме того, некоторые пациенты, первоначально ответившие на терапию блокаторами ФНО-α, в 17–22% случаев прекращают лечение в связи с вторичной потерей ответа на терапию или развитием нежелательных явлений [4, 5], а в 19–40% случаев требуется повышение дозы препарата или уменьшение интервалов между введением [5].
Таким образом, существует потребность в разработке новых видов лекарственных препаратов для лечения больных ВЗК, которые позволили бы добиться быстрой индукции клинической ремиссии, снизить риск иммуногенности и иных побочных эффектов и иметь наименьшее число побочных эффектов [4].
Следствием быстрого появления нескольких классов ГИБП: ингибиторов ФНО-α, иногда представленных различными биологическими аналогами (биосимилярами), антагонистов интегриновых рецепторов и ингибиторов интерлейкинов (ИЛ) 12/23 – при относительно высокой стоимости терапии является недостаточно полное представление об особенностях терапии в условиях реальной практики.
В 2019 г. в России для лечения больных БК, а в 2020 г. для лечения пациентов с ЯК зарегистрирован препарат устекинумаб (УСТ). Препарат УСТ представляет собой полностью человеческое моноклональное антитело IgG1κ, которое специфично связывается с общей единицей белка p40 ИЛ-12 и ИЛ-23 человека. УСТ ингибирует биоактивность ИЛ-12 и ИЛ-23 человека, предотвращая связывание p40 с рецептором ИЛ-12Rβ1, экспрессируемым на поверхности иммунных клеток. УСТ не связывается с ИЛ-12 или ИЛ-23, которые уже связаны с рецепторами ИЛ-12Rβ1 на поверхности клеток. Связывая общую субъединицу p40 ИЛ-12 и ИЛ-23, УСТ может влиять на клиническое течение БК и ЯК посредством прерывания пути выработки цитокинов Th1 и Th17, которые играют центральную роль в патогенезе этих заболеваний. У пациентов с БК и ЯК в результате терапии препаратом УСТ отмечалось значимое снижение уровней маркеров воспаления, в том числе С-реактивного белка (CРБ) и фекального кальпротектина (ФКП) [6].
В настоящее время в России накапливается опыт применения УСТ в реальной клинической практике. Данная работа представляет собой опыт применения препарата в Московском клиническом научно-практическом центре (МКНЦ) им. А.С. Логинова у больных с тяжелой и среднетяжелой БК и ЯК.
Цель исследования – оценка эффективности и переносимости терапии препаратом УСТ у пациентов с ЯК и БК средней и тяжелой степени в реальной клинической практике.
Материал и методы
Изучены истории болезни 54 пациентов, получивших хотя бы одну инъекцию УСТ с декабря 2019 г. по ноябрь 2021 г. в МКНЦ им. А.С. Логинова. Для каждого пациента формировался структурированный набор данных, включающий социально-демографическую характеристику (пол, возраст, социальная активность, инвалидность); структуру диагноза; тяжесть (активность) течения заболевания перед началом терапии УСТ; значения индекса активности БК (CDAI; индекс Беста) или индекса активности ЯК (индекс Мейо), концентрации CРБ, концентрации тромбоцитов; информацию об осложненном течении и хирургических вмешательствах, терапии другими ГИБП (очередность и длительность терапии, причина отмены) в анамнезе, о текущем режиме, длительности и причинах прекращения терапии УСТ. Также у пациентов, прошедших полное обследование в МКНЦ им. А.С. Логинова, через четыре месяца после первой инъекции УСТ оценивали значения индекса активности БК (ИАБК – индекс Беста) или индекса активности ЯК (индекс Мейо), концентрации CРБ, концентрации тромбоцитов, которые сравнивались с наблюдаемыми перед началом терапии.
Оценка эффективности препарата и описание исследуемых клинических характеристик пациентов были основаны на рекомендациях Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России [1, 2].
Исследуемые характеристики пациентов оценивали методами описательной статистики. Для непрерывных типов данных указывались среднее значение и границы 95% доверительного интервала (ДИ), медиана, нижний и верхний квартили. Для дискретных и номинальных – число и доля. Для сравнения двух непрерывных нормально распределенных величин использовали критерий Стьюдента для независимых или повторных измерений, в прочих случаях – критерий Манна – Уитни или Вилкоксона. Сравнение номинальных данных проводили с помощью критерия хи-квадрат Пирсона, критерия хи-квадрат с поправкой Йейтса на непрерывность. Проверку статистических гипотез осуществляли на уровне значимости 0,05.
Результаты и обсуждение
Характеристика пациентов
Устекинумаб был назначен 54 пациентам, из них 42 (77,8%) по показанию БК, у остальных 22,2% показанием для назначения явился ЯК. Число мужчин было несколько ниже, чем женщин, среди всех пациентов – 25 (46,3%) и 29 (53,7%) соответственно, пациентов с БК – 18 (46,5%) и 24 (57,1%), но выше среди пациентов с ЯК – 7 (58,3%) и 5 (41,7%). Указанные различия между пациентами с БК и ЯК статистически незначимы (p = 0,53) (табл. 1).
Возраст пациентов находился в интервале от 19 до 75 лет, средний возраст – 35,5 (95% ДИ 32,5–38,6) лет. С момента начала заболевания прошло от года до 26 лет – 9,5 (95% ДИ 7,9–11,1). Различия в возрасте пациентов и длительности БК или ЯК не были статистически значимыми (p > 0,57).
Течение заболевания отмечено как хроническое у всех пациентов, за исключением одного с медикаментозной ремиссией. У половины пациентов был уточнен характер течения: рецидивирующий в 15% и непрерывный в 85% случаев.
Течение заболевания оценивали как тяжелое у 30 (55,6%) пациентов, средней степени тяжести – у 24 (44,4%). При этом доля с тяжелой степенью была большей среди пациентов с БК – 26 (61,9%) по сравнению с таковой среди пациентов с ЯК – 4 (33,3%), но различия не имели статистической значимости (p = 0,15).
Активность (тяжесть текущей атаки) расценивалась как высокая у 21 (38,9%) пациента, умеренная – у 15 (35,7%), легкая или минимальная – у 12 (23,8%). Доли пациентов с умеренной и легкой активностью были несколько выше среди пациентов с ЯК, а с высокой и минимальной активностью – с БК, однако эти различия не были статистически значимыми (p = 0,91).
Среднее значение индекса Беста составило 9,4 (8,8–9,9), медиана – 8,0 (8,0–11,0), индекса Мейо – 8,8 (7,4–10,1) и 8,5 (8,0–10,5) соответственно. Только у 1 (8,3%) пациента с ЯК значение индекса Мейо было менее 6. У большинства – 7 (58,3%) – значения индекса Мейо лежали в интервале от 6 до 9, у 4 (33,3%) – превышали 9. У 17 (40,5%) пациентов с БК значения индекса Беста превышали 9, у остальных – 25 (59,5%) лежали в интервале от 6 до 9.
Средняя концентрация CРБ – 10,9 (95% ДИ 4,7–17,1) мг/л, концентрация тромбоцитов – 306,6 (278,0–335,3) × 109/л. Различия между пациентами с БК и ЯК не были статистически значимыми (p > 0,38).
Гормонорезистентность наблюдали у 17 (31,5%) пациентов, различия между группами БК – 10 (23,8%) и ЯК – 7 (58,3%) лежали на границе статистической значимости (p = 0,055).
Гормонозависимость выявлена у 10 (18,5%) пациентов и в два раза чаще наблюдалась среди пациентов с ЯК – 4 (33,3%), чем у пациентов с БК – 6 (14,3%), но различия не были статистически значимыми (p = 0,28).
Таким образом, у половины пациентов была отмечена либо гормонорезистентность, либо гормонозависимость. К таким пациентам относились 91,7% среди больных с ЯК и 38,1% – с БК (p = 0,003).
Большинство пациентов (55,6%) имели внекишечные проявления: БК – 19 (45,2%) или ЯК – 5 (41,7%) (p = 0,55), 24 (44,4%) пациента не имели внекишечных проявлений.
У 38 (70,4%) пациентов течение заболевания сопровождалось различными осложнениями. Число таковых среди пациентов с БК – 36 (85,7%) было достоверно большим, чем с ЯК – 2 (16,7%) (p < 0,001). Вероятно, следствием этого явился факт, что среди пациентов с ЯК большее число не имело хирургических вмешательств в анамнезе – 9 (75%) и меньшему числу пациентов проводили оперативные вмешательства – резекцию участка кишечника и/или формирование анастомозов – 1 (8,3%), среди больных с БК – 21 (28,6%) (p = 0,01) и 23 (54,8%) (p = 0,012) соответственно. В целом 33 (61,1%) пациента перенесли оперативные вмешательства, 24 (44,4%) пациентам проведена резекция участка кишечника и/или сформирован анастомоз.
Инвалидами второй группы были признаны 12 (22,3%) пациентов, третьей группы – 38 (70,4%), четыре пациента не имели инвалидности.
Предшествующая терапия ГИБП
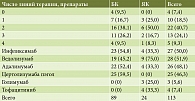
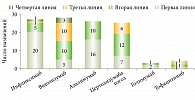
До назначения УСТ не получали ГИБП только 4 (7,4%) пациента. Максимальная длительность терапии ГИБП – 13 лет. Средняя длительность терапии ГИБП – 4,8 (95% ДИ 3,9–5,6) лет и была большей среди пациентов с БК – 5,3 (95% ДИ 4,2–6,3) лет по сравнению с ЯК – 3,0 (95% ДИ 1,9–4,1) (p = 0,024). Пациенты получали терапию ГИБП преимущественно двух классов: ингибиторы ФНО-α (инфликсимаб, адалимумаб, цертолизумаба пэгол), антагонисты интегриновых рецепторов (ведолизумаб). Частота назначений инфликсимаба – 27, адалимумаба – 26, цертолизумаба пэгол – 25, ведолизумаба – 29 случаев, то есть была сопоставимой.
Голимумаб и тофацитиниб назначены в трех и четырех случаях соответственно. Одной трети пациентов различные ГИБП назначались три и более раз. Доля таких пациентов была несколько выше среди пациентов с БК, чем с ЯК (p = 0,7) (табл. 2).
Пациентам с БК терапия ГИБП назначалась 89 раз, ЯК – 24 раза. Всего проведено 113 назначений. Таким образом, в среднем пациент получал более двух назначений ГИБП в анамнезе.
Средняя и медианные оценки длительности терапии отдельными ГИБП находились в интервале от 10 до 28 месяцев для четырех наиболее часто назначаемых препаратов (рис. 1).
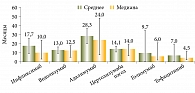
Основной причиной прекращения терапии ГИБП до назначения УСТ явилась ее вторичная неэффективность – 78% случаев. Первичная неэффективность (10,6%) и непереносимость (7,1%) встречались на всех линиях терапии. Прочие причины (социальные, нерегулярное введение, самостоятельная отмена) отмечались в единичных случаях (рис. 2, табл. 3).
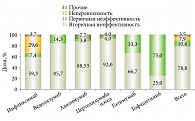
Сравнение частот назначений, причин отмены ГИБП для назначенных препаратов некорректно по причине относительно небольшого числа наблюдений и значительной вариабельности различных условий: длительность, течение, тяжесть и активность заболевания, линия терапии и т.д. Тем не менее инфликсимаб и адалимумаб были назначены в качестве первой линии терапии в 74 и 61% случаев, первой или второй – в 92 и 100% случаев. Ведолизумаб и цертолизумаба пэгол как препараты второй или третьей линии терапии – более чем в 70% случаев (рис. 3). При этом прерывание терапии вследствие первичной неэффективности или непереносимости для инфликсимаба отмечено в 37% случаев назначений, для ведолизумаба – в 14,3%.
Терапия устекинумабом
Препарат УСТ назначался пациентам с ноября 2019 г. Хотя бы одну инъекцию получили все пациенты. Длительность наблюдения составила от 1 до 22 месяцев. Средняя длительность терапии составила 9,2 (95% ДИ 7,7–10,8) месяца, медиана – 8 (5–12) месяцев.
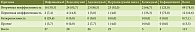
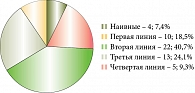
Только 4 (7,4%) пациента ранее не получали ГИБП, препараты первой линии терапии получили 10 (18,5%), второй линии – 22 (40,7%), третьей линии – 13 (24,1%), четвертой линии – 5 (9,3%) (рис. 4).
Всем больным был назначен УСТ в индукционной дозе 390 мг внутривенно капельно. Ранний ответ на терапию УСТ оценивался на первой неделе. Быстрый клинический ответ на третий день лечения, характеризующийся урежением частоты стула, уменьшением интенсивности абдоминального болевого синдрома и улучшением общего самочувствия, был отмечен у 46 (85,2%) из 54 пациентов, включенных в исследование. Скорость достижения клинического ответа в нашем анализе коррелирует с данными, полученными при анализе опросников пациентов, включенных в исследование UNITI-1, – к концу первой недели терапии статистически значимо ниже были показатели частоты стула и наблюдалось улучшение общего самочувствия у пациентов, получавших УСТ, по сравнению с пациентами с БК, получавшими плацебо [17].
На момент окончания наблюдения одну инъекцию 90 мг для подкожного введения каждые 12 недель получали 33 (61,1%) пациента; одну инъекцию 90 мг для подкожного введения каждые восемь недель – 9 (16,7%) пациентов, из которых двум проведена оптимизация режима терапии (через 14 и 18 месяцев). В стадии подбора режима терапии после первого введения находились 4 (7,4%) пациента. Терапия прекращена у 8 (14,8%) пациентов (табл. 4).
В настоящее время терапию УСТ продолжают получать 36 (85,7%) пациентов с БК и 10 (83,3%) с ЯК.
В трех случаях терапия УСТ прервана у пациентов с БК по причине первичной неэффективности, из которых один пациент (УСТ – третья линия ГИБП) переведен на инфликсимаб, второй (третья линия ГИБП) – на ведолизумаб, третий (пятая линия ГИБП) – прооперирован и более не получает ГИБП. Еще в одном случае (третья линия ГИБП) возвращена терапия инфликсимабом по причине вторичной неэффективности. У двух пациентов причина изменения терапии неизвестна: один (вторая линия ГИБП) переведен на инфликсимаб, второй (четвертая линия ГИБП) – не получает терапию ГИБП.
Одному пациенту с ЯК (третья линия ГИБП) вследствие вторичной неэффективности возобновлена терапия инфликсимабом, на терапию которым развилась вторичная неэффективность и аллергическая реакция. В результате этому пациенту проведено оперативное вмешательство. Другому (четвертая линия ГИБП) с началом терапии в январе 2021 г. в связи с отсутствием ответа на проводимую терапию (сохраняющейся диареей, абдоминальным болевым синдромом, анемией, лейкоцитозом, сохраняющимся высоким уровнем CРБ, СОЭ, прокальцитонина и ФКП) были назначены антибактериальная терапия и ГКС и в последующем выполнено хирургическое вмешательство.
Длительность терапии УСТ до отмены у четырех пациентов не превысила трех месяцев, у двух составила девять месяцев, у двух остальных без указания причин прекращения терапии – 21 месяц. К моменту отмены УСТ два пациента получили единственную внутривенную инфузию, трое – продолжали терапию подкожными инъекциями после внутривенной инфузии.
Через четыре месяца после первой инъекции УСТ 19 пациентов (БК – 16, ЯК – 3) прошли полное обследование в МКНЦ им. А.С. Логинова. Впоследствии троим из них терапия была отменена по причинам: первичной неэффективности, вторичной неэффективности, неизвестной.
У всех пациентов на фоне терапии отмечено снижение активности заболевания: исходные значения индексов всех пациентов лежали в интервале от 8 до 11, через четыре месяца только у двух пациентов с БК индекс Беста был равен 9, у остальных был в интервале от 2 до 5, у трех пациентов с ЯК индекс Мейо был равен 4 баллам.
Среднее исходное значение ИАБК снизилось через четыре месяца по сравнению с исходным с 9,31 (95% ДИ 8,52–10,11) до 3,81 (95% ДИ 2,66–4,97) балла (p < 0,001), индекса Мейо – с 9,33 (95% ДИ 3,6–15,07) до 3,33 (95% ДИ 0,46–6,2) балла (p = 0,11) соответственно (рис. 5, табл. 5).
Средние концентрации CРБ и тромбоцитов достоверно не изменились (p > 0,28) (табл. 5).
Полученные нами данные в полной мере согласуются, а в некоторых случаях превосходят данные клинического исследования UNITI-1, в котором пациентов с БК, не ответивших на предшествующую терапию ГИБП, переводили на лечение препаратом УСТ в дозе 390 мг индукционной фазы с последующим переводом на поддерживающую терапию через восемь недель. Согласно исследованию UNITI-1, первичная конечная точка эффективности препарата достоверно превосходит плацебо у пациентов с неэффективностью ингибиторов ФНО-α и стандартной терапии на третьей, шестой и восьмой неделях терапии. Через три, шесть и восемь недель клинический ответ достигнут у 30,1; 33,7 и 37,8% пациентов соответственно [7]. Клиническая ремиссия на УСТ на третьей, шестой и восьмой неделях терапии достигнута у 12,9; 18,5; 20,9% пациентов с БК соответственно.
Долгосрочная эффективность клинической ремиссии терапии среди рандомизированных пациентов в двухлетнем периоде наблюдения составила около 70% [8]. Однако данный анализ нам только предстоит, так как средний период наблюдения у большинства пациентов в настоящее время составляет не более 82 недель от проведения индукционного курса УСТ.
В клинических испытаниях UNITI для анализа эффективности применения УСТ для контроля заживления слизистой проводили эндоскопическое исследование. Пациентам выполняли илеоколоноскопию до рандомизации и на восьмой и 44-й неделях. Наблюдалось снижение по сравнению с исходным значением по баллам простой эндоскопической шкалы для БК (SES-CD). Оно было значительно более существенно у пациентов, получавших устекинумаб, по сравнению с теми, кто получал плацебо [9]. Кроме того, эти результаты были подтверждены в некоторых нерандомизированных исследованиях: R. Battat и соавт. описали эндоскопический ответ у 59% пациентов [10], и С. Ma и соавт. подтвердили эндоскопический ответ в половине случаев [11], что также соответствует результатам нашего исследования.
В целом препарат УСТ характеризовался хорошей переносимостью. Ни в одном случае не отмечено нежелательных явлений, которые могли бы послужить причиной отмены препарата.
Заключение
В терапии ВЗК достигнут значительный прогресс, но сохраняется необходимость в новых терапевтических возможностях, которые могут помочь снизить риски неблагоприятного прогноза, повысить качество жизни пациентов, снизить экономические расходы, связанные с заболеванием, и в идеальном случае изменить естественное течение болезни. Устекинумаб как первый зарегистрированный для терапии БК и ЯК препарат в классе ингибиторов ИЛ-12/23 представляет собой новую перспективную альтернативу в лечении БК.
Наше клиническое наблюдение на группе больных БК, как и предшествующие многоцентровые исследования, проводимые в мире, продемонстрировало высокую эффективность препарата УСТ в индукционной и поддерживающей терапии в когорте больных с тяжелыми и среднетяжелыми, резистентными к базисным и генно-инженерным биологическим препаратам формами БК [7–9].
В нашем исследовании была выявлена тенденция, что возникает необходимость в уменьшении интервала введения УСТ до восьми недель с целью повышения эффективности проводимой терапии у пациентов, получавших ранее один или несколько анти-ФНО-α препаратов.
Группа больных ЯК была меньше, чем группа больных БК, однако результаты анализа группы пациентов с ЯК демонстрируют, что, несмотря на полный объем медикаментозной терапии, проводимой в соответствии с рекомендуемым алгоритмом [2], часть пациентов теряет ответ на терапию ГИБП. Последующее назначение ГИБП с аналогичным (анти-ФНО-α) и иным механизмом действия (блокатор анти-α4β7 интегрина, блокатор янус-киназ) менее эффективно, чем первое назначение препарата. Тем не менее, столкнувшись с прогрессирующим, трудноконтролируемым течением заболевания, развитием осложнений на фоне анти-ФНО-α терапии, назначение УСТ продемонстрировало его высокую эффективность у пациентов с резистентностью к препаратам анти-ФНО-α, анти-α4β7 интегрина и блокатора янус-киназ, позволило добиться клинического ответа в соответствии с современной концепцией терапии ЯК [12].
Согласно исследованию UNITI-2, клинический ответ, клиническая ремиссия, эндоскопическая ремиссия, эндоскопический ответ и заживление слизистой оболочки были более выражены у бионаивных пациентов в сравнении с пациентами с неэффективностью ингибиторов ФНО-α [13, 14]. Однако в нашем исследовании бионаивных пациентов не было. Необходимы дальнейшие исследования для изучения долгосрочной эффективности и безопасности УСТ в реальной клинической практике как у бионаивных пациентов, так и у пациентов с ЯК и БК, получавших ранее биологическую терапию [15]. ![]()
Конфликт интересов
Настоящее исследование проведено при поддержке фармацевтической компании «Янссен».
O.V. Knyazev, MD, Prof., K.A. Nikolskaya, MD, M.V. Chebotareva, E.Yu. Zhulina, MD, A.V. Kagramanova, MD, N.A. Fadeeva, MD, A.I. Parfenov, MD, Prof., D.S. Bordin, MD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Ryzhikh National Medical Research Centre for Coloproctology
Scientific Research Institute of Healthcare and Medical Management of the Moscow City Health Department
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Tver State Medical University
Contact person: Dmytriy S. Bordin, d.bordin@mknc.ru
Relevance. Therapy of Crohn's disease (CD) and ulcerative colitis (UC) still remains an urgent problem in modern gastroenterology. Unfortunately, currently there are not enough medications to achieve clinical, endoscopic, histological remission of inflammatory bowel diseases (IBD).
The aim is to retrospectively evaluate the efficacy and tolerability of ustekinumab (UST) therapy in patients with moderate and severe CD and UC in real clinical practice.
Material and methods. To assess the effectiveness and safety of UST, we included in the study 54 patients with IBD (42 – BC, 12 – UC) who received at least one UST injection from December 2019 to November 2021 at the A.S. Loginov Moscow Clinical Scientific and Practical Center (MCSC). The average age is 35.5 years. Anamnesis of the disease – from 1 to 26 years – 9.5 (95% CI 7.9–11.1). The vast majority (92.6%) of them received previous therapy with genetically engineered biological drugs (GIBD).
Results. A rapid clinical response on the third day of treatment, characterized by a decrease in stool frequency, a decrease in the intensity of abdominal pain syndrome and an improvement in general well-being, was observed in 46 (85.2%) of 54 patients. Four months after the first oral injection, 19 patients (CD – 16, UC – 3) underwent a full examination at the A.S. Loginov MCSC. Subsequently, therapy was canceled for three of them for reasons: primary inefficiency, secondary inefficiency, unknown. A decrease in disease activity was noted in all patients during therapy: the initial values of the indices of all patients were from 8 to 11 points, after four months only two patients with CD had a Best index of 9, the rest had an interval from 2 to 5, in three patients with UC the Mayo index was 4 points. The mean baseline value of the CDAI decreased after four months compared to the baseline from 9.31 (95% CI 8.52–10.11) points to 3.81 (95% CI 2.66–4.97) (p < 0.001), the Mayo index – from 9.33 (95% CI 3.6–15.07) to 3.33 (95% CI 0.46–6.2) points (p = 0.11), respectively. In no case has the appearance of adverse events that could cause the withdrawal of the drug been noted.
Conclusion. Clinical observation of a group of patients with CD and UC, as well as previous multicenter studies, demonstrated the high effectiveness of UST in induction and maintenance therapy of a cohort of patients with severe and moderate forms of CD and UC resistant to basic drugs and GIBP.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.