Эффективность иммунотерапии при метастатической мезотелиоме плевры
- Аннотация
- Статья
- Ссылки
- English
Введение
Мезотелиома плевры – редкая злокачественная опухоль, которая возникает из мезотелия, выстилающего плевру. Болезнь характеризуется агрессивным течением и этиологически объясняется воздействием асбеста. Обычно диагноз устанавливают на поздних стадиях болезни, когда показано только паллиативное лечение. Однако за последние годы удалось достигнуть внушительных успехов в борьбе с этим смертельным заболеванием. Речь, в частности, идет о такой опции, как иммунотерапия.
Клинический случай
34-летняя женщина в январе 2020 г. была госпитализирована по каналу скорой помощи с жалобами на выраженную одышку в покое, сухой кашель и периодическое повышение температуры до 37,5 °С. Семейный и трудовой анамнезы не отягощены.
В ходе ультразвукового исследования плевральных полостей выявлены узловые образования и большое количество жидкости. При плевральной пункции эвакуировано 2,5 л серозной жидкости. Выполнена видеоторакоскопическая биопсия узлового образования с плевры справа. По результатам гистологического исследования – подозрение на плоскоклеточный рак. Учитывая несоответствие клинической картины морфологическому диагнозу, в Московском клиническом научно-практическом центре им. А.С. Логинова провели иммуногистохимическое исследование. Экспрессия подопланина, кальретинина, p53 и цитокератина AE1/AE3 в опухолевых клетках свидетельствовала о наличии у пациентки мезотелиомы легкого.
При повторной компьютерной томографии (КТ) выявлены многочисленные узловые образования по плевре с инвазией в мягкие ткани грудной клетки сзади. Принимая во внимание многоочаговое распространение на окружающие мягкие ткани, процесс расценили технически нерезектабельным (T4 – стадия IIIB).
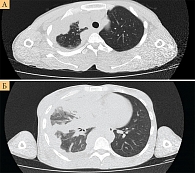
В рамках стандарта первой линии терапии распространенной мезотелиомы плевры был выбран режим «пеметрексед 500 мг/м2 в первый день и цисплатин 75 мг/м2 в первый день каждого 21-дневного цикла». Пациентка переносила лечение удовлетворительно и уже после второго курса терапии отмечала снижение выраженности болевого синдрома и уменьшение самого крупного образования (9–10-е межреберье по заднеподмышечной линии). С учетом положительной динамики на фоне противоопухолевого лечения и данных исследования MAPS проводимую терапию усилили препаратом бевацизумаб 15 мг/кг каждые три недели. К сожалению, эффект от терапии оказался недлительным. При контрольном обследовании после шестого курса терапии зафиксировано прогрессирование заболевания в виде увеличения объема поражения париетальной и висцеральной плевры правого легкого, увеличения конгломератов внутригрудных лимфатических узлов и появления ненапряженного асцита (рис. 1).
Соматический статус пациентки снизился с 1 до 2 по шкале ECOG, усилился болевой синдром с 2 до 5 баллов по визуальной аналоговой шкале в области образования мягких тканей на уровне 9–10-го межреберья по заднеподмышечной линии. В целях купирования болевого синдрома в августе 2020 г. провели курс паллиативной лучевой терапии на опухоль грудной стенки справа (разовая очаговая доза (РОД) 6 Гр, суммарная очаговая доза (СОД) 24 Гр) и зону поражения костальной плевры и мягких тканей в области 9-го и 10-го межреберья по заднеподмышечной линии справа (РОД 4 Гр, СОД 24 Гр). Поскольку опухолевый процесс прогрессировал, пациентке была показана противоопухолевая терапия второй линии. Ее выбор основывался на позитивных данных исследований INITIATE и MAPS2 [1, 2]. Иммунотерапию в режиме «ниволумаб в дозе 3 мг/кг каждые три недели + ипилимумаб 1 мг/кг каждые шесть недель» пациентка переносила удовлетворительно, без какой-либо токсичности.
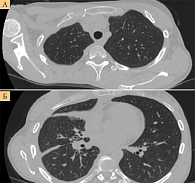
КТ после трех курсов иммунотерапии показала частичный регресс опухоли: уменьшение объема узлового поражения плевры правого легкого, внутригрудных лимфатических узлов и подмышечных лимфоузлов справа более чем на 50%, полный регресс узлового образования мягких тканей на уровне 8–9-го межреберья справа и уменьшение размеров рядом расположенного узла, расправление и восстановление воздушности легочной ткани правого легкого, отсутствие асцита (рис. 2). Однако пациентка отметила появление учащенного сердцебиения и нарастание одышки. При эхокардиографии визуализировалась жидкость в перикарде с сепарацией листков на 35 мм. Выполнена эвакуация жидкости из перикарда, проведена фотодинамическая терапия на область перикарда и остаточных очагов по плевре с положительным клиническим эффектом. Продолжена иммунотерапия в прежнем режиме.
ПЭТ (позитронно-эмиссионная томография)/КТ показала уменьшение метаболизма и размеров внутригрудных лимфатических узлов, очаги по плевре прежних размеров – сохранялся частичный ответ опухоли. На текущий момент пациентка получает иммунотерапию свыше 20 месяцев без клинического ухудшения самочувствия. При последнем контроле в январе 2022 г. признаки прогрессирования заболевания отсутствовали.
Обсуждение
Мезотелиома представляет собой крайне агрессивное заболевание, возникающее из мезотелия плевральной и брюшной полостей, влагалищной оболочки или перикарда. В 80% случаев заболевание имеет плевральное происхождение. Наиболее распространенной причиной развития злокачественной мезотелиомы является ингаляционное воздействие асбеста, причем примерно в 70% случаев задокументированное.
С 2003 г. химиотерапия цисплатином в комбинации с пеметрекседом стала стандартом лечения мезотелиомы плевры. Добавление к цисплатину пеметрекседа позволило увеличить медиану общей выживаемости с 9,3 до 12,1 месяца, а частоту объективного ответа – с 17 до 41% [3].
Следует отметить, что в исследовании EMPHACIS у пациентов, получавших сопроводительную терапию фолиевой кислотой и витамином B12, отмечался наибольший выигрыш в выживаемости с меньшей токсичностью [3]. Исследование MAPS стало следующим ключевым событием. Добавление антиангиогенного препарата бевацизумаб к известной комбинации цисплатина и пеметрекседа способствовало увеличению медианы выживаемости без прогрессирования с 7,3 до 9,2 месяца, медианы общей выживаемости – с 16,1 до 18,8 месяца. При этом возросла токсичность лечения, в частности увеличилась частота артериальной гипертензии, тромбоэмболических осложнений и протеинурии [4]. Однако до недавнего времени эффективность второй линии терапии при раннем прогрессировании заболевания (менее шести месяцев от момента окончания последнего курса химиотерапии) нельзя было назвать выдающейся. Наиболее часто используемыми препаратами были винорелбин в монорежиме (медиана общей выживаемости – 9,2 месяца, частота объективного ответа – 16%) [5] или в комбинации с гемцитабином (медиана общей выживаемости – 10,9 месяца, частота объективного ответа – 10%) [6].
Крупный метаанализ 49 исследований второй линии терапии мезотелиомы показал необходимость дальнейших исследований новых препаратов (медиана объединенной общей выживаемости – 7,86 месяца, частота объективного ответа всего 8,63%) [7, 8].
Настоящим прорывом во второй линии лечения мезотелиомы плевры стало внедрение иммунотерапии. Исследование MAPS2 продемонстрировало многообещающую активность ниволумаба в монорежиме и комбинированной иммунотерапии ниволумабом и ипилимумабом без неожиданной токсичности. Медиана общей выживаемости составила 15,9 месяца в группе комбинированной иммунотерапии. Общая выживаемость и выживаемость без прогрессирования не зависели от уровня экспрессии PD-L1 [1].
Эффективность комбинации ниволумаба и ипилимумаба также отмечалась в датском исследовании II фазы INITIATE, в котором частота объективного ответа достигла 29%, контроль за заболеванием наблюдался у 68% пациентов [2].
Результаты исследования II фазы иммунопрепарата тремелимумаб и исследования III фазы пембролизумаба оказались негативными у больных распространенной мезотелиомой, получавших терапию второй линии [9, 10].
В 2020 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило использование комбинации ниволумаба и ипилимумаба уже в первой линии лечения, опираясь на данные исследования CheckMate 743 [11] – первого крупного рандомизированного исследования III фазы, подтвердившего преимущество комбинированной иммунотерапии перед стандартом терапии цисплатином и пеметрекседом. Преимущество отмечалось во всех исследуемых группах, особенно в группе пациентов с неэпителиоидной гистологией. Медиана общей выживаемости в группе иммунотерапии составила 18,1 месяца, в группе стандартной терапии – 14,1 месяца. У пациентов с мезотелиомой неэпителиоидной гистологии медиана общей выживаемости составила 18,1 и 8,8 месяца соответственно.
В настоящее время проводятся свыше десяти крупных рандомизированных исследований иммуноонкологических препаратов для лечения резектабельной или распространенной мезотелиомы плевры [12].
Возможность назначения иммунотерапии в рамках второй и последующих линий лечения мезотелиомы плевры отражена в клинических рекомендациях Ассоциации онкологов России и RUSSCO.
Представленный клинический случай демонстрирует эффективность и удовлетворительную переносимость комбинированной иммунотерапии у пациентки с мезотелиомой плевры.
S.A. Smolin, P.S. Feoktistova, PhD, A.V. Smolin, PhD
A.S. Loginov Moscow Clinical Scientific and Practical Center
N.N. Burdenko Main Military Clinical Hospital
Contact person: Sergey A. Smolin, s.smolin@mknc.ru
The article presents a clinical case of the effectiveness of immunotherapy for metastatic pleural mesothelioma in a young woman, which is still rare for Russia.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.