Эффективность комбинаций вальпроата с леветирацетамом, топираматом или ламотриджином у детей с резистентной фокальной эпилепсией – открытое наблюдательное исследование
- Аннотация
- Статья
- Ссылки
- English


Введение
Разработка новых антиэпилептических препаратов (АЭП) позволяет надеяться на получение лучших результатов в лечении эпилепсии у детей. Однако растущее число лекарственных средств также затрудняет выбор оптимального препарата или комбинации препаратов. Только в немногих имеющихся клинических исследованиях проводилось сравнение различных АЭП при эпилепсии у детей. Многие контролируемые исследования АЭП не включают больных с педиатрическими синдромами.
Практически все зарегистрированные АЭП могут использоваться в лечении фокальной (парциальной) эпилепсии, поэтому выбор первого, второго препарата или комбинации АЭП в большой степени зависит от того, какие препараты являются наиболее привычными для врача. Два АЭП – вальпроат натрия и карбамазепин – уже давно признаны в качестве препаратов первого выбора. Так, недавно J. Jedrzejczak и соавт. показали, что вальпроат является эффективным и хорошо переносимым средством первого выбора для монотерапии при парциальной эпилепсии [1]. В соответствии с рекомендациями Консенсуса специализированной Рабочей группы Комиссии по стратегии лечения Международной противоэпилептической лиги (International League Against Epilepsy – ILAE, Commission on Therapeutic Strategies, 2010), в случае неэффективности обоих препаратов первого выбора (в виде монотерапии или в комбинации) такую эпилепсию называют резистентной [2]. Какой АЭП будет оптимальным в качестве дополнительной терапии у ребенка, уже получающего вальпроевую кислоту? Фактически все новые АЭП – ламотриджин, топирамат, леветирацетам – эффективны как дополнительные препараты в лечении фокальной эпилепсии у детей [3]. Использование какой из этих комбинаций АЭП будет наиболее рациональным (эффективным и безопасным)? Международный консенсус по этому вопросу отсутствует [3].
Целью настоящего исследования являлась оценка эффективности и переносимости «новых» антиэпилептических препаратов (леветирацетам, топирамат, ламотриджин) в комбинации с вальпроевой кислотой как основным препаратом в лечении детей с резистентной симптоматической или криптогенной фокальной эпилепсией.
Материал и методы
Дизайн исследования
Данное исследование было открытым, проспективным, наблюдательным и максимально приближенным к обычной клинической практике. Длительность его составляла 12 месяцев. Исследование проводилось на базе отделения психоневрологии и эпилептологии ФГБУ «Московский НИИ педиатрии и детской хирургии» Минздрава России, Москва.
Критерии включения/исключения
В исследование включали детей в возрасте до 18 лет (от 1 до 18 лет) с симптоматической или криптогенной эпилепсией. Диагноз эпилепсии устанавливали в соответствии с критериями Международной противоэпилептической лиги (International League Against Epilepsy – ILAE) и Международного бюро по борьбе с эпилепсией (International Bureau for Epilepsy) [4]. Тип эпилептического приступа определяли в соответствии с Предлагаемой диагностической схемой для лиц с эпилептическими приступами и эпилепсией (Proposed Diagnostic Schema for People with Epileptic Seizures and with Epilepsy) [5].
Кроме формы эпилепсии, критериями включения являлись:
- подтвержденная частота эпилептических приступов не менее 2 раз в месяц в течение 2 предшествующих месяцев;
- подтвержденная резистентность к препаратам (неэффективность первой и второй попыток монотерапии АЭП);
- комбинированная терапия вальпроатом в качестве основного противосудорожного средства и леветирацетамом или топираматом или ламотриджином в качестве дополнительного.
Критерии исключения включали наличие противопоказаний, указанных в инструкции по применению препаратов; беременность; гиперчувствительность к вальпроату; заболевания печени; генерализованные формы эпилепсии и любые другие острые или хронические заболевания, способные повлиять на ход исследования.
Лечение
Все пациенты получали вальпроат натрия замедленного высвобождения в максимальных переносимых дозах. Дополнительные препараты (леветирацетам, топирамат, ламотриджин) распределялись в последовательном порядке (так, первый пациент получал терапию группы 1 – дополнительный препарат леветирацетам; второй – терапию группы 2 – топирамат; третий – ламотриджин; четвертый – вновь леветирацетам и т.д.). Дозы АЭП корректировали в зависимости от клинических проявлений (частота приступов, переносимость препарата) и результатов электроэнцефалографии (ЭЭГ); дозы варьировали от средних до максимальных переносимых. Терапию леветирацетамом начинали с 10–20 мг/кг/сут; дозу увеличивали на 20 мг/кг/сут каждые 2 недели. Начальная доза топирамата составляла 1 мг/кг/сут; дозу увеличивали каждую 1–2 недели на 1–3 мг/кг/сут также до достижения индивидуальной эффективной или максимальной переносимой дозы. Начальная доза ламотриджина в комбинации с вальпроатом составляла 0,15 мг/кг/сут; дозу увеличивали каждые 2 недели на 0,3 мг/кг в течение первых месяцев титрования, затем каждую неделю – до индивидуальной эффективной или максимальной переносимой дозы. Применение других АЭП не разрешалось. Лечение отслеживали в течение 1, 3, 6 и 12 месяцев (в эти временные промежутки проводили визиты последующего наблюдения).
Оценка эффективности
Основным критерием оценки эффективности являлась частота ремиссии по эпилептическим приступам через 6 месяцев, которую определяли по доле пациентов, не имеющих приступов. Дополнительным критерием оценки эффективности служил уровень удержания на препарате, который определяли как долю пациентов, продолжающих лечение через 12 месяцев.
Критерии оценки безопасности
Безопасность оценивали путем регистрации спонтанных сообщений о побочных эффектах на протяжении всего исследования.
Статистический анализ
Компьютерный статистический анализ полученных результатов проводили с использованием пакета программ STATISTIСA (версия 6.0). Для оценки корреляции качественных показателей применяли таблицы сопряженности признаков. Значимость корреляции оценивали по критерию Пирсона (хи-квадрат). В качестве уровня значимости при оценке достоверности различий был выбран р < 0,05. При анализе количественных показателей рассчитывали средние значения и ошибку среднего.
Результаты
Исследуемая популяция
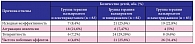
В исследование включили 248 детей. Средний возраст составил 8,8 ± 3,7 года. Доля пациентов мужского пола составляла 61%. 204 из 248 детей (82,3%) имели симптоматическую фокальную эпилепсию, 44 из 248 (17,7%) – криптогенную фокальную эпилепсию. У 35% пациентов эпилепсия началась в течение первого года жизни, у 38% – в возрасте от 1 до 6 лет, у 27% – после 6 лет. Средняя частота судорожных приступов на фоне терапии вальпроатом перед добавлением леветирацетама, топирамата или ламотриджина равнялась 14,2 ± 2,6 в неделю. 72 из 178 (40%) детей имели изменения в неврологическом статусе, 92 (51%) – задержку двигательного и интеллектуального развития разной степени выраженности.
Пациентов разделили на 3 группы: в первой группе пациенты получали вальпроат и леветирацетам – как дополнительный препарат (n = 83), во второй группе дети получали вальпроат и топирамат (n = 82), в третьей группе – вальпроат и ламотриджин (n = 83). Группы были сопоставимы по возрасту, половому составу, продолжительности заболевания, частоте приступов (табл. 1), доле пациентов с нарушениями двигательного и интеллектуального развития и типам эпилептических приступов.
Дозы препаратов
Через 6 месяцев терапии средняя суточная доза вальпроата составила 39,6 ± 2,2 мг/кг/сут (от 20 до 55 мг/кг/сут), средняя доза леветирацетама – 48,11 ± 2,6 мг/кг/сут (от 25 до 75 мг/кг/сут). Средняя доза топирамата составляла 6,8 ± 0,8 мг/кг/сут (от 3,9 до 11 мг/кг/сут). Средняя доза ламотриджина, принимаемого в комбинации с вальпроатом, равнялась 5,1 ± 0,8 мг/кг/сут (от 2,8 до 10 мг/кг/сут, дозы более 5 мг/кг/сут использовались редко и только у детей старше 12 лет).
Эффективность
Основным критерием оценки эффективности являлась частота ремиссии по эпилептическим приступам через 6 месяцев. Она составляла 42,2% (35/83) в группе приема вальпроата и леветирацетама; 13,4% (11/82) в группе комбинации вальпроата и топирамата и 21,6% (18/83) в группе комбинации вальпроата и ламотриджина. Таким образом, частота ремиссии в первой группе была статистически значимо выше, чем во второй и третьей группах (р < 0,05). Уменьшение частоты эпилептических приступов (более чем на 50%) отмечено у 15,66% (15/83) детей, получавших вальпроат и леветирацетам, у 14,6% (12/82) детей в группе вальпроата и топирамата и у 17,64% (15/83) детей, получавших вальпроат и ламотриджин. Следовательно, при анализе эффективности показано, что общее количество пациентов, ответивших на лечение в каждой группе (полная ремиссия или значительное клиническое улучшение), составило 57,86%, 28% и 39,2% соответственно.
В качестве дополнительного критерия оценки эффективности определяли уровень удержания на препарате через 12 месяцев для всех трех комбинаций АЭП. Уровень удержания на препарате через 12 месяцев исследования составлял 50,6% (42/83) в первой группе (вальпроат и леветирацетам), 39% (32/82) во второй группе (вальпроат и топирамат) и 53% (44/83) в третьей группе (вальпроат и ламотриджин). Наиболее низкий уровень удержания через 12 месяцев отмечен во второй группе (терапия вальпроатом и топираматом), однако эти различия не достигли уровня статистической значимости (p = 0,4).
Преждевременная отмена дополнительного препарата
Основные причины преждевременной отмены терапии включали исходную неэффективность, аггравацию течения эпилепсии, развитие толерантности к препарату и побочные эффекты (табл. 2). Аггравацию течения эпилепсии определяли как увеличение частоты и/или появление новых типов судорожных припадков в сочетании с увеличением количества эпилептиформных паттернов на ЭЭГ [6]. Толерантность к АЭП определяли как клиническую ситуацию, в которой реакция пациента на лекарственный препарат со временем уменьшалась, несмотря на то что доза или концентрация применяемого препарата оставались прежними. Это означало, что для достижения прежнего эффекта требовались более высокие дозы [7].
В первой группе (вальпроат и леветирацетам) количество детей, не ответивших на лечение, было статистически значимо ниже, чем в первых двух группах (р < 0,01). Факторами прогноза исходной неэффективности считались дебют эпилепсии в возрасте менее 5 лет (р < 0,04) и высокая (более 10 раз в неделю) частота судорожных припадков до начала лечения (р < 0,02). Еще одним фактором неблагоприятного прогноза при лечении леветирацетамом служит задержка развития (р < 0,01).
Аггравация эпилептических приступов отмечена у 18/83 (21,6%), 6/82 (7,47%) и 4/83 (5%) детей в 1, 2 и 3-й группах соответственно. Самое большое количество пациентов с аггравацией отмечалось в первой группе (вальпроат и леветирацетам) (различия со второй и третьей группами статистически значимы, p < 0,01). Обычно аггравация приступов наблюдалась в начале терапии (после добавления леветирацетама). Факторами, увеличивающими риск развития аггравации при применении леветирацетама, были высокая частота приступов и их вторично-генерализованный характер (p < 0,01). У детей, получавших топирамат, фактором риска развития аггравации могла являться вторичная билатеральная синхронизация на ЭЭГ (однако статистическая значимость этого фактора не была достигнута из-за малого количества случаев).
Толерантность развилась у 6/83 (7,2%) детей в первой группе, у 24/82 (29,26%) детей во второй группе и у 8/83 (9,6%) детей в третьей группе. Таким образом, развитие толерантности достоверно чаще отмечалось у пациентов второй группы (терапия вальпроатом и топираматом), чем в первой и третьей группах (p < 0,04). У детей с задержкой развития толерантность наблюдалась значительно чаще при любой схеме терапии (p = 0,02).
Переносимость комбинаций
Наиболее частые побочные эффекты в начале терапии дополнительными препаратами включали сыпь, симптомы нейротоксичности и симптомы со стороны желудочно-кишечного тракта (табл. 3).
Почти у 20% пациентов, получавших вальпроат и ламотриджин, развилась сыпь; это нежелательное явление не отмечено в других группах. Большинство побочных эффектов (кроме сыпи) были умеренно выраженными, дозозависимыми и не требовали отмены терапии. Серьезный побочный эффект развился у одного пациента (почечная недостаточность). Этот ребенок получал в качестве дополнительного средства топирамат; после развития побочного эффекта диагностирован порок развития почек, и топирамат был отменен. Чаще всего отмена препарата из-за развития нежелательных реакций происходила в группе ламотриджина – у 26 детей (31,4%), реже – в группе топирамата – у 21 (25,6%); наиболее редко из-за побочных эффектов отменялся леветирацетам – у 4 детей (4,8%) (различия с группами ламотриджина и топирамата статистически значимы, p < 0,01). Таким образом, согласно полученным результатам, леветирацетам в комбинации с вальпроатом обладает наилучшей переносимостью при длительном применении. Для этой комбинации была характерна наименьшая частота нежелательных реакций, за исключением аггравации эпилептических приступов (p < 0,01).
Анализ данных позволил установить, что пациенты с побочными эффектами были младше, чем дети с хорошей переносимостью терапии. Так как наиболее частым побочным эффектом в группе ламотриджина была сыпь (у 19,3% детей), мы сделали вывод о том, что возраст младше 3 лет является значимым фактором риска появления сыпи.
Обсуждение результатов
При принятии решений о назначении терапии пациенту с эпилепсией врач опирается на информацию из множества источников. Несмотря на широкое распространение принципов доказательной медицины, применение такого подхода в детской неврологии часто бывает затруднительным в связи с малым количеством двойных слепых исследований по эффективности и переносимости АЭП у детей. Всегда будут существовать вопросы, для ответа на которые пока не проведено рандомизированных контролируемых исследований, и при принятии решений приходится довольствоваться данными более низкого уровня доказательности, а именно данными открытых наблюдательных исследований. Настоящее исследование имеет ряд ограничений в том, что касается дизайна и интерпретации результатов. Определение резистентной эпилепсии требует уточнения. Это обусловлено тем, что врачи и исследователи пользуются разными критериями, а в некоторых случаях критерии и вовсе отсутствуют – все это затрудняет сравнение результатов исследований и выработку практических рекомендаций [2]. В нашей работе мы руководствовались следующим определением: «О резистентной эпилепсии говорят в том случае, если две попытки адекватно подобранной и переносимой терапии АЭП (в виде монотерапии или комбинации) не позволили достигнуть устойчивого контроля эпилептических приступов» [2]. Однако мы хорошо понимаем, что этот подход является эмпирическим и требует проверки в проспективных исследованиях.
Данные неконтролируемых исследований могут вводить в заблуждение, так как уменьшение тяжести течения эпилепсии иногда бывает связано со спонтанными колебаниями частоты приступов и психогенными факторами. Именно поэтому полученные данные могут вызывать определенные сомнения. Так, например, для того чтобы доказать, что конкретный АЭП вызывает аггравацию эпилепсии, препарат должен назначаться дважды, и каждый раз должно регистрироваться увеличение частоты приступов и ухудшение картины ЭЭГ после начала приема и улучшение после отмены препарата (в нашем исследовании таких попыток не было предпринято). Кроме того, хорошо известно, что частота аггравации течения эпилепсии при применении АЭП нередко переоценивается. Прежде чем делать вывод о том, что увеличение частоты приступов после начала приема нового препарата отражает фармакодинамическую аггравацию, необходимо исключить другие возможные причины ухудшения. К ним относятся спонтанные колебания частоты приступов, влияние факторов, известных своей способностью ухудшать течение эпилепсии (например, дефицит сна, алкоголь и психотропные препараты), прогрессирование эпилепсии и др. [6]. Поскольку во время исследования не проводилось измерения концентраций вальпроата и других АЭП в сыворотке крови, нельзя с уверенностью говорить о том, что применялись достаточные дозы препаратов. В этой связи мы можем говорить только о «предположительно» резистентном характере эпилепсии, «предположительных» аггравации и толерантности. Тем не менее можно утверждать, что в нашем исследовании в группе детей с резистентной фокальной эпилепсией, наблюдавшихся в условиях реальной клинической практики, нам удалось показать сравнительную эффективность и переносимость терапии двумя препаратами – вальпроатом и одним из «новых» противоэпилептических средств. Частота ремиссии по эпилептическим приступам через 6 месяцев – основной критерий оценки эффективности, использовавшийся в нашей работе, – считается наиболее адекватным параметром оценки эффективности в клинических исследованиях АЭП [8].
Частота ремиссии через 6 месяцев составила 42,2% в группе комбинации вальпроата и леветирацетама; 13,4% в группе вальпроата и топирамата; 21,6% в группе вальпроата и ламотриджина. Таким образом, частота ремиссии (особенно в группе леветирацетама) намного превосходит частоту в рандомизированных клинических исследованиях леветирацетама, топирамата и ламотриджина в качестве дополнительной терапии при парциальных припадках [9]. Эти данные также отчасти противоречат результатам обсервационных когортных исследований у взрослых [2, 10] и детей [11] с впервые выявленной эпилепсией, на основании которых возникло мнение о том, что вероятность достижения контроля эпилептических приступов у пациентов, которые ранее не ответили на адекватные попытки терапии двумя АЭП, очень невелика. Данные недавнего проспективного педиатрического исследования свидетельствовали о том, что, хотя у многих пациентов, безуспешно леченных в двух информативных исследованиях АЭП, могли отмечаться периоды без судорожных припадков в дальнейших исследованиях, возможность достижения длительной ремиссии оставалась спорной [12]. Однако у авторов некоторых других работ появились основания высказать предположение о том, что у части таких пациентов все же возможно достижение контроля над приступами путем дальнейшего подбора лекарственных препаратов [13, 14].
Уровень удержания на препарате является интегративным показателем, отражающим как эффективность АЭП, так и его переносимость. Уровень удержания на терапии в течение 12 месяцев исследования составил 50,6% в первой группе (вальпроат и леветирацетам), 39% во второй группе (вальпроат и топирамат) и 53% в третьей группе (вальпроат и ламотриджин). В целом комбинация вальпроата и топирамата имела наименьший уровень удержания при длительном применении, но различия между группами были статистически не значимыми (p = 0,4). Не у всех пациентов в исследовании был достигнут контроль над эпилепсией, и многие продолжали принимать АЭП даже в случае их недостаточной эффективности. Таким образом, уровень удержания в большей степени отражает переносимость АЭП, чем их эффективность. Следовательно, выводы о том, что комбинация вальпроата с леветирацетамом превосходит по эффективности комбинацию вальпроата с топираматом, следует делать с большой осторожностью, особенно если эти выводы основаны только на указанных выше данных.
Помимо сравнительной оценки уровней удержания, в исследовании получена и другая значимая информация. Частота аггравации эпилепсии в нашем исследовании была более высокой при добавлении леветирацетама к вальпроату (21,6%); дополнительная терапия ламотриджином сопровождалась аггравацией в 5% случаев, топирамата – в 7,47%. Парадоксальное усугубление судорожного синдрома при применении леветирацетама уже описано в литературе [15]. Нам представляется, что довольно высокий уровень аггравации при комбинировании вальпроата и леветирацетама был, по всей видимости, обусловлен быстрым темпом наращивания дозы второго препарата. Имеются данные, свидетельствующие о том, что более медленная титрация может уменьшить риск аггравации [15]. Более частое развитие толерантности отмечали в группе топирамата (29,3%) по сравнению с группами ламотриджина и леветирацетама (только 9,6% и 7,2% соответственно).
У пациентов без аггравации комбинация вальпроата и леветирацетама переносилась лучше, чем две другие используемые схемы терапии. Как аггравация, так и толерантность приводили к отмене дополнительного препарата. Чаще всего препарат отменяли из-за развития побочных эффектов в группе ламотриджина – у 31,4% детей (почти у каждого пятого пациента развивалась сыпь), реже в группе топирамата – у 25,6% детей; наименьшая частота отмены наблюдалась при приеме леветирацетама – у 4 детей (4,8%, p < 0,01). Характер наблюдавшихся побочных эффектов соответствовал данным, полученным в рандомизированных клинических исследованиях [9]; не отмечено незарегистрированных нежелательных явлений.
Выводы
Результаты исследования показали, что применение леветирацетама в качестве дополнительного препарата вместе с вальпроатом у детей с резистентной симптоматической и криптогенной эпилепсией сопровождалось более частым достижением ремиссии и меньшей частотой отмены препарата из-за побочных эффектов (по сравнению с другими исследуемыми препаратами). В этой же популяции добавление ламотриджина к вальпроату почти в 1/5 случаев приводило к появлению сыпи, которая являлась причиной отмены препарата и чаще отмечалась у детей в возрасте до 3 лет. Дополнительная терапия топираматом сопровождалась наименьшим уровнем удержания на терапии через 12 месяцев исследования, наибольшей частотой развития толерантности и относительно низкой частотой аггравации. Мы полагаем, что назначение топирамата (в дополнение к вальпроату) оправдано у пациентов, относящихся к группе высокого риска неэффективности ламотриджина или леветирацетама, или при резистентности к этим препаратам.
Efficacy of valproate combinations with lamotrigine, or topiramate, or levetiracetam in children with drug resistant focal epilesy. An open-label observational study
Ye.D. Belousova, I.V. Shulyakov, A.Yu. Yermakov
Federal State Budgetary Institution ‘Federal Research Institute of Pediatrics and Pediatric Surgery’ of the Ministry of Health of Russia, Moscow
Contact person: Yelena Dmitriyevna Belousova, ebelousova@inbox.ru
There is no international pediatric consensus on optimal antiepileptic drugs combination for the treatment of resistant symptomatic and cryptogenic focal epilepsies in children. The aim of the study was to evaluate efficacy and tolerability of the “new” antiepileptic drugs (AED) lamotrigine, topiramate, levetiracetam in dual-therapy regimen with valproic acid as basic AED in children with resistant symptomatic and probably symptomatic focal epilepsies.
This was an open-label, prospective, observational study performed in real practice setting. The study duration was 12 months. 248 children under 18 years old (from 1 to 18 years) with resistant symptomatic and cryptogenic focal epilepsies were included. They were receiving the dual-therapy with valproate as a basic anticonvulsant and lamotrigine or topiramate or levetiracetam as an additional one. The primary efficacy outcome criterion was the remission rate at 6 months, secondary outcome criteria was the retention rate at 12 months of therapy. Safety was assessed by recording of spontaneously reported adverse events throughout the study.
The remission rate at 6 months was 21,6% in group of patients receiving combination of valproate and lamotrigine (18/83); 13,4% – in group with valproate and topiramate (11/82); 42.2% – in group with valproate and levetiracetam (35/83) (р < 0,05). The observed retention rate at the 12 months in the trial was 53% (44/83) in the first group (valproate and lamotrigine), 39% (32/82) in the second group (valproate and topiramate) and 50,6% (42/83) in the third group (valproate and levetiracetam). Aggravation of seizures was observed in 4/83 (5%), 6/82 (7.47%) and 18/83 (21.6%) children from 1, 2 and 3 groups, respectively (p < 0,01). Tolerance developed in 8/83 (9.6%), in 24/82 (29.26%) and in 6/83 (7.2%) children, respectively. Drug withdrawal due to adverse reactions (with exclusion of aggravation effect) was mostly related with lamotrigine – in 26/83 children (31.4%), less frequently with topiramate – in 21/82 (25.6%) and levetiracetam – in 4/83 children (4.8%) (p < 0,01). In those children with resistant focal epilepsies, who did not aggravate, combination of valproate and levetiracetam was better tolerated than valproate/lamotrigine and valproate/topiramate combinations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.