Эффективность нового антигистаминного препарата в комплексной терапии атопического дерматита у детей
- Аннотация
- Статья
- Ссылки


Термин «аллергия» происходит от двух греческих слов: «аллос» – другой, иной и «эргос» – действие. Буквальный перевод слова означает, таким образом, «действие по-другому». В современной науке данное понятие определяется следующим образом: аллергия – это состояние патологически повышенной реакции организма на какие-либо вещества чужеродной природы, в основе которой лежат иммунологические механизмы. Патологические состояния, характеризующиеся образованием антител и специфически реагирующих лимфоцитов, развиваются в ответ на контакт с соответствующим аллергеном (или аллергенами), который рассматривается как этиологический фактор (или факторы) болезни.
Аллергический ответ является очень сложным процессом, который включает в себя дегрануляцию тучных клеток, активацию Т-лимфоцитов, эпителиальных и эндотелиальных клеток, накопление в тканях эозинофилов и в меньшей степени базофилов, а также синтез и высвобождение хемокинов. Образование и секреция медиаторов тучными клетками, эозинофилами и базофилами прямо и/или косвенно способствует появлению симптомов аллергии.
В основе острых аллергических реакций лежит гиперчувствительность немедленного типа. Ее опосредуют молекулы, которые высвобождаются тучными клетками при взаимодействии аллергена с IgE на поверхности клеток: гистамин, триптаза и мембранные липидные медиаторы – лейкотриены, простагландины и фактор активации тромбоцитов. Медиаторы тучных клеток играют ключевую роль в развитии анафилаксии, риноконъюнктивита и крапивницы.
Гистамин, этот важнейший медиатор различных физиологических и патологических процессов в организме, был химически синтезирован в 1907 году. A. Windaus и W. Vogt впоследствии его выделили из тканей животных и человека. Еще позднее были определены его функции: желудочная секреция, нейромедиаторная функция в ЦНС, аллергические реакции, воспаление и др. Спустя почти 20 лет, в 1936 году, D. Bovet, A. Staub были созданы первые вещества, обладающие антигистаминной активностью.
Гистамин участвует в механизме практически всех основных симптомов аллергии. Поэтому первыми противоаллергическими средствами стали антигистаминные препараты (АГП). Первоначально эти препараты не обладали достаточной селективностью. Некоторые из первых представителей этой группы нашли применение не при аллергических, а при других заболеваниях благодаря наличию седативной, антисекреторной активности. Центральные эффекты этих препаратов были главным фактором, ограничивающим их применение при аллергических заболеваниях.
В 60-е годы была доказана гетерогенность рецепторов в организме к гистамину и выделены три их подтипа: Н1, Н2 и Н3, различающиеся по строению, локализации и физиологическим эффектам, возникающим при их активации и блокаде.
В процессе изучения были выделены блокирующие Н1-гистаминовые рецепторы, которые стали носить название антигистаминных, а лекарства, воздействующие на Н2-гистаминовые рецепторы (циметидин, ранитидин, фамотидин и др.), называют Н2-гистаминоблокаторами. Первые используются для лечения аллергических заболеваний, вторые применяются в качестве антисекреторных средств.
Большинство блокирующих Н1-гистаминовые рецепторы веществ оказывали следующие эффекты: противозудный, противоотечный, антиспастический, антихолинергический, антисеротониновый, седативный и местноанестезирующий, а также предупреждение гистамининдуцированного бронхоспазма (3).
Однако, несмотря на высокую терапевтическую эффективность данных препаратов, у них было выявлено множество побочных эффектов, связанных со способностью проникать через гематоэнцефалический барьер, за счет липофильных свойств, электрического заряда, и обладанием антихолинергической активностью. Среди основных побочных эффектов выделяют: центральные, связанные с угнетающим воздействием на ЦНС, проявляющиеся в виде сонливости, снижения психомоторной активности, то есть появления эффекта «седации» и воздействие на холинергическую активность, такие как сухость во рту, нарушение мочеиспускания, зрительные расстройства.
Изучая свойства блокатора Н1-рецепторов вещества гидроксизина, компания UCB Pharma обнаружила, что существенно дольше характерного седативного действия препарата длится его антигистаминное действие, и предположили, что антигистаминным действием обладает не сам гидроксизин, а один из его метаболитов. Длительное время не существовало технологий, позволяющих подтвердить это предположение. Расшифровать структуру вещества, обладающего длительным антигистаминным эффектом, выделить и синтезировать его удалось лишь в 1978 г. Цетиризин стал первым среди антигистаминных препаратов – естественных метаболитов.
Из положительных свойств данной группы, кроме значительной селективности в отношении периферических Н1-рецепторов, отсутствия седативного и кардиотоксического действия, можно выделить и дополнительные противоаллергические эффекты: торможение выделения медиаторов системного аллергического воспаления, включая цитокины и хемокины (триптаза, лейкотриен С4, простагландин D2, интерлейкины 3, 4 и 8, фактор некроза опухоли TNF, гранулоцитарно-макрофагальный колониестимулирующий фактор, RANTES), уменьшение экспрессии молекул адгезии (в том числе Р-селектина и ICAM-1), подавление хемотаксиса и активации эозинофилов и образования супероксидного радикала, снижение гиперреактивности бронхов и выраженности аллерген-индуцированного бронхоспазма (3, 5). Активность метаболитов может быть в 2-4 раза выше по сравнению с исходным соединением (для метаболитов акривастина, эбастина и лоратадина) или такой же (для метаболитов астемизола и кетотифена), а период полувыведения и продолжительность лечебного действия некоторых метаболитов гораздо выше, чем у препарата-предшественника.
Поэтому применение метаболитов более оправдано при проведении долговременной терапии аллергических заболеваний, в генезе которых значительную роль играют медиаторы поздней фазы аллергического воспаления: круглогодичного аллергического ринита, сезонного аллергического ринита или риноконъюнктивита с продолжительностью сезонных обострений более 2 недель, хронической крапивницы, атопического дерматита, аллергического контактного дерматита. Особенности фармакокинетики, хороший профиль безопасности и высокая клиническая эффективность делают их наиболее перспективными антигистаминными средствами в настоящее время. В связи с выявленным свойством цетиризина легко проникать в кожу и накапливаться в ней в высоких концентрациях даже после однократного приема, данный препарат активно применялся у пациентов с аллергическим поражением кожных покровов.
С момента успешного синтеза было известно, что цетиризин – это рацемическая смесь двух изомеров, левоцетиризина и декстроцетиризина. Также было известно, что гистаминовый рецептор I типа – стереоселективная структура и преимущественно связывает только один из изомеров. Лишь в 2001 году удалось применить технологию, позволяющую успешно разделить энантиомеры цетиризина.
При изучении левоцетиризина и декстроцетиризина было доказано, что второй практически не обладает антигистаминным действием.
Левоцетиризин является первым примером выделения активного энантиомера человеческого метаболита как самостоятельного противоаллергического лекарства.
Среди положительных свойств естественных метаболитов у левоцетиризина были доказаны также и хорошие фармакодинамические характеристики: избирательная, стойкая и длительная связь с Н1-рецептором, а также низкая межсубъектная вариабельность, т.е. предсказуемость антигистаминного действия. По параметрам фармакокинетики препарат превосходит практически все другие современные гистаминоблокаторы: в исследованиях показаны быстрая абсорбция, высокая биодоступность – близкая к 100%, минимальный метаболизм, отсутствие взаимодействия с изоферментами системы цитохрома CYP 450, малый объем распределения (6, 10, 11).
При изучении левоцетиризина доказано, что сродство к Н1-рецепторам у него в 2 раза больше, чем у цетиризина. Левоцетиризин оказывает влияние на гистаминозависимую стадию аллергических реакций, а также уменьшает миграцию эозинофилов, уменьшает сосудистую проницаемость, ограничивает высвобождение медиаторов воспаления. Предупреждает развитие и облегчает течение аллергических реакций, обладает противоэкссудативным, противозудным действием, практически не оказывает антихолинергического и антисеротонинового действия. В терапевтических дозах практически не оказывает седативного действия. Действие препарата начинается через 30 мин. (1 час) у 95% больных и сохраняется в течение 24 часов. Левоцетиризин на 90% связывается с белками плазмы. Биодоступность достигает 100%. Период полувыведения составляет 7-10 часов. Полностью выводится из организма за 96 часов.
В связи с тем, что левоцетиризин, как и его предшественник цетиризин, хорошо проникает в кожу, было решено провести клиническое исследование левоцетиризина при атопическом дерматите у детей.
Атопический дерматит является одним из первых аллергических заболеваний, ведущих в последующем к развитию бронхиальной астмы, аллергическому риниту / конъюнктивиту, сочетанных проявлений аллергопатологии («аллергический марш») (4).
В настоящее время атопический дерматит является одной из самых распространенных в структуре аллергических заболеваний (50-60%) форм аллергии, причем эта цифра неуклонно растет (1). Так, до 60-х годов XX века атопический дерматит отмечался у 2-3% от всех детей, посещающих школу, в 1960-1970 гг. эта цифра возросла до 4-8% и после 1980 года составила 9-12% (8). В 1996 году случаи атопического дерматита в Германии, Швеции и Дании (в этой же возрастной группе) были зарегистрированы соответственно в 15,6% и 9% в Италии (9).
В механизмах развития атопического дерматита ключевым звеном патогенеза служит аллергическое воспаление, опосредованное преимущественно Тh2-лимфоцитами, приводящие к появлению определенных цитокинов: IL-4, IL-13, IL-10, IL-5, стимулирующих В-клеточную продукцию IgE антител, а также индуцирующих активность и пролиферацию эозинофилов, увеличивающих экспрессию антигенов гистосовместимости II класса и служащих фактором роста тучных клеток. Особенностью IgE антител является их избирательная способность фиксироваться с помощью высокоаффинного рецептора (FcέRI) с тучными клетками. Согласно последним исследованиям, высокоаффинные рецепторы (FcέRI) присутствуют на поверхности антигенпрезентирующих дендритных клеток кожи больных атопическим дерматитом. Дендритные клетки, экспрессирующие FcέRI рецепторы и IgE антитела, могут усиливать вторичный иммунный ответ, что приводит к повышенному синтезу IgE антител посредством активации большего числа Тh2-лимфоцитов или дендритных клеток из периферической крови в кожу. Этому способствует IL-16 – хемоттрактант для CD4+ лимфоцитов, экспрессируемый в поврежденной коже больных атопическим дерматитом дендритными клетками.
В развитии воспаления кожи у больных атопическим дерматитом важное значение имеют кератиноциты эпидермиса (2), при стимуляции которых повышается продукция хемокина RANTES. Кератиноциты кожи больных атопическим дерматитом являются также важным источником тимического стромального лимфопоэтина, который активирует дендритные клетки к примированию наивных Тh-лимфоцитов и продукции IL-4, IL-13, FNO-α. Кроме того, кератиноциты кожи у больных атопическим дерматитом недостаточно продуцируют антимикробные пептиды, необходимые для защиты против бактерий, грибов и вирусов. Установлено, что именно Тh2-цитокины угнетают экспрессию одного из таких пептидов β-дефензина 2. Эти наблюдения позволяют понять повышенную колонизацию кожи больных атопическим дерматитом золотистым стафилококком, который поддерживает или обостряет кожный процесс при атопическом дерматите за счет секреции экзотоксина. Активированные под влиянием экзотоксина эозинофилы, макрофаги и клетки Лангерганса в свою очередь активируют кератиноциты к продукции IL-1 и FNO-α, которые изменяют функцию рецепторов адгезивных молекул на эндотелиальных клетках и способствуют рециркуляции Т-клеток в кожу. Активированные Т-лимфоциты кожи больных атопическим дерматитом могут запускать апоптоз кератиноцитов через Fas-лиганд, экспрессия которого усиливается под влиянием INF-γ, и кератиноциты становятся чувствительными к апоптозу. Взаимодействие Fas-лиганда с рецептором CD 95 рассматривается главный механизм повреждения кератиноцитов Т-клетками с последующим развитием спонгиоза и акантолиза – характерных проявлений атопического дерматита (2).
Определенное значение в развитии атопического дерматита играют и психосоматические расстройства. Сильный зуд, раздражительность, тревожный поверхностный сон, неадекватность реакций, белый дермографизм – классические проявления психосоматической патологии. При оценке психосоматического статуса у пациентов часто выявляется высокая степень тревожности, развитие реактивных депрессий, астеновегетативный синдром. В последнее время доказано, что основным субстратом в психонейроиммунном взаимодействии являются нейропептиды, (субстанция P, нейрокинин А, нейрокинин В, кальцитонин-геноподобный пептид), обеспечивающие взаимосвязь между нервными волокнами, тучными клетками и сосудами. В следствие аксонрефлекса развивается вазодилатация, проявляющаяся эритемой. Субстанция P обеспечивает высвобождение гистамина из тучных клеток кожи и оказывает прямое воздействие на сосуды, увеличивая их проницаемость.
Для оценки левоцетиризина в комплексной терапии атопического дерматита у детей, эффективность была изучена у 22 детей с атопическим дерматитом, имеющих среднетяжелое и тяжелое течение болезни. Оценка осуществлялась на основе динамики клинических симптомов и шкалы SCORAD.
В задачи исследования входило оценить противоаллергические эффекты, индивидуальную переносимость, наличие побочных эффектов.
Для решения поставленных задач была сформирована группа детей, страдающих атопическим дерматитом, представленная 22 пациентами.
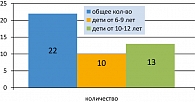
Соотношение по полу в исследуемой группе было одинаковым – 50% девочек и 50% мальчиков. Все пациенты, включенные в группу исследования, были старше 6 лет, средний возраст составил 10,2 ± 3,6 лет. От 6-9 лет было 10 больных, от 10-17 было 12 детей (рисунок 1).
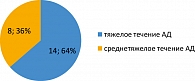
По тяжести течения атопического дерматита: 14 больных наблюдались с тяжелым течением, у 8 пациентов среднетяжелое течение болезни (рисунок 2).
При обследовании у большинства (71,5%) больных была выявлена поливалентная сенсибилизация (чаще бытовая, и/или пищевая, и/или эпидермальная). У 19 пациентов при обследовании была выявлена сочетанная аллергопатология. У 10 детей атопический дерматит сочетался с бронхиальной астмой, у 9 – с аллергическим ринитом легкой или средней степени тяжести, эти заболевания были в периоде ремиссии.
Левоцетиризин назначался в составе комплексной терапии наряду с топическими кортикостероидными препаратами (у части больных комбинированными с антибактериальными и противогрибковыми), длительность приема левоцетиризина составила в среднем 14 дней.
Критериями включения в протокол исследования эффективности левоцетиризина были следующие:
- возраст детей старше 6 лет;
- наличие установленного диагноза (атопический дерматит, согласно разработанных критериев постановки диагноза);
- отсутствие предыдущих курсов антигистаминных препаратов в течение 3 недель;
- на момент назначения левоцетиризина у всех пациентов отмечалось обострение атопического дерматита.
Так, у всех детей с тяжелым течением атопического дерматита (n = 14) отмечались распространенные эритематозно-сквамозные высыпания, лихенификация, трещины, множественные экскориации и геморрагические корочки. Наряду с этим у пациентов с тяжелым течением отмечался зуд различной интенсивности, который проявлялся как в дневное, так и ночное время, нарушая сон больного. Индекс SCORAD был равен 76,5 ± 11,3.
У пациентов со среднетяжелым течением атопического дерматита проявления атопического дерматита носили чаще локализованный характер с преимущественным поражением локтевых, коленных сгибов, реже голеностопных и лучезапястных суставов. При этом высыпания носили эритематозный характер, сопровождались сухостью с мелкопластинчатым шелушением и незначительным усилением кожного рисунка. Индекс SCORAD был равен 44,2 ± 3,4.
Оценка эффективности левоцетиризина осуществлялась врачом на 0, 3, 7 и 14-й дни использования препарата.
Зуд оценивался отдельно по 4-балльной шкале:
- 0 баллов – нет зуда;
- 1 балл – слабый зуд;
- 2 балла – умеренный зуд;
- 3 балла – сильный (тяжелый) зуд.
Исследование эффективности лечения было открытым.
В результате проведенного исследования получены следующие результаты.
На фоне применения левоцетиризина в течении 14 дней в дозе 5 мг (1 таблетка) один раз в сутки отмечалась положительная динамика. Так, индекс SCORAD у детей с тяжелым течением атопического дерматита до лечения составлял 76,5 ± 11,3, а на 7-е сутки терапии 14 ± 6,2 баллов (среднее значение 18,3) (p < 0,01) (рисунок 3).
К 7-м суткам с момента начала лечения удалось достичь перехода дерматита из острой в подострую фазу, которая сопровождалась регрессией кожных высыпаний в виде значительного уменьшения кожных проявлений и зуда кожи, отсутствием свежих высыпания, нормализацией сна.
При анализе динамики индекса SCORAD у детей со среднетяжелым течением атопического дерматита на фоне приема левоцетиризина получены следующие данные: индекс SCORAD до начала лечения составлял 44,2 ± 3,4 балла, на 3 сутки 20,4 ± 2,6 на 7-е сутки – полное отсутствие клинических проявлений основного заболевания.
У детей со среднетяжелым течением атопического дерматита на фоне применения левоцетиризина отмечалась более выраженная положительная динамика кожного процесса в виде исчезновения клинических проявлений болезни и зуда. Результаты оценки изменения зуда представлены в таблице.
До начала лечения практически у всех пациентов отмечен зуд кожных покровов, который был оценен у 14 (63,6%) детей в 2 балла, а у 8 (36,4%) – в 3 балла. Уже через 7 дней применения препарата число пациентов с сильным зудом уменьшилась до 2 (9,1%). К 14-му дню исследования лишь у 8 пациентов сохранялся слабый зуд, это были дети с тяжелым течением атопического дерматита.
Побочные реакции на применение препарата были минимальными: у 1 пациента наблюдалась сухость во рту в первый день приема, у 2 больных – легкая тошнота и метеоризм, однако это не послужило поводом для отмены препарата. Патологических изменений ЭКГ зарегистрировано не было. Применение левоцетиризина привело к исчезновению зуда у большинства обследованных пациентов.
Таким образом, включение левоцетиризина в комплексную терапию атопического дерматита оказывает положительное влияние на динамику клинических симптомов заболевания у наблюдаемых детей, а проведенное нами наблюдение показало, что он является эффективным антигистаминным препаратом и может быть рекомендован в комплексном лечении атопического дерматита, особенно тяжелых его форм.
Однако прогноз течения атопического дерматита, качество жизни больного и его семьи во многом зависят от полученных им достоверных знаний о причинах развития высыпаний на коже, зуда, а также от тщательного выполнения всех рекомендаций врача и профилактики данного заболевания.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.