Новые подходы к лечению метастатического колоректального рака
Ежегодная научно-практическая конференция с международным участием «Мультидисциплинарные подходы в онкологии»: Оптимизация лечения метастатического колоректального рака: междисциплинарный подход и таргетные препараты
- Аннотация
- Статья
- Ссылки

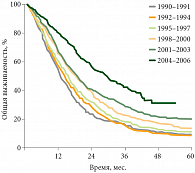



Выступление профессора Иисуса ГАРСИА-ФОНСИЕСА, руководителя онкологического департамента Университета г. Мадрид (Испания), было посвящено комбинированному лечению метастатических поражений печени при колоректальном раке (КРР). Прежде всего докладчик обратил внимание слушателей на очевидные успехи лечения КРР, связанные с применением таргетных препаратов. На сегодняшний день общая выживаемость на протяжении четырех и более лет отмечается у 30% больных КРР (рис. 1).
КРР не является однородным заболеванием, выделяют несколько его биологических подтипов; при этом определяющую роль играет наличие (мутированный тип) или отсутствие (дикий тип) мутаций гена KRAS. Мутация KRAS наблюдается более чем в 40% случаев таких опухолей. Основные препараты для лечения КРР – фторпиримидины, оксалиплатин, иринотекан, а также таргетные анти-EGFR- и анти-VEGF-препараты.
По мере развития лекарственной терапии зафиксировано увеличение общей выживаемости больных метастатическим КРР. Так, медиана общей выживаемости пациентов при монотерапии 5-фторурацилом (5-ФУ) составляла 11–13 мес., при использовании схемы IFL (иринотекан + 5-ФУ + лейковорин) удалось увеличить этот параметр до 15 мес., при применении FOLFOX (оксалиплатин + 5-ФУ + лейковорин) и FOLFIRI (иринотекан + лейковорин + 5-ФУ) – до 20–21 мес. При использовании режима FOLFOXIRI, включающего оксалиплатин, иринотекан, 5-ФУ и лейковорин, медиана общей выживаемости пациентов достигает 22,6 мес. Сегодня, при применении цетуксимаба, подчеркнул докладчик, наилучший показатель составляет 23,5 мес. (режим FOLFIRI + цетуксимаб для пациентов с диким типом KRAS).
Прежде чем остановиться на современных схемах терапии метастатического КРР, профессор И. Гарсиа-Фонсиес обратил внимание слушателей на то, что для успешного лечения этого заболевания в первую очередь следует определить стратегию и интенсивность первой линии терапии с использованием оптимальной комбинации таргетных и химиопрепаратов, и первым шагом должно стать определение цели лечения исходя из того, каких успехов можно достичь у данного пациента. Следующий этап выработки стратегии лечения – исследование биологии опухоли: необходимо понять, является ли она неактивной (медленно прогрессирующей) или агрессивной. Кроме того, необходимо определить KRAS-статус опухоли: дикий тип гена или мутированный.
Еще один важный фактор, определяющий успех лечения, – функциональное состояние пациента. По данному признаку больных можно разделить на три группы. К первой группе относятся пациенты с потенциально резектабельными метастазами, ко второй – больные с нерезектабельными метастазами и большим объемом опухолевого поражения или симптоматикой, связанной с опухолью. Третья группа – пациенты с нерезектабельными метастазами, у которых наблюдается изначально асимптоматичное и менее агрессивное течение заболевания. По словам докладчика, для больных первой и второй групп требуется более интенсивная терапия, тогда как скрытое течение болезни говорит о том, что пациент является кандидатом на менее агрессивное лечение. «Для того чтобы обеспечить высокую частоту ответа на терапию и добиться определенных показателей резектабельности, мы должны строго отбирать больных, – отметил профессор И. Гарсиа-Фонсиес. – Для этого требуется междисциплинарный подход».
Для лечения пациентов первой группы с потенциально резектабельными метастазами КРР в печень определение статуса KRAS очень важно. При терапии с применением цетуксимаба частота ответа на терапию у пациентов с диким типом KRAS намного выше по сравнению с теми, у кого обнаружен мутированный тип KRAS.
Недавно было обнаружено, что не все мутации KRAS являются одинаковыми в отношении исхода лечения, например, мутация G13D более близка к дикому типу по сравнению с другими видами мутаций. В исследовании W. de Roock и соавт.1 была проверена гипотеза о том, что у пациентов с мутацией KRAS G13D результаты терапии цетуксимабом превосходят результаты лечения больных с другими мутациями KRAS. Были изучены результаты лечения 579 больных, резистентных к химиотерапии КРР, получавших цетуксимаб в 2001–2008 гг. в рамках клинических исследований CO.17, BOND, MABEL, EMR202600, EVEREST, BABEL и SALVAGE или вне исследований. Влияние различных мутаций на результаты терапии изучалось in vitro путем создания изогенных клеточных линий с диким типом KRAS, с мутациями G12V или G13D, которые затем подвергались воздействию цетуксимаба.
Основной конечной точкой была общая выживаемость, вторичными конечными точками – частота ответа на терапию и выживаемость без прогрессирования. Было установлено, что медиана общей выживаемости пациентов с мутацией G13D (n = 32) составила 7,6 мес. (95% ДИ 5,7–20,5), что несколько выше, чем медиана общей выживаемости пациентов с другими мутациями (5,7 мес., 95% ДИ 4,9–6,8), отношение рисков (ОР) 0,50 (95% ДИ 0,31–0,81; p = 0,005). Более длительной была у этих пациентов и выживаемость без прогрессирования (медиана 4,0 мес. (95% ДИ 1,9–6,2) против 1,9 мес. (95% ДИ 1,8–2,8)), ОР 0,51 (95% ДИ 0,32–0,81; p = 0,004). Анализ моделей in vitro и мышиной модели показал, что клетки КРР с мутацией G12V были менее чувствительны к цетуксимабу, чем клетки с мутацией G13D и клетки с диким типом KRAS.
Профессор И. Гарсиа-Фонсиес ознакомил собравшихся с результатами сводного анализа данных клинических исследований CRYSTAL (Cetuximab combined with irinotecan in first-line therapy for metastatic colorectal cancer) и OPUS (Oxaliplatin and cetuximab in first-line treatment of mCRC), в ходе которых изучались ответ на лечение цетуксимабом, выживаемость без прогрессирования и общая выживаемость больных с мутацией G13D по сравнению с результатом лечения больных с другими мутациями KRAS или с диким типом KRAS2. В анализ вошли данные по 689 пациентам, сравнивались результаты химиотерапии и химиотерапии в комбинации с цетуксимабом: 447 против 398 пациентов с KRAS дикого типа, 41 против 42 пациентов имели мутацию G13D, 201 против 249 пациентов имели другие мутации KRAS. Было показано, что добавление цетуксимаба в первую линию химиотерапии значительно улучшает результаты лечения для больных метастатическим КРР с диким типом KRAS.
Как показывает исследование OPUS, 85% больных КРР с метастазами в печень нерезектабельны, но применение цетуксимаба в сочетании с химиотерапией делает от 10 до 30% из них потенциально резектабельными3. В рандомизированном исследовании II фазы CELIM (Cetuximab in neoadjuvant treatment of non-resectable colorectal liver metastases) и исследовании POCHER (Preoperative chemotherapy for hepatic resection) пациенты, являвшиеся технически нерезектабельными, получали неоадъювантную терапию цетуксимабом. После лечения цетуксимабом до 60% этих пациентов достигли уровня резектабельности4. Таким образом, частота резекций варьируется от 13,2% в исследовании CRYSTAL до 60% в исследовании POCHER (рис. 2).
Отвечая на вопрос, почему частота резекций печени столь сильно отличается в разных исследованиях, докладчик обратил внимание на то, что в исследованиях СRYSTAL и OPUS решение об операции принималось онкологами, а в исследованиях CELIM и POCHER это решение принималось командой, в которую входили химиотерапевты и хирурги-гепатологи. Частота резекций увеличивалась для всех больных, которые получали цетуксимаб, но если решение о резектабельности принималось междисциплинарной командой, то частота резекций оказывалась выше. Таким образом, подчеркнул профессор И. Гарсиа-Фонсиес, междисциплинарный подход, когда процесс принятия решения об операции происходит при тесном сотрудничестве хирургов и химиотерапевтов, эффективен, и его необходимо широко применять.
Что касается неоадъювантной терапии c применением других моноклональных антител, добавление панитумумаба к режимам терапии FOLFOX и FOLFIRI, по словам профессора И. Гарсиа-Фонсиеса, не приводило к повышению частоты ответа на терапию у пациентов8. Добавление бевацизумаба к режиму FOLFOX/XELOX (Кселода (капецитабин) + оксалиплатин) также не приводило к достоверному увеличению частоты резекций9. В исследовании эффекта добавления бевацизумаба к схеме CAPOX (капецитабин + оксалиплатин) в периоперационном лечении пациентов с метастазами КРР только в печень10 приняли участие 45 больных, 15 из которых были изначально признаны резектабельными, 30 – нерезектабельными. Из 15 потенциально резектабельных пациентов полная резекция (R0) оказалась возможной только у 9 пациентов (20% от общего числа больных). Из 30 изначально нерезектабельных пациентов после получения терапии CAPOX + бевацизумаб 10 больных стали потенциально резектабельными и 7 были прооперированы. Говоря о безопасности лечения, докладчик отметил повышение частоты возможных кровотечений и осложнений в процессе заживления.
Положительную оценку профессора И. Гарсиа-Фонсиеса получило применение цетуксимаба в комбинации с химиотерапией в периоперационном периоде (2 недели до операции / 2 недели после операции), которое приводит к достоверным изменениям объема опухоли. При данной схеме лечения наблюдается достоверный ответ со стороны опухоли в виде уменьшения ее объема, что приводит к повышению частоты резекций R0. Профессор И. Гарсиа-Фонсиес отметил благоприятный профиль безопасности данной терапии.
Лечение пациентов второй группы (больные с нерезектабельными метастазами в печень, большим объемом опухоли и связанными с опухолью клиническими проявлениями) заключается в том, чтобы добиться в первую очередь сокращения размеров опухоли. Применение у таких больных в первой линии терапии цетуксимаба в комбинации с химиотерапией (режимы FOLFOX и FOLFIRI) в течение 8 недель вызывало сокращение объема опухоли и повышало показатели выживаемости без прогрессирования (рис. 3). У пациентов, которые получали только стандартную химиотерапию, без цетуксимаба, таких результатов не обнаружено (рис. 3). Таким образом, применение цетуксимаба у больных с нерезектабельными метастазами КРР в печень открывает перспективу улучшения качества жизни и ее продления. Установлено, что ответ на химиотерапию FOLFIRI в комбинации с цетуксимабом выше, чем на стандартную химиотерапию, а выраженность симптомов заболевания значительно уменьшается12.
Целью лечения пациентов третьей группы, в которую вошли больные с нерезектабельными метастазами и изначально бессимптомным течением заболевания, явилось замедление прогрессирования и уменьшение системного влияния опухоли на организм. Течение заболевания у таких больных было менее агрессивным, объем опухоли относительно меньше, чем у больных второй группы. Основной задачей терапии у этих пациентов было улучшение качества жизни и повышение выживаемости. По данным исследований CRYSTAL и OPUS, применение цетуксимаба в комбинации со стандартной химиотерапией статистически увеличивает общую выживаемость таких больных до 23,5 мес. (табл. 1)13. По словам докладчика, у пациентов с КРР без поражения печени общая выживаемость увеличивается на 3,5–5 и более месяцев по сравнению с показателями у больных с нерезектабельными метастазами в печень.
Заключение
