Глибенкламид в лечении сахарного диабета 2 типа с диабетической нейропатией
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Обследовано 16 больных СД 2 типа и ДН, которым проводилось лечение микронизированными формами глибенкламида (1,75 и 3,5 мг) в суточной дозе 7,0–10,5 мг, препаратами альфа-липоевой кислоты и витаминов группы B.
Изучались вариабельность гликемии методом восьмиточечного СКГ с расчетом SD и CV, динамика HbA1c, ОХС, ХС ЛПНП, ХС ЛПВП, ТГ и ИА. Оценка позитивной и негативной неврологической симптоматики проводилась по TSS, NIS-LL с исследованием температурной чувствительности, ВАШ, опроснику Мак Гилла, по результатам ЭНМГ n. tibialis и n. peroneus с определением амплитуды М-ответа, СРВ и РЛ.
Результаты. У больных СД 2 типа, страдающих ДН, на фоне приема микронизированных форм глибенкламида зафиксировано снижение уровня HbA1c, глюкозы перед ужином, вариабельности гликемии и ИА. Через 12 недель терапии по NIS-LL отмечены улучшение вибрационной чувствительности и снижение общей оценки неврологических изменений, тенденция к повышению тактильной чувствительности, по TSS – уменьшение онемения в голенях и стопах, общей оценки симптомов ДН, тенденция к уменьшению жжения, по опроснику Мак Гилла – снижение суммарной оценки боли, по сенсорной и эвалюативной шкалам – тенденция к уменьшению РИБ, по ВАШ – улучшение состояния. При ЭНМГ выявлено увеличение амплитуды М-ответа n. peroneus (левый), тенденция к уменьшению РЛ n. tibialis (левый) и увеличению СРВ n. tibialis (правый).
При корреляционном анализе установлена прямая связь между показателями HbA1c и CV, общей оценкой по NIS-LL, обратная связь HbA1c с СРВ, а также CV с показателями амплитуды М-ответа, SD с суммарной оценкой выраженности боли по опроснику Мак Гилла.
Заключение. Применение микронизированных форм глибенкламида способствует снижению вариабельности гликемии и компенсации углеводного обмена, а также улучшению показателей неврологического статуса пациентов с ДН.
Материал и методы. Обследовано 16 больных СД 2 типа и ДН, которым проводилось лечение микронизированными формами глибенкламида (1,75 и 3,5 мг) в суточной дозе 7,0–10,5 мг, препаратами альфа-липоевой кислоты и витаминов группы B.
Изучались вариабельность гликемии методом восьмиточечного СКГ с расчетом SD и CV, динамика HbA1c, ОХС, ХС ЛПНП, ХС ЛПВП, ТГ и ИА. Оценка позитивной и негативной неврологической симптоматики проводилась по TSS, NIS-LL с исследованием температурной чувствительности, ВАШ, опроснику Мак Гилла, по результатам ЭНМГ n. tibialis и n. peroneus с определением амплитуды М-ответа, СРВ и РЛ.
Результаты. У больных СД 2 типа, страдающих ДН, на фоне приема микронизированных форм глибенкламида зафиксировано снижение уровня HbA1c, глюкозы перед ужином, вариабельности гликемии и ИА. Через 12 недель терапии по NIS-LL отмечены улучшение вибрационной чувствительности и снижение общей оценки неврологических изменений, тенденция к повышению тактильной чувствительности, по TSS – уменьшение онемения в голенях и стопах, общей оценки симптомов ДН, тенденция к уменьшению жжения, по опроснику Мак Гилла – снижение суммарной оценки боли, по сенсорной и эвалюативной шкалам – тенденция к уменьшению РИБ, по ВАШ – улучшение состояния. При ЭНМГ выявлено увеличение амплитуды М-ответа n. peroneus (левый), тенденция к уменьшению РЛ n. tibialis (левый) и увеличению СРВ n. tibialis (правый).
При корреляционном анализе установлена прямая связь между показателями HbA1c и CV, общей оценкой по NIS-LL, обратная связь HbA1c с СРВ, а также CV с показателями амплитуды М-ответа, SD с суммарной оценкой выраженности боли по опроснику Мак Гилла.
Заключение. Применение микронизированных форм глибенкламида способствует снижению вариабельности гликемии и компенсации углеводного обмена, а также улучшению показателей неврологического статуса пациентов с ДН.
Сахарный диабет (СД) 2 типа – хроническое прогрессирующее заболевание. По прогнозам экспертов Международной федерации диабета (International Diabetes Federation – IDF), к 2040 г. в мире количество больных может увеличиться до 642 млн. В России в 2015 г. по показателю «обращаемость в лечебные учреждения» таких пациентов было 4,1 млн, при этом с СД 2 типа – 3,7 млн. Однако фактическое число больных, по результатам эпидемиологических исследований Эндокринологического научного центра, достигает 9–10 млн – 7% населения [1, 2].
Ведущее место в структуре осложнений СД занимает диабетическая дистальная нейропатия, субклиническая и клиническая формы поражения периферических нервов. Она является предиктором развития синдрома диабетической стопы, прогрессирование которого нередко приводит к нетравматической ампутации. Согласно данным исследования UKPDS, при выявлении СД 2 типа у 14–20% пациентов уже отмечается диабетическая нейропатия (ДН), ее распространенность увеличивается с увеличением длительности и тяжести заболевания [3].
Основными метаболическими факторами развития диабетической дистальной сенсомоторной нейропатии считаются гипергликемия и вариабельность гликемии, окислительный стресс, неферментативное гликозилирование белков, а также системное воспаление с повышением уровня С-реактивного белка и провоспалительных цитокинов. Вследствие этого нарушаются внутриклеточная осморегуляция, эндоневральный кровоток, проводимость по нервным волокнам и цитотоксический эффект конечных продуктов гликозилирования (КПГ). Последние, взаимодействуя с атерогенными фракциями липидного спектра, влияют на липидный обмен и активируют процессы перекисного окисления липидов [4, 5].
Наиболее часто при СД 2 типа наблюдается симметричная дистальная нейропатия – 80% случаев. Распространенность болевой формы ДН варьирует от 8 до 26% в зависимости от критериев оценки болевого синдрома [5]. Хроническая боль обусловливает снижение качества жизни пациентов [6]. Ремиссия боли ассоциируется с небольшой ее длительностью, предшествующим снижением массы тела и менее тяжелыми формами потери чувствительности.
Компенсация СД способствует снижению риска развития и прогрессирования его осложнений.
В настоящее время подходы к лечению СД значительно изменились. Так, согласно консенсусу Российской ассоциации эндокринологов, приоритетным считается достижение индивидуального гликемического контроля – в зависимости от возраста, ожидаемой продолжительности жизни, наличия сердечно-сосудистых осложнений и риска гипогликемии [1].
Более трех десятилетий при СД используются производные сульфонилмочевины. Среди препаратов данного класса золотым стандартом пероральной сахароснижающей терапии СД 2 типа признан глибенкламид как в виде монотерапии, так и комбинированной. Глибенкламид способствует закрытию аденозинтрифосфат-зависимых К+-каналов, повышению содержания внутриклеточного Са2+ и секреции инсулина бета-клетками. Это приводит к восстановлению первой фазы секреции инсулина и снижению постпрандиальной гликемии [7].
Особенностью лекарственных форм глибенкламида считается постепенное нарастание сахароснижающего эффекта, что достигается благодаря медленной абсорбции и низкой биодоступности. Однако в постабсорбционном периоде повышается риск развития гипогликемии, особенно при приеме больших доз [8]. Микронизированная форма глибенкламида позволяет повысить биодоступность и длительно поддерживать терапевтическую концентрацию вещества в крови при приеме более низких доз. Так, биодоступность обычного глибенкламида в дозе 5 мг составляет 29–69%, его микронизированной формы – приблизительно 100% [9].
Микронизированная форма глибенкламида по 1,75 и 3,5 мг хорошо известна с 1985 г. Пик ее сахароснижающего действия практически совпадает с фазой постабсорбционной гипергликемии, что способствует снижению риска развития гипогликемических состояний между приемами пищи [10].
На данный момент вопрос о плейотропных эффектах микронизированной формы глибенкламида изучен недостаточно. В этой связи представляется актуальным исследовать роль такой терапии в профилактике прогрессирования ДН.
Цель исследования
Целью настоящего исследования стало изучение влияния микронизированных форм глибенкламида на вариабельность гликемии и неврологические изменения у пациентов с СД 2 типа и ДН.
Материал и методы
В эндокринологическом отделении Рязанской областной клинической больницы проведено открытое сравнительное исследование с участием 16 пациентов (7 мужчин и 9 женщин). Длительность СД 2 типа – 9,2 ± 3,6 года, ДН – 7,4 ± 3,1 года, средний возраст больных – 56,4 ± 4,2 года, индекс массы тела – 27,9 ± 3,6 кг/м2. В 37,5% случаев диагностирована диабетическая ретинопатия, 43,8% – диабетическая нефропатия, 81,3% – артериальная гипертензия.
Сахароснижающая терапия проводилась согласно принципам стратификации с применением микронизированных форм глибенкламида в дозах 1,75 и 3,5 мг, суточная доза – 7,0–10,5 мг.
В качестве дополнительной патогенетической терапии назначались препараты альфа-липоевой кислоты (Октолипен, Тиоктацид, Тиогамма, Берлитион) по 600 мг/сут в/в капельно и витаминов группы B (Комбилипен, Мильгамма) по 2 мл/сут в/м в течение двух недель, далее – пероральные препараты альфа-липоевой кислоты по 600 мг/сут и жирорастворимых форм тиаминсодержащих витаминов (Комбилипен табс, Мильгамма композитум, Бенфогамма) в течение 12 недель.
Изучалась динамика параметров углеводного обмена: гликированный гемоглобин (HbA1c) и вариабельность гликемии. Первый показатель определялся с помощью автоматического анализатора NycoCard Reader II. Второй – оценивался по восьми точкам самоконтроля гликемии (СКГ) с расчетом стандартного отклонения (standard deviation – SD) и коэффициента вариабельности (coefficient of variation – CV).
Показатели липидного обмена: общий холестерин (ОХС), холестерин липопротеинов высокой плотности (ХС ЛПВП), триглицериды (ТГ) с расчетом холестерина липопротеинов низкой плотности (ХС ЛПНП) и индекса атерогенности (ИА) – определяли ферментативным методом с использованием биохимического анализатора Olimpus 400 (Япония) в биохимической лаборатории Рязанской областной клинической больницы.
Исследование неврологического статуса проводилось в кабинете диабетической стопы. Для оценки позитивной неврологической симптоматики применяли TSS (Total Symptom Score), вибрационной, тактильной, болевой чувствительности, сухожильных рефлексов, мышечной силы в нижних конечностях – NIS-LL (Neuropathy Impairment Score – Lower Limb), температурной – комплексное устройство Twin-Tip (Германия). Для определения выраженности болевого синдрома и его интенсивности использовали опросник Мак Гилла c расчетом индекса числа выбранных дескрипторов (ИЧВД) и рангового индекса боли (РИБ) и десятибалльную Визуальную аналоговую шкалу (ВАШ). Проводилась также стимуляционная электронейромиография (ЭНМГ) nervus tibialis и nervus peroneus с помощью анализатора «Синапсис» (Россия) с определением амплитуды М-ответа, скорости распространения возбуждения (СРВ) и резидуальной латентности (РЛ).
Все пациенты обследовались дважды: исходно и через 12 недель.
Для статистической обработки данных использована программа Statistica 10. Данные представлены в виде M ± m. Для установления связи между показателями использовали t-критерий Стьюдента. Нормальность распределения значений проверялась с помощью критерия Колмогорова – Смирнова. Связь между различными показателями устанавливали с помощью корреляции Спирмена. Статистически значимыми считали различия при р < 0,05.
Все больные подписали информированное согласие на участие в исследовании, форма утверждена этическим комитетом Рязанского государственного медицинского университета им. академика И.П. Павлова (протокол № 5 от 07.12.2012).
Результаты
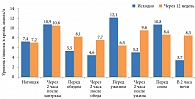
Через 12 недель терапии у больных СД 2 типа и ДН отмечено снижение HbA1c с 8,6 ± 0,4 до 7,4 ± 0,3% (p < 0,05), а также гликемии перед ужином (рис. 1). При оценке вариабельности гликемии выявлено уменьшение SD с 3,6 ± 0,4 до 2,3 ± 0,3 ммоль/л (p < 0,01) и CV с 25,7 ± 1,8 до 19,1 ± 2,5% (p < 0,05). Достижение индивидуальных целевых значений гликемии – HbA1c < 7,0% зафиксировано в 57% случаев.
Исходно у пациентов была диагностирована дислипидемия с повышением атерогенных фракций липидного спектра. Через 12 недель ИА снизился с 4,1 ± 0,3 до 3,3 ± 0,2 (p < 0,05).
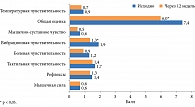
При анализе неврологического статуса по NIS-LL у больных СД 2 типа через 12 недель наблюдалось улучшение вибрационной чувствительности и снижение общей оценки неврологических изменений (рис. 2). Кроме того, выявлена тенденция к повышению тактильной чувствительности.
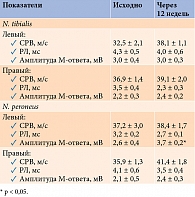
Исходно при ЭНМГ-обследовании n. tibialis и n. peroneus зарегистрировано снижение СРВ, амплитуды М-ответа и увеличение РЛ. Через 12 недель наблюдалось увеличение амплитуды М-ответа n. peroneus (левый), тенденция к уменьшению РЛ n. tibialis (левый) и увеличению СРВ n. tibialis (правый) (табл. 1).
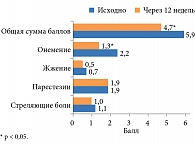
На клинической стадии ДН через 12 недель по TSS уменьшилось онемение в голенях и стопах и общая оценка симптомов, наметилась тенденция к снижению жжения (рис. 3).
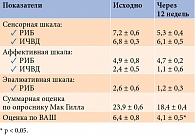
Анализ ответов пациентов по опроснику Мак Гилла в конце наблюдения показал снижение суммарной оценки боли. Отмечена также тенденция к уменьшению РИБ сенсорной шкалы, РИБ эвалюативной шкалы (табл. 2). Выявлено улучшение по ВАШ.
При проведении корреляционного анализа у больных СД 2 типа и ДН обнаружена прямая связь между показателями HbA1c и коэффициентом вариабельности гликемии (r = 0,32, p = 0,016), общей оценкой симптомов по NIS-LL (r = 0,57, p = 0,039), обратная связь между уровнем HbA1c и СРВ (r = -0,41, p = 0,02), CV и показателями амплитуды М-ответа (r = -0,36, p = 0,015), SD гликемии и суммарной оценкой по опроснику Мак Гилла (r = 0,41, p = 0,037).
Вывод
Полученные результаты позволяют сделать следующие выводы.
- У больных СД 2 типа и ДН терапия микронизированными формами глибенкламида через 12 недель привела к улучшению параметров углеводного обмена и снижению CV, SD. Индивидуального целевого уровня гликемии – HbA1c < 7,0% достигли 57% пациентов, при этом зафиксировано снижение ИА.
- Выявлено улучшение показателей неврологического статуса: снижение суммы баллов, повышение вибрационной чувствительности по NIS-LL, уменьшение онемения и суммарной оценки по TSS, суммарной оценки боли по опроснику Мак Гилла, увеличение амплитуды М-ответа n. peroneus (левый).
- Проведенное исследование подтверждает обоснованность и эффективность применения микронизированных форм глибенкламида у больных СД 2 типа и дистальной диабетической нейропатией.
Информация о финансировании и конфликте интересов
Авторы декларируют отсутствие потенциальных и иных конфликтов интересов, связанных с публикацией настоящей статьи.
Исследование и публикация работы проведены без внешнего финансирования
I.I. Dubinina1, S.V. Berstneva1, M.N. Kuzin2, V.V. Baranov1
1 I.P. Pavlov Ryazan State Medical University
2 Regional Clinical Hospital, City of Ryazan
Contact person: Inessa Ivanovna Dubinina, inessa.dubinina@mail.ru
Objective: to examine impact of micronized glibenclamide on variability of glycemia and neurological changes in patients with type 2 diabetes mellitus (DM) and diabetic neuropathy (DN).
Material and Methods. There were examined 16 patients with type 2 DM and diabetic neuropathy (DN) treated with micronized glibenclamide (dosage: 1.75 and 3.5 mg), at daily dose 7.0–10.5 mg, alpha-lipoic acid and group B vitamins.
Glycemic variability was examined by self-monitoring blood glucose at eight time points and calculating SD and CV, dynamic HbA1c, total cholesterol, LDL-Cholesterol, HDL-Cholesterol, triglycerides and Atherogenic Index (AI). Positive and negative neurological symptoms were assessed by using TSS, NIS-LL with checking thermal sense, visual analog scale (VAS), McGiIl Pain Questionnaire, ENMG in n. tibialis and n. peroneus with measuring M-response amplitude, nerve conduction velocity (NCV), residual latency (RL).
Results. Patients with type 2 DM suffering from DN treated with micronized glibenclamide were found to have lowered HbA1c, glucose level before dinner, glycemic variability and AI. After performing a 12-week therapy it was demonstrated that vibration sensation was improved according to the NIS-LL and ameliorated general neurological symptoms, touch sensitivity tended to elevate, according to TSS – decreased numbness in lower leg and feet, general symptoms of DN, burning sensation tended to decrease, McGiIl Pain Questionnaire revealed reduced overall pain scores, sensation and evaluation scales found that rank pain index tended to decline, and VAS was improved. ENMG revealed increased M-response amplitude in n. peroneus (left side), RL in n. tibialis (left side) tended to decrease and NCV in n. tibialis (right side) increased.
A correlation analysis found a direct relationship between magnitude of HbA1c and CV, overall estimate according to the NIS-LL, inverse relationship between HbA1c and NCV as well as CV and M-response amplitude, SD and overall pain scores assessed by McGiIl Pain Questionnaire.
Conclusions. Use of micronized glibenclamide contributes to lowered glycemic variability and compensated carbohydrate metabolism as well as improved parameters of neurological status of patients with DN.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.