Глюкофаж Лонг – эффективный и безопасный сахароснижающий препарат для длительного применения
- Аннотация
- Статья
- Ссылки
- English


Сахарный диабет типа 2 (СД 2) – опасное, прогрессирующее и очень распространенное заболевание. По оценке Международной федерации диабета, в 2014 г. число больных в мире достигло 387 млн, при этом доля СД 2 составила 90% случаев [1]. Ведущими причинами данной неблагоприятной тенденции являются избыточная масса тела/ожирение, гиподинамия и старение населения.
СД 2 считается многофакторным заболеванием, ассоциированным с различными сопутствующими метаболическими нарушениями. Он ухудшает не только сердечно-сосудистый, но общий прогноз [2–5]. Основная причина смерти пациентов с СД 2 – сердечно-сосудистые заболевания (ССЗ).
По данным Всемирной организации здравоохранения, заболевание в два-три раза увеличивает общую смертность [6].
Хронические осложнения СД 2 остаются главной проблемой для большинства пациентов. Гипергликемия является основным фактором риска микрососудистых осложнений [7]. Макрососудистые осложнения, как правило, обусловлены и другими весомыми факторами: висцеральным ожирением, инсулинорезистентностью (ИР), артериальной гипертензией, дислипидемией. В сочетании с гипергликемией они значительно ухудшают сердечно-сосудистый прогноз и требуют своевременного вмешательства [7–10]. Повышает риск развития патологии сердца и сосудов гипогликемия, способствующая активации контринсулярной защиты [11–13]. Известно, что гипогликемия является независимым фактором риска сердечно-сосудистых событий. Именно поэтому при выборе сахароснижающего препарата следует учитывать факторы, повышающие риск ее развития: возраст, патологию почек и печени [14–16].
Препятствовать эффективному лечению СД может и избыточная масса тела больных, которая нередко увеличивается на фоне проводимой терапии, особенно при приеме препаратов сульфонилмочевины (ПСМ) [1, 8, 11].
Успехи, достигнутые в последние годы в области диабетологии, в значительной мере обусловлены внедрением в клиническую практику современных алгоритмов ведения пациентов с СД. При выборе терапевтического средства учитывается не только его эффективность, но и безопасность [1, 15, 17].
Согласно российскому алгоритму специализированной медицинской помощи больным СД 2 старт и интенсификация сахароснижающей терапии осуществляются в зависимости от исходного уровня гликированного гемоглобина (HbA1c). Уровень HbA1c рекомендуется поддерживать в пределах выбранных индивидуальных значений – в зависимости от возраста, ожидаемой продолжительности жизни, осложнений и риска развития тяжелой гипогликемии. Изменять фармакотерапию при недостаточной эффективности на каждом этапе необходимо не позднее, чем через шесть месяцев от начала лечения [1].
В качестве препарата первой линии рекомендуется метформин, учитывая его эффективность в отношении снижения уровня гликемии, отсутствие влияния на массу тела, низкий риск развития гипогликемии, хорошую переносимость и относительно низкую стоимость [1, 4, 17].
На сегодняшний день метформин остается наиболее изученным препаратом монотерапии [18–21]. Метформин одинаково эффективен и безопасен как у молодых, так и пожилых пациентов [13, 18, 20].
Кроме того, выбор инсулинорезистентности (ИР) – фундаментального патофизиологического механизма развития СД 2 в качестве терапевтической мишени позволил улучшить чувствительность органов и тканей к инсулину. Результаты проведенных исследований продемонстрировали значимую роль ИР в развитии и прогрессировании ССЗ, а также в повышении риска острых макрососудистых осложнений [3, 4, 22] и неблагоприятных прогнозов [18, 23]. Степень ИР является независимым предиктором прогрессирования заболеваний почек [24].
Метформин обладает выраженным ингибирующим действием в отношении ИР. Необходимо отметить, что устранение глюкозотоксичности вследствие эффективного снижения уровня глюкозы также улучшает тканевую чувствительность к инсулину [1, 25, 26].
Еще в исследовании UKPDS была отмечена способность метформина предотвращать развитие макрососудистых осложнений. Лечение метформином по сравнению с ПСМ и инсулином в большей степени улучшало прогноз больных: снизился на 36% риск смерти по любой причине, смерти от СД или инфаркта [21], что было подтверждено в последующих исследованиях [18, 19].
Эффекты метформина
Антигипергликемический эффект метформина – результат его воздействия на чувствительность к инсулину главным образом на уровне печени, а также мышечной и жировой тканей [25–27]. Метформин снижает продукцию глюкозы в основном за счет подавления глюконеогенеза: уменьшается экспрессия гена, индуцирующего этот процесс путем фосфорилирования циклического аденозинмонофосфата (цАМФ) – ко-активатора CREB-протеина [27, 28]. Кроме того, снижается поступление субстратов глюконеогенеза в гепатоциты и ингибирование таких ферментов, как пируваткарбоксилаза, фруктозо-1,6-бифосфатаза и глюкозо-6-фосфатаза.
Известно, что избыточная продукция глюкозы печенью в ночные часы у больных СД 2 особенно неблагоприятна ввиду стимуляции процессов атерогенеза и развития резистентности к сахароснижающим препаратам. Так, при повышении концентрации глюкозы крови натощак (ГКН) > 6,1 ммоль/л риск развития сердечно-сосудистых событий в последующие 12,4 года возрастает в 1,33 раза [29]. Прием метформина способствует снижению уровня ГКН на 25–30% (в среднем на 3,3–3,9 ммоль/л) [25, 26].
Под влиянием метформина чувствительность тканей к инсулину возрастает на 18–50%, в результате повышается утилизация глюкозы печенью, мышечной и жировой тканями. В этих тканях метформин способствует связыванию инсулина с рецепторами. Наблюдается также повышение их количества и аффинности, активация пострецепторных механизмов действия инсулина, в частности тирозинкиназы и фосфотирозин фосфатазы [25, 26].
Лечение метформином изменяет и липидный профиль: снижается концентрация триглицеридов на 10–20%, холестерина липопротеинов низкой плотности (ЛПНП) на 10%, при этом повышается концентрация холестерина липопротеинов высокой плотности (ЛПВП) на 10–20% [20, 25]. Метформин способствует снижению уровня и скорости окисления свободных жирных кислот (на 10–17 и 10–30% соответственно) и активации их реэстерификации. В результате устраняются эффекты липотоксичности на всех уровнях, включая печень, жировую и мышечную ткани и островки Лангерганса [26].
Интестинальный эффект метформина заключается в замедлении скорости всасывания углеводов. При этом препарат повышает утилизацию глюкозы в желудочно-кишечном тракте (ЖКТ), усиливая анаэробный гликолиз как в состоянии насыщения, так и натощак. В результате постпрандиальная гликемия снижается в среднем на 20–45% [20, 25]. Таким образом, метформин вносит существенный вклад в предотвращение постпрандиальных пиков гликемии, ассоциированных с риском преждевременной смерти от ССЗ [20].
Предотвращение гипогликемии, учитывая ее опасные последствия, у больных СД 2, имеющих ССЗ, является крайне важным [4, 6, 10]. Благодаря указанным эффектам метформина происходит снижение уровня глюкозы без риска гипогликемических состояний, что является несомненным достоинством препарата [20]. Применение метформина приводит к снижению уровня HbA1c на 1,5–2,0% [1, 25].
Важно отметить, что, не оказывая прямых эффектов на бета-клетки поджелудочной железы, метформин улучшает секрецию инсулина, способствуя сохранению их функциональной активности. На фоне уменьшения ИР снижается базальный уровень инсулина в сыворотке крови [20, 25]. В связи с этим интересны результаты ретроспективного исследования [17], в котором анализировалась сахароснижающая терапия на этапе инициации и интенсификации. Количество участников – 15 516. Период наблюдения – с 2009 по 2013 г. Пациентов в зависимости от получаемого лечения разделили на группы: метформин, ПСМ, тиазолидиндионы, ингибиторы дипептидилпептидазы 4 (ДПП-4). Цель исследования – определить начало интенсификации терапии (добавление другого сахароснижающего средства, включая инсулин) у пациентов с СД 2, получавших пероральные сахароснижающие препараты (ПСП) впервые.
Только 57,8% пациентов начали терапию с метформина. С помощью регрессионного анализа Кокса установлено, что старт терапии с метформина (по сравнению с другими ПСП) ассоциировался с меньшей необходимостью интенсификации терапии в будущем (р < 0,01) (табл. 1). В частности, доля пациентов, которым потребовалось назначение второго сахароснижающего средства, в группе метформина составила 24,5%, ингибиторов ДПП-4 – 36,2%, ПСМ – 37,1%, тиазолидиндионов – 39,6%.
Учитывая, что подавляющее большинство больных СД 2 имеют избыточную массу тела, первоочередной задачей лечения является ее снижение и поддержание в норме [1, 9]. На фоне терапии метформином у пациентов наблюдается уменьшение массы тела либо отсутствие ее увеличения. Кроме того, лечение сопровождается снижением отложения висцерального жира, что является независимым фактором риска развития ССЗ [20, 25]. Последние исследования свидетельствуют: метформин подавляет выработку орексигенного пептида грелина, повышает уровень глюкагоноподобного пептида 1, обладающего анорексигенным действием. Это отчасти объясняет некоторые метаболические эффекты препарата [20, 30].
В последние годы активно обсуждаются кардиопротективные эффекты метформина [31]. Через подавление повышенной адгезии моноцитов к эндотелию сосудов, липоидоза метформин влияет на механизмы развития атеросклероза [32, 33]. Препарат ускоряет катаболизм ЛПНП, способствуя их конверсии в ЛПВП, снижает аккумуляцию эфиров холестерина в аорте, увеличивает содержание фосфолипидов и уменьшает содержание сфингомиелина. Наряду с этим метформин уменьшает пролиферацию гладкомышечных клеток сосудов, подавляет процессы дифференциации моноцитов в макрофаги, активно секретирующие проатерогенные факторы. В условиях in vitro метформин ингибировал лейкоцит-эндотелиальное взаимодействие, а также экспрессию на поверхность эндотелия внутриклеточной молекулы адгезии 1, сосудисто-клеточной молекулы адгезии 1 и Е-селектина [25, 26]. Показано, что препарат оказывает положительное воздействие на систему гемостаза, реологию крови, функцию эндотелия и сосудистую реактивность [34, 35].
Результаты ряда работ позволили раскрыть и другие механизмы, лежащие в основе кардиопротективного действия препарата. Так, в исследованиях K. Isoda и соавт. продемонстрировано, что метформин дозозависимо ингибирует высвобождение интерлейкинов (ИЛ) 6 и 8, индуцированное ИЛ-1-бета, в гладкомышечных клетках сосудов, макрофагах и эндотелиоцитах [36]. Авторы предполагают, что в основе этих процессов лежит снижение транслокации NF-kB.
Поскольку клиническое значение этих свойств метформина не окончательно подтверждено, их дальнейшее изучение представляет интерес.
Применение метформина при ХБП
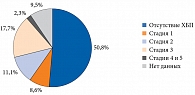
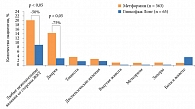
Диабетическая нефропатия – одно из наиболее серьезных и инвалидизирующих осложнений СД 2. Риск развития хронической болезни почек (ХБП) при СД повышается в 2,6 раза [37, 38]. Заболевание выявляется примерно у трети пациентов (рис. 1).
Диабетическая нефропатия среди причин смерти стоит на втором месте после ССЗ. Она является основной причиной развития терминальной стадии ХБП. По потребности в гемодиализе и трансплантации почек больные СД по-прежнему удерживают лидерство [14, 16, 39].
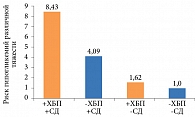
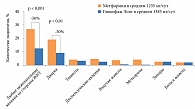
Нарушение функции почек накладывает ограничение на выбор сахароснижающего средства [1, 16, 39] из-за повышенного риска развития гипогликемии (рис. 2) вследствие сниженного клиренса креатинина, а также нарушения ренального глюконеогенеза [2, 16, 39].
Понятие ХБП было введено для унификации подходов к диагностике, лечению и профилактике поражений почек. Оно объединяет различные повреждения почек и/или снижение их функции, сохраняющиеся в течение трех месяцев и более, вне зависимости от первичного диагноза [1, 2]. Для постановки диагноза ХБП в случае сохранной или повышенной скорости клубочковой фильтрации (СКФ), а также ее незначительного снижения (60 ≤ СКФ < 90 мл/мин/1,73 м²) необходимо наличие признаков повреждения почек:
-
альбуминурия ≥ 30 мг/сут или соотношение альбумин/креатинин (ал/кр) в моче ≥ 30 мг/г (≥ 3 мг/моль);
-
изменение осадка мочи;
-
электролитные нарушения;
-
структурные и морфологические изменения;
-
трансплантация почки в анамнезе.
При СКФ < 60 мл/мин/1,73 м² диагноз ХБП ставится даже в отсутствие маркеров повреждения почек.
Оценка нарушения функции почек необходима не только для первичной диагностики патологии почек, но и контроля эффективности и безопасности терапии, скорости прогрессирования патологического процесса и определения прогноза. Стадия нарушения функции почек определяется по величине СКФ, как наиболее полно отражающей количество и суммарный объем работы нефронов (табл. 2), с учетом уровня альбуминурии (табл. 3).
Основанием для введения классификации ХБП по уровню альбуминурии послужили данные о том, что риск общей и сердечно-сосудистой смерти и прогрессирования ХБП в любом диапазоне СКФ зависит от скорости экскреции альбумина (СЭА) с мочой [31].
Безусловно, неблагоприятные последствия ХБП могут быть предупреждены или отсрочены в случае ранней диагностики и лечения [14, 16, 40].
В настоящее время активно обсуждается возможность применения метформина при ХБП [40, 41]. Необходимо отметить, что метформин не метаболизируется в организме и экскретируется преимущественно почками.
При СКФ < 60 мл/мин/1,73 м² экскреция препарата снижается [26, 39, 42]. Из-за этого повышается риск развития лактатацидоза. Частота встречаемости – 6 случаев на 100 тыс. пациенто-лет. Однако установлено, что ожидаемый риск развития лактатацидоза при использовании метформина составляет 3–8,1 случая на 100 тыс. пациенто-лет [41–43]. При этом он развивается у больных СД с выраженной почечной недостаточностью [39, 41].
Для предотвращения лактатацидоза до назначения препарата необходимо тщательно обследовать больных с целью выявления противопоказаний к его применению. К противопоказаниям относятся:
-
заболевания, сопровождающиеся тканевой гипоксией (сердечная или легочная недостаточность, инфаркт миокарда, анемия и др.);
-
почечная недостаточность или нарушение функции почек (клиренс креатинина < 45 мл/мин/1,73 м²);
-
печеночная недостаточность, алкоголизм;
-
беременность, лактация;
-
острые состояния, которые могут нарушить функцию почек (обезвоживание, острая инфекция, шок, внутрисосудистое введение рентгеноконтрастных средств);
-
диабетический кетоацидоз.
Ретроспективная оценка использования метформина у пациентов Чикагского университета за 2004–2009 гг. и пациентов, участвовавших в исследовании NHANES, за 1999–2006 гг. продемонстрировала, что применение метформина достаточно распространено при СКФ < 60 мл/мин/1,73 м² [39]. Значительное снижение клиренса метформина происходит при СКФ менее 30 мл/мин/1,73 м² – абсолютное противопоказание для назначения препарата. При СКФ от 30 до 60 мл/мин/1,73 м² экскреция метформина снижается на 45–60%, что требует уменьшения дозы препарата и мониторинга функции почек каждые три – шесть месяцев. В случае дальнейшего снижения СКФ препарат отменяют.
Применение метформина при СКФ 45–50 мл/мин/1,73 м² безопасно в отсутствие других факторов риска развития лактатацидоза: плохо контролируемый СД, кетоацидоз, длительное голодание, чрезмерное потребление алкоголя, печеночная недостаточность и состояния, связанные с выраженной гипоксией [1, 42].
Применение метформина при НЖБП
У больных СД 2 часто наблюдаются заболевания ЖКТ, среди которых лидирует неалкогольная жировая болезнь печени (НЖБП). Понятие НЖБП объединяет клинико-морфологические изменения печени – от жирового гепатоза, неалкогольного стеатогепатита до фиброза с возможным исходом в виде цирроза, развивающиеся вследствие воздействия различных факторов у пациентов, не употребляющих алкоголь в гепатотоксичных дозах [44, 45]. Поскольку развитие НЖБП связано с ИР, первая диагностируется у 50–78% пациентов с СД 2. НЖБП в свою очередь способствует развитию ССЗ [44, 45]. Следовательно, применение метформина при сочетании СД 2 и НЖБП патогенетически оправданно.
Как уже отмечалось, основной механизм действия метформина реализуется посредством активации цАМФ-зависимой протеинкиназы печени, что сопровождается снижением синтеза триглицеридов из жирных кислот и подавлением митохондриального бета-окисления, снижением экспрессии туморонекротического факторa альфа и транскрипционных факторов, ответственных за синтез холестерина из ацетил-коэнзима А [20, 25, 28].
Результаты ретроспективного исследования (2000–2010 гг.), включавшего больных СД 2 с циррозом печени (n = 250), показали, что у пациентов, получавших метформин (n = 172) на момент постановки диагноза «цирроз», по сравнению с пациентами (n = 78), которым метформин на этом этапе был отменен, статистически значимо увеличилась пятилетняя выживаемость (11,8 против 5,6 года, р < 0,0001). При этом применение метформина (после поправки на возраст, индекс массы тела, длительность заболевания) стало независимым предиктором лучшей выживаемости (относительный риск 0,43 (95% ДИ 0,24–0,78), р = 0,005). Прием метформина способствовал снижению риска смерти на 57% [46].
Глюкофаж Лонг
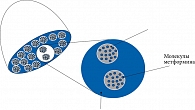
Установлено, что 5–10% пациентов с СД прекращают принимать метформин в связи с негативными явлениями со стороны ЖКТ [20, 47]. Повысить эффективность терапии, сократить частоту побочных реакций и, как следствие, увеличить приверженность пациентов лечению позволяет метформин замедленного высвобождения – препарат Глюкофаж Лонг [47, 48]. Данная лекарственная форма появилась благодаря созданию таблетки с системой диффузии через гелевый барьер (рис. 3). Активное вещество содержится внутри двухслойного гидрофильного полимерного матрикса (внутренний полимерный матрикс), окруженного закрытым полимерным матриксом (наружный полимерный матрикс). После приема препарата полимеры наружного плотного слоя гидратируются и таблетка Глюкофаж Лонг превращается в гелеподобную массу, увеличиваясь в размерах. Такая трансформация способствует замедлению эвакуации через привратник и увеличивает время нахождения препарата в желудке. Препарат, высвобождаясь для абсорбции из внутреннего слоя, диффундирует через внешний полимерный матрикс. Высвобождение 90% содержащегося лекарственного вещества при этом занимает около 10 часов, в отличие от традиционной формы, когда 90% метформина высвобождается в течение 30 минут.
Важно отметить, что скорость высвобождения вещества не зависит от перистальтики кишечника, уровня pH, что сводит к минимуму вариабельность поступления препарата в ЖКТ.
Исследования фармакокинетики показали, что после однократного приема 2000 мг метформина замедленного высвобождения площадь под кривой зависимости «концентрация – время» была аналогична таковой после двукратного приема 1000 мг метформина обычного высвобождения, что свидетельствует о биоэквивалентности данных лекарственных форм [48, 49].
Доказано, что время достижения пиковой концентрации Глюкофажа Лонг увеличивается до 7 часов (для метформина обычного высвобождения оно составляет 2,5 часа) [49]. Следовательно, Глюкофаж Лонг обладает более длительным действием, что позволяет принимать его один раз в день. Это в свою очередь способствует повышению приверженности и результатов терапии СД 2 [47–49].
При аналогичной биодоступности пиковая концентрация метформина замедленного высвобождения по сравнению с таковой метформина обычного высвобождения снижена на 25% [49].
В рандомизированном двойном слепом исследовании Глюкофаж Лонг продемонстрировал такую же эффективность в снижении уровня HbA1c, как и метформин обычного высвобождения [50].
Кроме того, благодаря фармакокинетике Глюкофажа Лонг удается избежать быстрого подъема концентрации метформина в плазме и, как следствие, развития нежелательных явлений со стороны ЖКТ (рис. 4) [47–50]. Так, при ретроспективном анализе медицинских карт пациентов с СД 2 на предмет гастроинтестинальной переносимости двух форм метформина показано существенное сокращение частоты нежелательных явлений со стороны ЖКТ у пациентов, переведенных с терапии метформином обычного высвобождения на метформин замедленного высвобождения (рис. 5) [47, 48].
Глюкофаж Лонг выпускается в таблетках по 500 и 750 мг. Начальная доза – 500 мг один раз в сутки. Препарат принимается во время ужина. Его доза в зависимости от уровня глюкозы в плазме крови может увеличиваться на 500 мг каждые 10–15 дней до максимальной суточной дозы – четыре таблетки по 500 мг или три таблетки по 750 мг однократно. Если при максимальной суточной дозе целевой уровень гликемии не достигается, рассматривается возможность приема препарата два раза в день. При переходе с Глюкофажа на Глюкофаж Лонг начальная доза последнего должна быть равна суточной дозе первого.
Заключение
Выбор ПСП требует взвешенного подхода и оценки соотношения риск/польза, особенно у пациентов с факторами риска развития ССЗ и ХБП. Повысить эффективность сахароснижающей терапии позволяет применение лекарственных средств, воздействующих на ИР. Выраженным ингибирующим действием в отношении ИР обладает метформин. На сегодняшний день он остается наиболее изученным с точки зрения эффективности и безопасности препаратом в лечении пациентов с СД 2 типа как в монотерапии, так и в комбинации с другими ПСП и инсулином. Современные пролонгированные формы метформина (Глюкофаж Лонг) сохраняют все достоинства традиционного метформина, а также характеризуются лучшей переносимостью и удобством применения, что способствует повышению приверженности лечению.
Ye.V. Biryukova, I.A. Morozova
Moscow State Institute of Medicine and Dentistry named after A.I. Evdokimov
Contact person: Yelena Valeryevna Biryukova, lena@obsudim.ru
Type 2 duabetes mellitus (T2DM) is a chronic disease characterized by development of micro- and macrovascular complications. Prevention of their development is an important task for modern medicine. Here we discuss key arms of T2DM pathogenesis, pathophisiologically-validated approaches to its treatment, particularly administration of medicila drugs acting on improving sensitivity of the body tissues to insulin. Pharmacological characteristics of metformin and opportunities of its administration were discussed in detail in patients with chronic renal disease, Non-alcoholic fatty liver disease. The main benefits of Glucophage Long were outlined as well.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.