Глюкофаж – препарат выбора при манифестации сахарного диабета типа 2
- Аннотация
- Статья
- Ссылки
Основная часть пациентов – это пациенты, страдающие сахарным диабетом 2 типа (СД 2). Необходимо учитывать, что очень часто манифестация СД 2, а точнее момент постановки диагноза, приходится на период проявления первых осложнений данного заболевания. Отсутствие яркой клинической картины вначале, а как следствие и жалоб у пациента, позволяет длительное время предполагать отсутствие заболевания. В связи с этим не удивительно, что практическая распространенность СД 2 в 2-3 раза выше, чем статистическая (5).
Проведенное в 1998 г. в США исследование (NHANES lll) показывает, что распространенность не диагностированного СД 2 среди населения в среднем составляет 2,7%, причем, среди женщин в возрасте 50-59 лет она составляет 5,8%, а у мужчин этой же возрастной группы – 3,3% (6). В исследовании под руководством Dunstan D.W. было показано, что у 8% пациентов имел место ранее не диагностированный СД 2 типа, а у 1,5-7,3% лиц с нарушенной толерантностью к глюкозе (НТГ) развивается СД 2 типа (7).
Чем выше уровень тощаковой гликемии, тем больше риск развития СД 2 типа, т.к. стойкий уровень гликемии натощак 5,6 ммоль/л и более повышает риск перехода НТГ в СД 2 типа в 3,3 раза. Глюкозотоксичность является одним из ведущих факторов образования и развития диабетических осложнений. Достоверно доказано, что пациенты, имеющие нарушения углеводного обмена, так же часто имеют осложнения со стороны сердечно-сосудистой и нервной систем, как и пациенты, страдающие СД 2 типа. Большинство пациентов, к моменту постановки диагноза СД 2 типа нуждаются в лечении данных осложнений (1, 2). Именно осложнения приводят к потере трудоспособности, инвалидизации и ранней смерти данных пациентов.
Сахарный диабет ускоряет развитие атеросклероза (АС), возникновение которого часто предшествует диагностике гипергликемии и постановке диагноза СД 2 типа (8-10). У больных СД 2 типа 60-75% смертельных исходов вызваны коронарным атеросклерозом, что в 3 раза выше, чем среди людей того же возраста, не страдающих диабетом (1, 2). Распространенность ишемической болезни сердца (ИБС) у больных СД 2 типа в 2-4 раза выше, чем у лиц, не страдающих данным заболеванием, риск инфаркта миокарда – в 6-10 раз выше, а инсультов – в 4-7 раз, причем у женщин он выше, чем у мужчин. Причиной смерти почти 50% больных СД 2 типа служит острый инфаркт миокарда (11). Необходимо отметить, что от 40 до 80% больных СД 2 страдают артериальной гипертензией (АГ) (12, 13), причем даже небольшое повышение артериального давления (АД) у этих пациентов значительно повышает риск смерти и сердечно-сосудистых осложнений (14). Так, повышение АД на каждые 10 мм рт. ст. сопряжено с увеличением смертности на 15%, повышением частоты инфаркта миокарда – на 11%, инсульта – на 19% и застойной сердечной недостаточности – на 12% (15).
Необходимо отметить, что сахарный диабет 2 типа практически всегда ассоциирован с ожирением. Практически 90% пациентов с впервые выявленным СД 2 типа страдают ожирением или имеют избыточную массу тела, причем чаще всего это распределение жира по абдоминальному типу или сочетанное ожирение (гиноидное и андроидное). Известно, что жировая ткань при абдоминальном ожирении представлена большими инсулинрезистентными адипоцитами, а жировая ткань в области бедер – малыми инсулин чувствительными адипоцитами. Между инсулинорезистентностью и висцеральным ожирением формируется «замкнутый порочный» круг, одним из звеньев которого является гиперинсулинемия. Белая жировая ткань синтезирует лептин, гормон жировой ткани. Секреция лептина прямо пропорциональна объему жировой массы. Уровень лептина повышен при ожирении (16). Основные его эффекты – это блокирование активности фосфоэнолпируваткарбоксилазы в печени, что приводит к снижению скорости глюконеогенеза; подавляет транспорт глюкозы в самой жировой ткани; фосфорилирование тирозина, который является субстратом инсулинового рецептора, – в мышечной ткани. Отмечена четкая положительная корреляция между продукцией лептина, гиперинсулинемией и инсулинорезистентностью. Чем больше выражено висцеральное ожирение, тем больше будет выражена инсулинорезистентность. При сравнении секреции инсулина у пациентов с нормальной массой тела и пациентов с ожирением, выявлено, что уровень секреции инсулина повышен при избытке веса. Чем больше избыток массы тела пациента, тем больше выражена инсулинорезистентность и тем больше уровень секретируемого инсулина (17).
Таким образом, можно сказать, что абдоминальное ожирение является одним из ключевых факторов, приводящих к развитию сахарного диабета 2 типа. При снижении массы тела удается достичь целевых значений гликемии у лиц с выявленным нарушением толерантности к глюкозе, а также замедлить прогрессирование или предотвратить развитие осложнений при сахарном диабете 2 типа. Достоверно известно, что при снижении массы тела отмечается улучшение чувствительности к инсулину, улучшение (иногда нормализация) липидного профиля, снижение артериального давления, маркеров воспаления и тромбообразования (18). Вышеперечисленные изменения начинают проявляться уже при снижении веса на 5-10% от исходной массы тела. Необходимо отметить, что чем медленнее происходит снижение веса, тем более стойким будет эффект. Естественно, медленно не означает долго.
Существует множество факторов, влияющих на выбор препарата для лечения. Безусловно, на первом месте стоит эффективность, безопасность и сочетаемость с другими препаратами. Необходимо четко понимать, что организм состоит из множества органов и систем и чаще всего пациенты, страдающие СД 2 типа, нуждаются в терапии сопутствующих заболеваний (гипертоническая болезнь, ХОБЛ, ожирение и другие), поэтому необходимо учитывать возможность сочетать препараты между собой. Самым распространенным из побочных эффектов, при применении препаратов для коррекции гликемии, является развитие гипогликемических состояний. Частота их развития будет являться одним из факторов, определяющих приверженность пациентов к данной терапии. Большинство больных СД 2 типа – это люди старшей возрастной группы, для которых необходимо учитывать простоту и удобство в применении препарата.
Факторы, влияющие на выбор препарата для лечения сахарного диабета типа 2:
-
эффективность;
-
побочные эффекты;
-
частота гипогликемических эпизодов;
-
сопутствующие заболевания;
-
наличие ожирения;
-
наличие дислипидемии;
-
сопутствующая терапия другими препаратами;
-
возраст пациента;
-
простота и удобство применения.
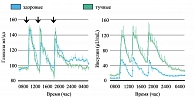
При выборе патогенетической терапии на фоне манифестации СД 2 типа ключевым фактором является определение патогенетического механизма развития СД, который преобладает у данного пациента, – нарушение секреции инсулина или инсулинорезистентность. У большинства больных с впервые выявленным СД 2 типа наблюдается избыточная масса тела, развивающаяся в рамках метаболического синдрома, которая при срыве компенсационных механизмов приводит к развитию стойкой инсулинорезистености и клиническому проявлению гипергликемии. Особо следует отметить постпрандиальный уровень гликемии, который существенно повышен у пациентов с СД 2 типа, страдающих ожирением.
В связи с этим у больных СД типа 2 приобретают актуальность пероральные сахароснижающие препараты, которые повышают чувствительность тканей организма к инсулину и подавляют тощаковый (ночной) выброс гликогена печенью. К этим препаратам относятся бигуаниды, из которых для применения при СД 2 типа на фармацевтическом рынке России рекомендован только метформин. Основное внимание мы уделим широко известному оригинальному метформину – препарату Глюкофаж (производитель «Мерк-Сантэ», Франция, в России представлен компанией «Никомед»).
Механизм антигипергликемического действия метформина включает в себя снижение продукции глюкозы печенью, а также уменьшение продукции свободных жирных кислот (СЖК), ускорение окисления жира и частично – усиление периферического захвата глюкозы (2, 20). Основной эффект проявляется на уровне печени, хотя периферическое действие метформина на мышечную и жировую ткань оказывает свое позитивное воздействие на уровень гликемии. Препарат увеличивает синтез гликогена в печени за счет усиления кровообращения в печени и ускорения процесса превращения глюкозы в гликоген (19, 21), с другой стороны, способствует подавлению глюконеогенеза из таких предшественников глюкозы, как лактат, пируват, глицерол и некоторых аминокислот, а также противодействует глюконеогенетическому действию глюкагона. Метформин тормозит поступление перечисленных выше субстратов глюконеогенеза в гепатоциты и ингибирует его ключевые ферменты (пируваткарбоксилазу, фруктозо-1,6-бифосфатазу и глюкозо-6-фосфатазу). При оценке безопасности действия метформина выявлено повышение уровня печеночных трансаминаз у ряда пациентов. В основном данный эффект наблюдался у лиц, регулярно употреблявших большие дозы алкоголя и/или имеющих разные стадии печеночной недостаточности. Рекомендован контроль ферментов печени перед назначением препаратов метформина.
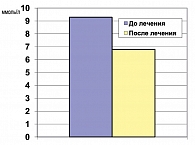
Препараты метформина усиливают утилизацию глюкозы скелетными мышцами и жировой тканью, что приводит к повышению чувствительности этих тканей к инсулину на 18-50% (22). В ходе плацебо-контролируемых исследований показано, что инсулинозависимое поглощение глюкозы повышается на 20-30% под влиянием метформина. Достоверно показано снижение уровня тощаковой глюкозы в плазме крови при применении препарата Глюкофаж пациентами с СД 2 типа на 2,5 ммоль/л.
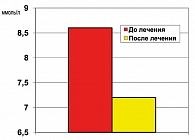
Результаты клинических исследований свидетельствуют, что метформин снижает HbA1c на 0,6-2,4% (23). Данный критерий был оценен для препарата Глюкофаж при проведении ретроспективного анализа историй болезни пациентов, находившихся 3 месяца на терапии данным представителем метформина.
Одновременно метформин оказывает влияние на всасывание углеводов в желудочно-кишечном тракте (ЖКТ), с одной стороны, замедляя ее скорость, с другой – значительно повышая утилизацию глюкозы в кишечнике, усиливая в нем анаэробный гликолиз как в состоянии насыщения, так и натощак. Именно этим обусловлен один из побочных эффектов (ПЭ) данной группы препаратов – диспепсия. Выраженность данного ПЭ колеблется от 65 до 97%. В проведенном ретроспективном анализе эффективности и безопасности применения бигуанидов (метформина) в фармакотерапии сахарного диабета
2 типа показано, что диспепсия развивалась у 81% пациентов, принимавших Глюкофаж. Данный эффект, вероятно, связан с накоплением препарата в слизистой кишечника и локальным повышением выработки лактата. Расстройства со стороны ЖКТ чаще всего развиваются при назначении препарата с дозы 2000 мг и отсутствии титрации. В связи с чем, рекомендуется начинать назначение препарата с минимальной дозы и постепенно наращивать ее до необходимой. Это позволяет нивелировать данный побочный эффект.
Большинство пациентов, принимавших Глюкофаж, отметили снижение аппетита, что приводило к значимому уменьшению объема употребляемой пищи и, как следствие, способствовало уменьшению постпрандиальной гликемии (22, 24). В ходе длительной терапии метформином у тучных пациентов с СД 2 типа часто наблюдается уменьшение веса тела или отсутствует его увеличение. Увеличение массы тела является одним из наиболее частых побочных эффектов терапии препаратами – производными сульфонилмочевины или инсулином (24).
Следует отметить отсутствие прямого влияния препаратов метформина на секрецию инсулина, что позволяет сохранять функциональную активность
b-клеток, снижение глюкозотоксичности и липотоксичности (8). Метформин, за счет снижения соотношения связанного инсулина к свободному и повышения соотношения инсулина к проинсулину, изменяет фармакодинамику инсулина, приводя, таким образом, к снижению базального уровня инсулина в сыворотке крови на фоне уменьшения инсулинорезистентности. Глюкофаж способствует коррекции нарушенной секреции инсулина и улучшению чувствительности тканей к нему.
Препараты данной группы не вызывают гипогликемии, поэтому возможен их прием пациентами, страдающими нарушением толерантности к глюкозе и ожирением. Следует отметить гиполипидемическое и антиатерогенное действие метформина. Препарат способен снижать на 10-30% окисление СЖК, таким образом корректируя нарушенную секрецию инсулина. Повышенная концентрация СЖК в печени стимулирует ранние этапы глюконеогенеза, в скелетных мышцах подавляет активность пируват-дегидрогеназы, нарушает транспорт и фосфорилирование глюкозы (25), в b-клетках оказывает липотоксическое действие. Метформин снижает окисление СЖК, усиливает их реэстерификацию и подавляет липолиз в жировой ткани (26), снижает концентрацию триглицеридов (на 10-20%) и, как следствие, снижает печеночный синтез и повышает клиренс ЛПОНП (22-24), таким образом приводя к уменьшению отложения жира в этом органе.
В многоцентровом рандомизированном исследовании UKPDS (UK Prospective Diabetes Study, 1998) показано, что применение метформина позволило достоверно снизить риск сосудистых осложнений на 40%. Применение препаратов метформина позволяет замедлить прогрессирование сердечно-сосудистых осложнений (22, 23), снизить риск образования тромбов за счет торможения агрегации тромбоцитов (1, 23), улучшить процессы фибринолиза за счет снижением уровня ингибитора активатора плазминогена-1 (ИАП-1), инактивирующего тканевой активатор плазминогена. У пациентов пожилого возраста применение метформина не влияло на депрессию интервала QТ, что уменьшает риск развития аритмии и внезапной сердечной смерти (27). Большинство пациентов, страдающих НТГ или СД типа 2, имеют выраженное отклонение массы тела в сторону увеличения, поэтому проведен ряд исследований влияния препаратов метформина на вес. Выявлено, что метформин способствует уменьшению массы висцерального жира, адипоциты которого продуцируют больше ИАП-1, чем адипоциты подкожно-жировой клетчатки (28).
Метформин тормозит окислительное гликозилирование белков и ряд клеточных окислительных реакций (25), нормализует цикл сокращения/расслабления артериол, уменьшает проницаемость сосудистой стенки и тормозит процессы неоангиогенеза, восстанавливает функции пейсмекерных клеток, регулирующих циклическую вазодвигательную активность (23), воздействует на ранние стадии развития атеросклероза, нарушая адгезию моноцитов, их трансформацию и способность захватывать липиды (22, 23). В ряде экспериментальных и клинических исследований было выявлено прямое благоприятное воздействие Глюкофажа на микроциркуляцию и функцию эндотелия (25, 28).
Таким образом, можно сказать, что препараты данной группы обладают многоплановым действием, включающим в себя не только антигипергликемизирующий эффект, но и антиатеросклеротическое, антиоксидантное, вазопротективное действие. Именно эти характеристики важны при назначении препарата Глюкофаж пациентам с нарушенной толерантностью к глюкозе, что можно расценивать как профилактику развития СД 2 типа (11). Согласно выводам UKPDS, терапия метформином тучных пациентов позволяет снизить риск всех диабетических осложнений.
Выводы UKPDS по терапии метформином у тучных пациентов: – наиболее эффективными для достижения компенсации углеводного обмена признаны метформин, глибенкламид, хлорпропамид и инсулин; – терапия метформином у тучных лиц снижает риск всех диабетических осложнений:
сосудистых осложнений на 32%;
смертность от диабета на 42%;
общую смертность на 36%;
инфаркты миокарда на 39%.
Необходимо отметить, что риск развития гипогликемии на фоне приема препарата Глюкофаж практически отсутствует, поскольку препарат не стимулирует секрецию инсулина b-клетками (22).
В отличие от классических бигуанидов, Глюкофаж практически безопасен и редко приводит к развитию лактацидоза. Этот факт объясняется особенностями его строения (препарат является диметилбигуанидом). Метформины имеют две метильные группы в положении N1, что препятствует образованию циклической структуры, а отсутствие длинных гидрофобных боковых цепей ограничивает способность к связыванию с клеточной мембраной и активное накопление внутри клетки. Именно эти особенности химического строения обеспечивают низкую частоту развития лактацидоза. Факторами формирования последнего являются: выраженная почечная и/или печеночная недостаточность, гипоксия, алкогольная интоксикация. Пациенты должны быть осведомлены о необходимости отмены препарата при приеме алкоголя. При сочетании алкоголя и препаратов метформина может развиваться покраснение лица, проходящее самостоятельно. Длительность приема и дозировка Глюкофаж не влияют на частоту формирования лактацидоза.
Препарат абсорбируется из желудочно-кишечного тракта практически полностью, подвергается метаболизму в очень слабой степени и выводится из организма почками (90% препарата в неизмененном виде – в течение 16-18 ч.). Период полувыведения составляет 9-12 часов. При почечной недостаточности скорость выведения метформина снижается пропорционально уменьшению клиренса креатинина и возрастает риск кумуляции препарата и развития лактацидоза. Именно этим обусловлена необходимость титрации дозы препарата у пожилых пациентов и при развитии почечной недостаточности.
Учитывая активное тормозящее влияние Глюкофаж на глюконеогенез, рекомендуем назначать прием препарата на ночь для адекватной коррекции гликемии в ночные часы. При недостаточности эффекта необходимо добавить прием в утреннее время. Суточная дозировка может составлять до 3000 мг. По результатам проведенного анализа дозозависимого эффекта Глюкофаж на уровень гликемии и гликированного гемоглобина, Garber A. отметил, что максимально эффективной является доза в 2000 мг (29). При отсутствии достижения целевых значений уровня гликемии необходимо добавить препараты сульфонилмочевины или секретагоги. Глюкофаж необходимо добавлять к инсулинотерапии у тучных пациентов. Важно отметить, что Глюкофаж является единственным препаратом, показанным к применению в детской практике начиная с 10-летнего возраста.
В заключение необходимо выделить, что Глюкофаж является препаратом выбора для начала терапии у пациентов с избыточным весом и нарушенной толерантностью к глюкозе, а так же обязательным препаратом в комбинации с любым сахароснижающим препаратом у пациентов с СД 2 типа с избыточной массой тела.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.