Роль дапаглифлозина в снижении риска развития терминальной почечной недостаточности у пациентов с сахарным диабетом 2 типа и без диабета
- Аннотация
- Статья
- Ссылки
- English
За последние 15 лет расходы здравоохранения, связанные с сахарным диабетом, увеличились на 316%, приблизившись к 1 трлн долларов США. При этом 81% взрослых пациентов проживают в странах с низким и средним уровнем дохода.
Несмотря на разработанные критерии диагностики и алгоритмы лечения, в 2021 г. смертность от сахарного диабета достигла 6,7 млн человек.
Известно, что у большинства больных уже при установлении диагноза «сахарный диабет 2 типа» имеют место микро- и макрососудистые осложнения, полинейропатия, которые со временем приводят к инвалидизации и преждевременной смерти. Одним из наиболее распространенных микрососудистых осложнений сахарного диабета признана хроническая болезнь почек (ХБП). Согласно данным мировой статистики, 40% пациентов с сахарным диабетом 2 типа страдают ХБП и только 10–15% знают о наличии у себя патологии.
Дапаглифлозин ассоциируется с ранней и комплексной кардиоренальной защитой у широкой популяции пациентов. Препарат оказался эффективным в отношении уменьшения риска устойчивого снижения расчетной скорости клубочковой фильтрации, наступления терминальной стадии ХБП, смерти от сердечно-сосудистого заболевания и госпитализации по поводу сердечной недостаточности.
За последние 15 лет расходы здравоохранения, связанные с сахарным диабетом, увеличились на 316%, приблизившись к 1 трлн долларов США. При этом 81% взрослых пациентов проживают в странах с низким и средним уровнем дохода.
Несмотря на разработанные критерии диагностики и алгоритмы лечения, в 2021 г. смертность от сахарного диабета достигла 6,7 млн человек.
Известно, что у большинства больных уже при установлении диагноза «сахарный диабет 2 типа» имеют место микро- и макрососудистые осложнения, полинейропатия, которые со временем приводят к инвалидизации и преждевременной смерти. Одним из наиболее распространенных микрососудистых осложнений сахарного диабета признана хроническая болезнь почек (ХБП). Согласно данным мировой статистики, 40% пациентов с сахарным диабетом 2 типа страдают ХБП и только 10–15% знают о наличии у себя патологии.
Дапаглифлозин ассоциируется с ранней и комплексной кардиоренальной защитой у широкой популяции пациентов. Препарат оказался эффективным в отношении уменьшения риска устойчивого снижения расчетной скорости клубочковой фильтрации, наступления терминальной стадии ХБП, смерти от сердечно-сосудистого заболевания и госпитализации по поводу сердечной недостаточности.

Сахарный диабет (СД) является одним из самых распространенных заболеваний, получившим название неинфекционной пандемии. На настоящий момент времени каждый десятый на планете страдает сахарным диабетом (СД) [1], что составляет 537 млн человек. К 2045 г. количество пациентов может увеличиться до 783 млн. Нарушение углеводного обмена имеет место у 541 млн. У большинства из них при неправильном питании и сниженной физической активности разовьется СД.
Согласно заявлению экспертов Международной диабетической федерации, в 2021 г. СД стал одной из глобальных и стремительно нарастающих проблем здравоохранения [2]. Так, за последние 15 лет расходы здравоохранения, связанные с СД, увеличились на 316%, приблизившись к 1 трлн долларов США. При этом 81% взрослых пациентов с диабетом проживают в странах с низким и средним уровнем дохода.
Несмотря на существующие алгоритмы диагностики и лечения СД, в 2021 г. смертность в данной популяции составила 6,7 млн человек [2].
Развитие СД 2 типа характеризуется медленным, постепенным и плавным началом. Довольно длительное время организм справляется с умеренной гипергликемией. Сначала это происходит за счет компенсаторной гиперсекреции инсулина на фоне инсулинорезистентности. Прогрессирование заболевания приводит к апоптозу β-клеток, истощению инсулярного аппарата и развитию гипергликемии. Формирующиеся дефекты β-клетки частично обратимы при ранней интенсивной терапии – в первые четыре года от манифестации СД [3]. Отсутствие жалоб в этот период является одной из причин поздней диагностики заболевания. Так, диагноз устанавливается в среднем на пять – десять лет позже дебюта СД [4].
В настоящее время известно, что чем выше уровень гликированного гемоглобина (HbA1с), тем выше риск развития СД. При уровне HbA1с 6,0–6,5% диабет развивается в 20 раз чаще, чем при уровне менее 5,0% [5]. Именно поэтому всем лицам группы риска (ожирение, артериальная гипертензия, гиперхолестеринемия, возраст старше 45 лет и др.) необходимо регулярно определять HbA1с.
Большинство пациентов уже в момент постановки диагноза СД 2 типа имеют микро- и макрососудистые осложнения, полинейропатию, которые со временем приводят к инвалидизации и преждевременной смерти [6].
Одним из наиболее распространенных микрососудистых осложнений СД признана хроническая болезнь почек (ХБП). Согласно данным Федерального регистра СД на 1 января 2021 г., она встречается у 18% пациентов [7]. Данные мировой статистики свидетельствуют о том, что 40% пациентов с СД 2 типа страдают ХБП [8], однако только 10–15% из них знают о своем заболевании [9].
Механизмы развития хронической болезни почек при сахарном диабете 2 типа
Этиология и патогенез ХБП при СД 2 типа имеют сложный механизм, включающий артериальную гипертензию, нарушение липидного и пуринового обмена, ожирение, сердечную недостаточность на фоне хронической гипергликемии. Гломерулонефрит, рефлюкс-нефропатия, поликистозная болезнь почек, ишемическая нефропатия (двусторонний стеноз почечной артерии, холестериновая эмболия сосудов почек), артериолонефросклероз, преимущественно на фоне артериальной гипертензии, необратимые изменения почечной ткани после перенесенного острого почечного повреждения вследствие воздействия рентген-контрастного средства, на фоне септического состояния и ряд других факторов являются наиболее частыми причинами развития терминальной почечной недостаточности (ТПН) у пациентов с СД 2 типа [10].
Анализ данных почечного регистра США показал, что в 2019 г. в структуре диализной популяции 46,6% приходилось на больных СД, получавших программный диализ, 38,4% – перитонеальный [11].
Таким образом, СД является самой частой причиной развития терминальной стадии ХБП, требующей применения методов заместительной почечной терапии.
Риск смерти от любой причины резко увеличивается при прогрессировании ХБП у пациентов с СД [12], а также у лиц без СД при снижении расчетной скорости клубочковой фильтрации (рСКФ) и повышении соотношения «альбумин/креатинин» мочи [13].
В настоящее время ХБП признана наднозологическим понятием и определяется как нарушение структуры или функции почек, сохраняющееся более трех месяцев и имеющее последствия для здоровья [14].
Диабетическая нефропатия, модулируемая генетическими факторами, развивается в результате воздействия метаболических (гипергликемия, дислипидемия, нарушение пуринового обмена) и гемодинамических (артериальная гипертензия, внутриклубочковая гипертензия) факторов на почечную микроциркуляцию [6].
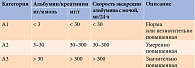
Стадия почечной патологии оценивается по СКФ, отражающей количество и суммарный объем работы нефронов, в том числе неэкскреторных функций, и уровню альбумина [15].
Предпочтительными маркерами ХБП являются соотношение «альбумин/креатинин» или уровень креатинина в разовой порции мочи и рСКФ (табл. 1 и 2) [16].
Преходящее повышение экскреции альбумина с мочой выявляется при значительной гипергликемии, интенсивной физической нагрузке, высокобелковом питании, лихорадке, менструации.
Референтными (клиренсовыми) методами СКФ определяется при беременности, морбидном ожирении (индексе массы тела ≥ 40 кг/м2), дефиците массы тела (индексе массы тела ≤ 15 кг/м2), вегетарианстве, миодистрофии, параплегии, квадриплегии, нестандартных размерах тела (ампутированные конечности), остром почечном повреждении, почечном трансплантате, назначении нефротоксичных препаратов, определении начала заместительной почечной терапии [15].
Несмотря на четкие критерии диагностики, процент недиагностированной ХБП у пациентов с СД остается очень высоким. Так, ХБП С1–2 остается недиагностированной у 96,6% больных, ХБП С3 – у 82%, ХБП С4–5 – у 46,7% [17, 18]. Именно поэтому в Алгоритмах специализированной медицинской помощи больным сахарным диабетом 2021 г. даны рекомендации по скринингу ХБП.
Ежегодная оценка альбуминурии (соотношение «альбумин/креатинин» в разовой порции мочи) и расчет СКФ проводятся:
- у пациентов с СД 1 типа с длительностью заболевания пять лет и более;
- у всех пациентов с СД 2 типа;
- у детей начиная с 11 лет при длительности СД более двух лет;
- у всех пациентов с сопутствующей артериальной гипертензией.
С учетом вариабельности повышенная альбуминурия подтверждается результатами двух положительных тестов в течение трех периодов от трех до шести месяцев [14].
Фармакологическая нефропротекция
В настоящее время лечение СД направлено на предотвращение развития его осложнений и улучшение качества жизни пациентов.
Особенностью современной диабетологии является персонализированный, пациенториентированный подход к терапии [19]. Учитываются не только возможности развития гипогликемии, прибавки массы тела на фоне приема препаратов, но и наличие признаков или факторов высокого риска развития сердечно-сосудистых заболеваний, хронической сердечной недостаточности, диабетической нефропатии (ХБП).
Препарат подбирают с учетом гликемического контроля (стартовой гликемии, уровня HbA1с), необходимости контроля веса (при избыточной массе тела или ожирении), способности управлять сердечно-сосудистыми рисками, а также кардиоренопротективных и органопротективных свойств.
Золотым стандартом фармакологической нефропротекции у пациентов с СД 2 типа являются препараты, блокирующие ренин-ангиотензин-альдостероновую систему. Ингибиторы ангиотензинпревращающего фермента (иАПФ) и антагонисты рецепторов ангиотензина II (блокаторы АТ1-рецепторов (БРА)) воздействуют на классические патогенетические механизмы поражения почек – системную и внутриклубочковую гипертензию [20].
С 2014 г. в клиническую практику были введены ингибиторы натрий-глюкозного котранспортера 2 (иНГЛТ-2).
В норме почки фильтруют и реабсорбируют около 180 г глюкозы в сутки, которая практически полностью реабсорбируется с помощью НГЛТ в проксимальных извитых канальцах [21].
Основную роль в почечной реабсорбции глюкозы играет НГЛТ-2, который является высокоаффинным мощным транспортером. Он представлен в сегментах S1 и S2 проксимального извитого канальца нефрона и опосредует 90% реабсорбции почечной глюкозы из первичного клубочкового фильтрата. НГЛТ-1 локализуется в S3-сегменте проксимального почечного канальца и отвечает за реабсорбцию 10% глюкозы [22].
В эпителиальных клетках почечных канальцев молекулы глюкозы связываются глюкозными транспортерами (ГЛЮТ) и с помощью пассивного транспорта выделяются в кровь. При участии Na+/K+-АТФазы реабсорбированные ионы натрия переносятся через базолатеральную мембрану из внутриклеточного пространства эпителиоцита в просвет сосуда в обмен на ионы K [23].
На экспериментальных моделях показано, что в условиях гипергликемии количество НГЛТ-1, НГЛТ-2 и ГЛЮТ увеличивается [24]. Кроме того, при СД 2 типа в проксимальных почечных канальцах повышается резорбтивный потенциал для молекул глюкозы. Так, в норме он составляет 10,0–11,0 ммоль/л, при СД – увеличивается на 2,2 ммоль/л (40 мг/дл), что является одним из механизмов развития гипергликемии [25].
Благодаря высокоселективному связыванию с соответствующим белком-переносчиком глюкозы ингибиторы НГЛТ-2 блокируют ее реабсорбцию в проксимальных извитых канальцах почек, усиливая глюкозурию у пациентов с СД [26].
На фоне гипергликемии одновременно увеличивается реабсорбция Na и уменьшается его доставка к плотному пятну, что приводит к вазодилатации афферентных артериол и формированию внутриклубочковой гипертензии. Ингибирование НГЛТ-2 снижает гиперфильтрацию через восстановление тубуло-гломерулярной обратной связи [27].
Индуцированная иНГЛТ-2 глюкозурия оказывает влияние на уровень HbA1c, массу тела и артериальное давление [28].
Ингибиторы НГЛТ-2 также способны улучшать функцию β-клеток и чувствительность мышечной ткани к инсулину, таким образом опосредованно снижая глюкозотоксичность [29].
Действие ингибиторов НГЛТ-2 является инсулиннезависимым и становится минимальным при гликемии менее 5,0 ммоль/л, что уменьшает риск развития гипогликемий. Это позволяет применять препараты данной группы на любой стадии СД 2 типа [30].
Результаты крупных рандомизированных клинических исследований продемонстрировали способность иНГЛТ-2 не только обеспечивать гликемический контроль, но и снижать частоту неблагоприятных почечных исходов у пациентов с СД 2 типа.
Именно поэтому в зарубежных клинических рекомендациях иНГЛТ-2 рассматриваются как приоритетная терапия у пациентов с СД 2 типа и ХБП [19, 31, 32].
Дапаглифлозин
Дапаглифлозин является первым представителем иНГЛТ-2 [33]. Установлено, что через 24 недели приема препарата уровень HbA1с снижался на 0,89% от исходного [34], систолическое артериальное давление – на 5,1 мм рт. ст. [35], масса тела – почти на 3 кг [36, 37].
Выявлено также специфическое влияние дапаглифлозина на почки: к 12-й неделе – снижение альбуминурии на 33% (в дополнение к иАПФ/БРА), до четырех лет – стабильность рСКФ [38, 39].
При метаанализе результатов 12 плацебо-контролируемых исследований продолжительностью от 12 до 104 недель было установлено, что на фоне приема дапаглифлозина в комбинации с метформином, глимепиридом, пиоглитазоном, ситаглиптином или инсулином скорректированный средний уровень HbA1c уменьшился на 0,52% от исходного (при 95%-ном доверительном интервале (ДИ) 0,45–0,60; p < 0,001) [40].
Эффективность препарата не зависела от уровня гликированного гемоглобина [41, 42].
Наибольшая динамика массы тела была отмечена у получавших комбинированную терапию дапаглифлозином и производными сульфонилмочевины [33].
На протяжении 208 недель сохранялось снижение массы тела на 3,65 кг, достигнутое при терапии дапаглифлозином в сочетании с метформином [39].
J. Bolinder и соавт. с помощью двухэнергетической рентгеновской абсорбциометрии исследовали жировую ткань пациентов с СД 2 типа, получавших комбинацию метформина и дапаглифлозина. Через 24 недели окружность талии уменьшилась на 2,5 см, через 102 недели – на 5,0 см по сравнению с исходными значениями. На 102-й неделе жировая масса тела уменьшилась на 2,8 кг [42, 43].
В исследовании DECLARE-TIMI 58 средняя продолжительность наблюдения на терапии дапаглифлозином составила 4,2 года. У большинства пациентов почечная функция была сохранна. Терапия дапаглифлозином ассоциировалась со снижением на 47% риска достижения первичной комбинированной конечной точки, включая снижение рСКФ на 40% и более (менее чем 60 мл/мин/1,73 м2), или развитие терминальной стадии почечной недостаточности (диализ в течение 90 дней и более, стойкое снижение рСКФ < 15 мл/мин/1,73 м2 или трансплантация почки), или почечную смерть (относительный риск (ОР) 0,53 (95% ДИ 0,43–0,66); p < 0,001). Частота их развития в группах лечения и контроля уменьшилась до 1,5 и 2,8%, или 3,7 и 7,0 случая на 1000 пациенто-год. Самостоятельный риск развития терминальной стадии почечной недостаточности или почечной смерти был ниже у получавших дапаглифлозин – 0,1 против 0,3% соответственно (ОР 0,41 (95% ДИ 0,20–0,82); p = 0,012) [44].
DAPA-CKD – первое международное многоцентровое с управляемыми событиями рандомизированное двойное слепое плацебо-контролируемое исследование в параллельных группах, направленное на изучение/оценку дапаглифлозина у пациентов с ХБП как с СД 2 типа, так и без СД 2 типа. Медиана периода наблюдения составила 2,4 года [38]. Дапаглифлозин в дозе 10 мг/сут добавляли к стандартной терапии стабильно максимально переносимыми дозами иАПФ или БРА. Первичная конечная точка определена как сочетание стойкого снижения рСКФ на ≥ 50%, ТПН (необходимость поддерживающего диализа (перитонеального или гемодиализа) в течение не менее 28 дней или трансплантации почки или рСКФ < 15 мл/мин/1,73 м2 в течение не менее 28 дней), почечной или сердечно-сосудистой смерти. Почечная смерть – смерть из-за ТПН, когда диализ был намеренно прекращен по какой-либо причине. Вторичные конечные точки включали стойкое снижение рСКФ ≥ 50%, ТПН или почечную смерть, комбинацию смерти от сердечно-сосудистых заболеваний или госпитализации по поводу сердечной недостаточности, или смерть от всех причин [45]. Безопасность терапии оценивали по серьезным нежелательным явлениям и нежелательным явлениям, приведшим к преждевременному прекращению приема исследуемого препарата, прерыванию его приема или снижению дозы. Нежелательными явлениями считались снижение объем циркулирующей крови, почечные нарушения, гипогликемия, переломы, потенциальный диабетический кетоацидоз и ампутации.
Исследование DAPA-CKD было прекращено досрочно по рекомендации Комитета по мониторингу данных из-за 408 событий достижения первичной конечной точки (60% запланированных событий).
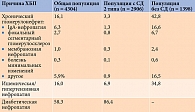
По сообщению исследователей, в общей популяции (n = 4304) наиболее частыми причинами ХБП были диабетическая нефропатия (58,3%), за которой следовали ишемическая/гипертоническая нефропатия (16,0%) и хронический гломерулонефрит (16,1%) (табл. 3). В группе с СД 2 типа (n = 2906) наиболее частой причиной ХБП была диабетическая нефропатия (86,4%). Помимо диабетической нефропатии частыми причинами ХБП были ишемическая/гипертензивная нефропатия (6,9%) и хронический гломерулонефрит (3,3%, из них 1,3% приходились на IgA-нефропатию). В группе без СД 2 типа (n = 1398) среди частых причин ХБП указаны хронический гломерулонефрит – 42,8%, из них 16,6% IgA-нефропатия, и ишемическая/гипертензивная нефропатия – 34,8%. Причина ХБП считалась неизвестной у 11,9% пациентов без СД 2 типа [46].
Анализ результатов исследования показал снижение риска достижения первичной комбинированной конечной точки при приеме дапаглифлозина по сравнению с применением плацебо на 39% – 197 против 312 событий (ОР 0,61 (95% ДИ 0,51–0,72); р = 0,000000028), вторичной почечной комбинированной конечной точки на 44% – 142 против 243 событий (ОР 0,56 (95% ДИ 0,45–0,68); р = 0,000000018). На фоне терапии дапаглифлозином наблюдалось снижение риска поисковой конечной точки на 34% – 71 против 103 событий (ОР 0,66 (95% ДИ 0,49–0,90); p = 0,0072), комбинированной конечной точки на 29% – 100 против 138 (ОР 0,71 (95% ДИ 0,55–0,92); p = 0,0089). При применении дапаглифлозина по сравнению с приемом плацебо отмечалось снижение риска смерти от всех причин на 31% – 101 против 146 случаев (ОР 0,69 (95% ДИ 0,53–0,88); p = 0,0035) [47].
Дапаглифлозин продемонстрировал хороший профиль переносимости. Так, прием плацебо прекращали чаще, чем использование дапаглифлозина, – 309 против 274 случаев, в том числе из-за нежелательных явлений – 123 против 118 случаев. Любые нежелательные явления регистрировались в 729 против 633 случаев соответственно.
Развития кетоацидоза на фоне приема дапаглифлозина не зарегистрировано.
Гипогликемия в группе плацебо зафиксирована в 1,3% случаев, в группе дапаглифлозина – в 0,7%.
В группах плацебо и дапаглифлозина нежелательные явления со стороны почек зафиксированы у 8,7 и 7,2% пациентов соответственно, ампутации – у 1,8 и 1,6%.
Обращает внимание большая частота встречаемости снижения объема циркулирующей крови, а также серьезных нежелательных явлений снижения объема циркулирующей крови у принимавших дапаглифлозин – 127 (5,9%) против 90 (4,2%) и 22 (1,0%) против 18 (0,8%) соответственно. Можно предположить, что пациенты недостаточно принимали жидкость в период лечения. Поэтому в рутинной клинической практике следует делать акцент на необходимости употребления достаточного количества жидкости при приеме иНГЛТ-2.
В группе дапаглифлозина в отличие от группы плацебо также выявлен повышенный риск переломов – 85 (4,0%) против 69 (3,2%) [47].
Таким образом, дапаглифлозин обладает мощным ренопротективным действием и рекомендован для применения у взрослых (старше 18 лет) пациентов с СД 2 типа в дополнение к диете и физическим упражнениям. Он может назначаться в виде монотерапии при непереносимости метформина или в виде комбинированной терапии с метформином, производными сульфонилмочевины (в том числе в комбинации с метформином), тиазолидиндионами, ингибиторами дипептидилпептидазы 4 (в том числе в комбинации с метформином), агонистом рецепторов глюкагоноподобного полипептида 1 эксенатидом пролонгированного действия в комбинации с метформином, препаратами инсулина (в том числе в комбинации с одним или двумя гипогликемическими препаратами для перорального применения) в отсутствие адекватного гликемического контроля на данной терапии, стартовой комбинированной терапии с метформином для улучшения гликемического контроля.
Дапаглифлозин является единственным зарегистрированным на территории Российской Федерации препаратом из группы иНГЛТ-2 с показанием к применению при ХБП у взрослых пациентов с вероятностью ее прогрессирования для уменьшения риска устойчивого снижения рСКФ, наступления терминальной стадии, смерти от сердечно-сосудистого заболевания и госпитализации по поводу сердечной недостаточности [48].
Дапаглифлозин (препарат Форсига) обладает кардиопротективным эффектом, поэтому рекомендован больным СД 2 типа с установленным сердечно-сосудистым заболеванием или двумя и более факторами риска (возраст у мужчин ≥ 55 лет, у женщин ≥ 60 лет и не менее одного из таких факторов, как дислипидемия, артериальная гипертензия, курение) для снижения риска госпитализации по поводу сердечной недостаточности. Взрослым пациентам без диабета при хронической сердечной недостаточности второго – четвертого функционального класса по классификации Нью-Йоркской кардиологической ассоциации со сниженной фракцией выброса препарат показан для снижения риска сердечно-сосудистой смерти и госпитализации по поводу сердечной недостаточности.
Дапаглифлозин необходимо рекомендовать с целью нефро- и кардиопротекции вне зависимости от уровня гликемии [41, 42].
A.M. Mkrtumyan, MD, PhD, Prof., A.N. Oranskaya, PhD
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Ashot M. Mkrtumyan, vagrashot@mail.ru
The prevalence of carbohydrate metabolism disorders among the adult population of the planet has exceeded 1 bln people, of which 537 mln have overt diabetes mellitus and 541 mln have prediabetes.
Health care costs associated with diabetes have increased by 316% over the past 15 years, approaching $1 trln. With 81% of adults with diabetes living in low- and middle-income countries.
Despite the developed criteria for diagnosing and treating diabetes, the death rate in 2021 was 6.7 mln.
Most patients, already at the time of diagnosis of type 2 diabetes, have micro- and macrovascular complications, polyneuropathy, which eventually lead to disability and premature death. Chronic kidney disease (CKD) is recognized as one of the most common microvascular complications of diabetes mellitus. According to world statistics, 40% of patients with type 2 diabetes have CKD and only 10–15% of patients with CKD are aware of their disease.
Dapagliflozin has early and comprehensive cardio-renal protection in a broad patient population. The drug was effective in reducing the risk of a sustained decline in estimated glomerular filtration rate, the onset of end-stage renal failure, death from cardiovascular disease, and hospitalization for heart failure.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.