Глюкофаж в настоящем и будущем
- Аннотация
- Статья
- Ссылки



Необходимо учитывать другие немаловажные свойства препаратов, а именно: влияние на сердечно-сосудистую систему, риск развития макрососудистых осложнений и прогрессирование атеросклероза, поскольку именно эти осложнения во многом определяют продолжительность жизни больных сахарным диабетом типа 2 (СД 2). Обеспечение желаемого длительного контроля за глюкозой во многом затруднено из-за прогрессирующего ухудшения функции β-клеток. В связи с этим большего внимания заслуживают препараты, сохраняющие свойства и функцию β-клеток. Комплексная оценка пользы и безопасности сахароснижающего препарата определяет индивидуальный патофизиологический подход в лечении СД. В большинстве обсуждаемых и уже принятых стандартов лечения СД 2 в качестве первого и основного препарата используется метформин.
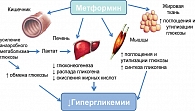
Метформин был введен в клиническую практику для лечения СД 2 в 1957 г. в Европе и в 1995 г. в США. В настоящее время метформин является наиболее часто назначаемым оральным сахароснижающим препаратом в Европе, США и других странах. Механизм антигипергликемического действия метформина достаточно хорошо изучен [2]. В многочисленных исследованиях установлено, что метформин не влияет на секрецию инсулина β-клеткой, а оказывает экстрапанкреатическое действие (рис. 1). Он вызывает:
- снижение всасывания углеводов в кишечнике;
- повышение превращения глюкозы в лактат в ЖКТ;
- усиление связывания инсулина с рецепторами;
- повышение экспрессии гена транспортера глюкозы (ГЛЮТ-1);
- усиление транспорта глюкозы через мембрану в мышцах;
- перемещение (транслокацию) ГЛЮТ-1 и ГЛЮТ-4 из плазменной мембраны к поверхностной мембране в мышцах;
- снижение глюконеогенеза;
- снижение гликогенолиза;
- снижение уровня триглицеридов и липопротеинов низкой плотности;
- повышенное содержание липопротеинов высокой плотности.
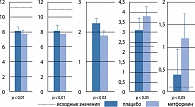
Основной механизм действия метформина направлен на преодоление резистентности периферических тканей к действию инсулина, в особенности это касается мышечной и печеночной ткани. Опубликован ряд клинических исследований с разным дизайном, подтвердивших действие метформина на метаболизм глюкозы печени [3]. Результаты двойного слепого рандомизированного перекрестного исследования представлены на рис. 2.
В данном исследовании получена достоверная разница между группами, доказывающая подавление продукции глюкозы печенью при добавлении метформина.
Прием 1000–2550 мг метформина в сутки в течение нескольких месяцев [2, 4] снижал базальный уровень продукции глюкозы печенью на 9–30% по сравнению с исходными данными и плацебо, что тесно коррелировало со снижением уровня глюкозы плазмы натощак. В присутствии инсулина метформин также увеличивает периферическую утилизацию глюкозы мышцами, активируя тирозинкиназу инсулинового рецептора и транслокацию ГЛЮТ-4 и ГЛЮТ-1 в мышечной и жировой тканях. Метформин улучшает анаэробное окисление глюкозы, что сопровождается повышением постпрандиального уровня молочной кислоты, усиливает синтез гликогена в скелетных мышцах. Метформин повышает утилизацию глюкозы кишечником (усиливая анаэробный гликолиз), что проявляется в снижении уровня глюкозы в крови, оттекающей от кишечника.
Длительное применение метформина положительно влияет на липидный обмен: приводит к снижению уровня триглицеридов, общего холестерина, холестерина липопротеидов низкой плотности в сыворотке крови [5].
Клинические эффекты метформина, помимо его антигипергликемических свойств, достаточно хорошо изучены. Впервые они были представлены после завершения многолетнего исследования UKPDS (United Kingdom Prospective Diabetes Study) в 1998 г. [6, 7]. В исследовании UKPDS при изучении эффективности метформина в лечении СД типа 2 использовался препарат Глюкофаж. Средняя суточная доза препарата для большинства пациентов составляла 2000 мг. Именно при такой дозировке препарата наблюдалось максимальное снижение уровня HbA1 c (на 2%), причем количество побочных эффектов со стороны желудочно-кишечного тракта было не выше, чем при дозе 500 мг/сут.
Были сделаны следующие основные выводы. Терапия метформином у тучных лиц снижает:
- риск сосудистых осложнений 32%;
- смертность от диабета 42%;
- общую смертность 36%;
- инфаркта миокарда 39% Эти данные были настолько убедительны, что метформин был полностью реабилитирован как безопасный и полезный сахаропонижающий препарат.
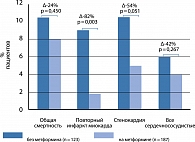
В дальнейшем были доказаны многочисленные кардиопротективные свойства метформина (рис. 3). Полагают, что именно наличием этих свойств объясняется дополнительный позитивный и профилактический эффект метформина при СД 2.
Полученные в последующие годы данные подтвердили влияние метформина на сердечно-сосудистую систему. Так, лечение метформином, в сравнении с любым другим лечением, было ассоциировано с более низкой частотой развития инфаркта миокарда, стенокардии или любого случая кардиоваскулярного проявления, а также смертностью от всех причин [8] (рис. 4).
В ретроспективном популяционном исследовании применение метформина (изолированно или в сочетании с препаратами сульфонилмочевины) сопровождалось снижением риска смерти по сравнению с применением препаратов сульфонилмочевины [9]. В течение среднего срока наблюдения (5,1 года) смертность среди больных, получавших препараты сульфонилмочевины, метформин или их комбинацию и не получавших инсулин, составила 24,7%, 13,8% и 13,6% соответственно.
Результаты UKPDS показали, что Глюкофаж обладает антигипергликемическим действием, аналогичным по эффективности действию производных сульфонилмочевины, не вызывая при этом увеличения массы тела. Монотерапия Глюкофажем позволила снизить уровень HbA1 c в среднем на 1,4% в течение 29 недель [10]. В ряде рандомизированных контролируемых исследований был продемонстрирован дозозависимый эффект препарата. Увеличение суточной дозировки Глюкофажа приводило к усилению сахароснижающего эффекта [11]. Среднеэффективной дозой считается 2000 мг/сут., максимально допустимой – 3000 мг/сут.
Основные выводы исследований последнего десятилетия: Глюкофаж (метформин) обладает прямыми ангиопротекторными эффектами, которые не зависят от сахароснижающего действия препарата. Эти эффекты уникальны. Двойное действие Глюкофажа объясняет результаты по снижению смертности, которые были получены в UKPDS.
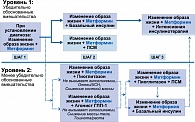
С 2005 г. в рекомендациях Международной диабетической федерации (International Diabetes Federation – IDF) метформин является препаратом первого выбора для лечения СД 2 [12]. С 2006 года в рамках согласованного алгоритма Американской (ADA) и Европейской ассоциации по изучению сахарного диабета (EASD) назначение метформина показано сразу при постановке диагноза СД 2 одновременно с изменением образа жизни (рис. 5) [13].
На представленном рисунке мы видим, что метформин присутствует при всех вариантах терапии. В связи с этим целесообразно рассмотреть вопрос о показаниях и противопоказаниях к использованию метформина, исходя из имеющихся современных данных.
Во‑первых, необходимо ответить на вопрос, почему лечение метформином следует начинать прямо с момента установления диагноза, одновременно с мерами по изменению образа жизни? Потому, что у большинства лиц с СД2 мероприятия по изменению образа жизни не приводят к достижению или поддержанию целевых уровней гликемии, что может быть связано со следующими причинами:
- неэффективность мер по снижению массы тела;
- повторный набор массы тела;
- прогрессирование заболевания;
- сочетание указанных факторов.
Помимо того, что у части больных отмечается непереносимость препарата (по данным разных авторов, от 10 до 20%), имеются и четкие противопоказания к назначению метформина.
Противопоказания к приему метформина (рис. 6):
- острые или хронические заболевания, которые могут вызывать тканевую гипоксию (например, сердечная или легочная недостаточность, инфаркт миокарда, шок);
- печеночная недостаточность, острая алкогольная интоксикация, алкоголизм;
- почечная недостаточность или нарушение функции почек (клиренс креатинина < 60 мл/мин.);
- острые состояния, которые могут нарушить функцию почек (обезвоживание, острая инфекция, шок, внутрисосудистое введение рентгеноконтрастных средств);
- лактация, диабетический кетоацидоз, диабетическая прекома, повышенная чувствительность к метформину или его компонентам [14].
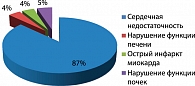
Частота противопоказаний к назначению метформина по данным разных авторов существенно отличается. Так, по данным A.M. Emsley-Smith, D.I. Boyle, J.M. Evance, F. Sullivan, A.D. Morris [15], представленным на рисунке 7, хроническая сердечная недостаточность составляет 87%.
Одной из главных причин опасения при назначении метформина является риск развития лактатацидоза при наличии любых состояний, сопровождающихся гипоксией. Лактатацидоз является очень редким, но потенциально смертельным осложнением. Частота его составляет, по данным разных авторов, 3 случая на 100000 пациентов‑лет, леченных метформином.
Лактатацидоз клинически очень опасен. Исследование, проведенное Stacpool P.W. c соавторами [16], было выполнено путем обследования и лечения 126 пациентов, помещенных в отделения интенсивной терапии, имевших уровень лактата ≥ 5 ммоль/л, в артериальной крови РН ≥ 7,35 или дефицит оснований > 6 ммоль/л. При госпитализации у 80% этих больных диагностирован циркуляторный шок. Сепсис, печеночная недостаточность и заболевания органов дыхания были главными факторами, приведшими к развитию лактатацидоза. Выживаемость через 24 часа составила 59%, через 3 дня –
41% и 17% через 30 дней.
По-прежнему важным и активно обсуждаемым остается вопрос о возможности применения метформина при хронической сердечной недостаточности (ХСН). К настоящему времени накоплен достаточно большой опыт, свидетельствующий о пользе использования метформина при лечении пациентов с СД 2 и ХСН. Было проведено исследование [17], целью которого являлась оценка взаимосвязи между приемом метформина и клиническими исходами у пациентов с ХСН и СД 2. Было обследовано 12272 больных СД 2, получавших сахароснижающие препараты, среди них было выявлено 1833 пациента с ХСН. Монотерапию метформином получали 208 пациентов, производные сульфонилмочевины – 773 и комбинированную терапию – 852 человека. Средний возраст больных составил 72 года. ХСН была впервые диагностирована при госпитализации, то есть в начале исследования. Длительность наблюдения составила 9 лет (1991–1999 гг.). Количество летальных исходов в группе, получавших производные сульфонилмочевины – 404 (52%), метформин – 69 (33%), комбинированную терапию – 263 случая (31%). Смертность от всех причин спустя 1 год составила у лиц, получавших производные сульфонилмочевины, 200 чел. (26%); у лиц, получавших метформин – 29 чел. (14%); на комбинированной терапии – 97 чел. (11%). Был сделан вывод о том, что метформин как в виде монотерапии, так и в составе комбинированной терапии связан с более низкой смертностью и заболеваемостью у пациентов с ХСН и СД 2 по сравнению с производными сульфонилмочевины.
В британское исследование 2010 г. [18] были включены 8404 пациента с впервые выявленным СД 2 и впервые выявленной СН (период с 1988 по 2007 г). Проводился сравнительный анализ причин смерти в двух группах (по 1633 случая смерти в каждой). Был сделан вывод, что использование метформина ассоциировано с более низким риском смертности по сравнению с другими антидиабетическими препаратами. Эти данные согласуются с предшествующими работами, в которых было показано, что у лиц с ХСН при использовании метформина отмечался более низкий риск смерти, чем у лиц, использовавших другие антидиабетические препараты.
Противоопухолевый эффект метформина
Еще одним важным и весьма перспективным направлением в изучении свойств метформина является его антионкогенный эффект. Опубликован ряд клинических исследований, в которых было показано снижение роста онкологических заболеваний среди пациентов, применяющих Метформин.
Bowker S. L. с соавт. опубликовали результаты популяционного ретроспективного когортного исследования с использованием базы данных штата Саскачеван, Канада, 1995–2006 гг. [19]. Целью исследования было изучение взаимосвязи смертности от рака с антидиабетической терапией при СД 2. Обследовали 10309 пациентов с СД 2 с впервые назначенными метформином, производными сульфонилмочевины (ПСМ) и инсулином. Средний возраст больных составил 63,4 ± 13,3 года, из них 55% составили мужчины. Метформин назначен 1229 больным в виде монотерапии, ПСМ –3340 больным в виде монотерапии, комбинированная терапия – 5740, 1443 – добавлен инсулин. Длительность наблюдения – 5,4 ± 1,9 года.
Всего смертность от рака составила 4,9% (162 из 3340) у лиц, получавших СА; 3,5% (245 из 6969) – метформин и 5,8% (84 из 1443) – инсулин. Данные, представленные Bowker, демонстрируют двукратное увеличение частоты возникновения онкологических заболеваний в группе пациентов на инсулинотерапии относительно группы метформина 1,9 (95% ДИ 1,5–2,4, p < 0,0001). В группе пациентов, находящихся на терапии препаратами ПСМ, риск возникновения раковых опухолей был также значительно выше показателей в группе метформина и составлял 1,3 (95% ДИ 1,1–1,6, p = 0,012) [19].
Currie C.J c соавторами [20] также изучали риск развития злокачественных образований у больных СД 2 в зависимости от вида проводимой терапии. В исследование было включено 62809 пациентов с СД 2 старше 40 лет, которые были разделены на четыре терапевтические группы: монотерапия метформином или ПСМ, комбинированная терапия метформином и ПСМ, и инсулинотерапия. Группа пациентов, получающих инсулин, была разделена на подклассы: монотерапия инсулином гларгин, НПХ инсулином, двухфазным инсулином и его аналогами. Также оценивались данные о манифестации или прогрессировании за период лечения (инсулинотерапия с 2000 г.) любых злокачественных образований; отдельное внимание уделялось раку молочной железы, толстого кишечника, поджелудочной и предстательной желез.
При анализе полученных данных было выявлено, что в группе пациентов, получающих метформин, отмечалось значительное снижение риска развития рака толстого кишечника и поджелудочной железы (однако подобной закономерности не наблюдалось относительно рака предстательной и молочной желез). Редуцирование роста злокачественных клеток на фоне монотерапии метформином составило 0,54 (95% ДИ 0,43–0,66). Даже в случае добавления к любой сахароснижающей терапии метформина риск малигнизации снижался до 0,54 (95% ДИ 0,43–0,66). Были сделаны следующие выводы.
- Монотерапия метформином была связана с наименьшим риском развития рака. Для сравнения, относительный риск (ОР) составили:
- для Метформина + ПСМ – 1,08;
- для монотерапии ПСМ – 1,36;
- при применении инсулина– 1,42;
- добавление Метформина к инсулину– 0,54.
- По сравнению с метформином инсулинотерапия повышала риск колоректального рака (ОР 1,69) и рака поджелудочной железы (ОР 4,63);
- Инсулинотерапия не влияла на риски рака простаты и молочной железы.
Одним из последних опубликованных исследований является исследование ZODIAC-16 (Zwolle Outpatient Diabetes project Integrating Available Care), завершенное в Нидерландах и опубликованное в 2010 г. [21]. Целью исследования являлось изучение ассоциации между специфическим лечением СД 2 и смертностью от рака. В данном случае изучали ассоциацию между использованием метформина и смертностью от рака в проспективной когорте. Набор пациентов проводился с 1998 по 1999 г. Было включено 1353 пациента с СД 2. Исследование завершено в 2009 г. Характеристика пациентов:
- на Метформине – 289;
- без метформина – 1064;
- средний возраст 67,8 ± 11,7 лет;
- длительность СД – 6,0 лет;
- ИМТ – 28,9 ± 4,8 кг/м²;
- HbA1 c – 7,5 ± 1,2%;
- CКФ – 73,9 ± 28,1 мл/мин.;
- инсулинотерапия – 16,5%;
- СА – 55,0%;
- диета (только) – 13,0%;
- исключены лица с активными формами рака, когнитивными расстройствами и очень маленькой предполагаемой продолжительностью жизни.
При оценке через 9,6 года умерло всего 570 пациентов (42%). Из них 122 (21%) умерли от рака, среди них 26 (21%) от рака легких, 21 (17%) от рака абдоминальной локализации. 238 больных (41%) умерли от сердечно-сосудистых заболеваний. Причины смерти 541 (94%) больного известны. У пациентов, получавших метформин, в сравнении с пациентами, не получавшими метформина, ОР смертности от рака составил 0,43 (95% CL 0,23–0,80). ОР повышался при увеличении дозы метформина – при добавлении каждого грамма метформина ОР был 0,58 (0,95% CL 0,36–0,93).
Безусловный интерес представляют исследования российских ученых, в которых бигуаниды, наряду с гиполипидемическими препаратами и диетой назначались на длительный срок более чем 300 больным раком молочной железы и толстой кишки, подвергавшимся оперативному лечению. В итоге к 3–7 годам наблюдения было обнаружено повышение кумулятивной выживаемости, а также некоторое уменьшение частоты выявления первично-множественных опухолей и метахронных опухолей второй молочной железы [22].
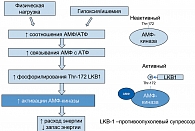
Очевидный противоопухолевый эффект метформина скорее всего связан с активацией циклической аденозин-монофосфатзависимой протеинкиназы (АМФК (AMP-activated protein kinase)), которая контролирует обмен глюкозы и липидов. АМФК активирует путь АМФ\АТФ, играющий ключевую роль в энергетическом клеточном балансе за счет увеличения уровня АТФ. Активацию АМФК в здоровой клетке вызывают различные метаболические процессы, такие как гипоксия, гипогликемия, оксидативный и гиперосмолярный стресс, что позволяет считать активацию АМФК адаптивным процессом, сохраняющим энергетические запасы в клетке. АМФК – это гетеротримерный белок, состоящий в отсутствии цАМФ из каталитической α- и регуляторных β- и γ-единиц (рис. 8).
Известно, что многие метаболические эффекты метформина осуществляются в присутствии АМФК, в том числе ингибирование mTOR (mammalian target of rapamycin) с последующим восстановлением чувствительности клеток к инсулину и снижением гиперинсулинемии как фактора развития опухолей.
mTOR-киназы относятся к семейству фосфатидилинозитолкиназ (PIKK), их С-конец похож на каталитическую область фосфатидилинозитол-3‑киназ (PI3 K), а N-конец связывает комплекс FKBP12 (рапамицин). Многочисленные работы показали, что mTOR играет ключевую роль в клеточном росте и энергетическом метаболизме клетки. Кроме того, mTOR регулирует многие аспекты клеточного метаболизма, в том числе биосинтез аминокислот, гомеостаз глюкозы, а также жировой обмен, играя существенную роль в адипогенезе и накоплении липидов. Таким образом, mTOR-киназа объединяет клеточные сигналы от факторов роста, питания и скорости метаболизма для регуляции синтеза белка и роста клеток.
Использование рапамицина, ин- гибитора mTOR и его производных при лечении некоторых онкологических заболеваний показало положительный эффект.
В ходе проведения исследования среди больных раком предстательной железы были получены данные о наличии сильного антипролиферативного эффекта метформина. В данном случае воздействие препарата было связано в большей степени с замораживанием клеточного цикла на фазе G0\G1 и подавлением уровня циклина D1, то есть с угнетением клеточной пролиферации.
Активность фермента АМФК регулирует важный с биохимической точки зрения белок LKB1, известный как супрессор опухолевого роста. Утрата функции способствует формированию доброкачественных опухолей гамартом и некоторых типов рака легких и толстого кишечника. Для большинства таких опухолей характерны высокие уровни нерегулируемой активности белка mTOR. Механизм LKB1/АМФК обеспечивает молекулярную взаимосвязь между СД и раком. Метформин активизирует АМФК и воздействует на LKB1‑зависимый туморогенез.
Применение метформина при неалкогольной жировой болезни печени (НАЖБП)
Одним из актуальных направлений в изучении возможностей иного использования метформина являются работы, связанные с возможностью лечения неалкогольной жировой болезни печени (НАЖБП). Неалкогольная жировая болезнь печени – это распространенное хроническое заболевание печени, характеризующееся патологическим накоплением жировых капель, не связанное с употреблением алкоголя. НАЖБП является компонентом метаболического синдрома, СД 2, ожирения. НАЖБП в литературе обозначается разными названиями: неалкогольная болезнь Лаэннека, гепатит «жирной печени», диабетический гепатит, алкоголь-подобное заболевание печени, неалкогольный стеатогепатит. Стеатогепатит представляет собой стадию в развитии неалкогольной жировой болезни печени.
Диагноз НАЖБП ставится на основании бессимптомного повышения уровней аминотрансфераз, необъяснимого существования постоянной гепатомегалии, которая подтверждается при радиологическом исследовании, при условии исключения всех других причин, приводящих к гепатомегалии (алкоголь, лекарства, недостаток белкового питания, ядовитые грибы, органические растворители и др.)
Единственным достоверным ди-агностическим критерием является биопсия печени. Именно отсутствием доступных неинвазивных методов диагностики объясняется небольшое количество работ, посвященных изучению патогенеза и эффективности лечения НАЖБП. Течение НАЖБП может быть доброкачественным и злокачественным. Во втором случае отмечается исход в цирроз и печеночную недостаточность или в гепатоцеллюлярную карциному.
Проведенное пилотное исследование показало, что метформин не оказывает отрицательного влияния на состояние печени при неалкогольном стеатогепатите [23]. Больные с неал-когольным стеатогепатитом, не страдающие СД типа 2, но имеющие периферическую инсулинорезистентность, были разделены на 2 группы путем рандомизации. Всем больным в качестве лечебного питания была рекомендована диета, богатая овощами, фруктами, с низким содержанием насыщенных жирных кислот и холестерина, снижение веса и дозированная физическая нагрузка. Больным первой группы был назначен метформин 1000 мг/сут. в течение 12 мес. Результаты гистологического анализа ткани печени не выявили различий в группах больных с неалкогольным стеатогепатитом, получавших метформин и без него. При этом в обеих группах отмечалось достоверное значимое снижение уровня печеночных трансаминаз (ALT, AST) и улучшение состояния клеток печени.
В заключение необходимо подвести итог той огромной работе, которая уже выполнена и представить перспективы, которые для метформина могут быть определены сегодня (таб. 1).
В ближайшее время в клинической практике в России появится новая лекарственная форма Метформина – ГЛЮКОФАЖ ®ЛОНГ (рис. 9).
Данная форма препарата продленного действия предназначена для преодоления таких побочных действий, как расстройства функции желудочно-кишечного тракта, упрощения схемы приема препарата для лиц пожилого возраста, для повышения комплаентности и сохранения эффективности проводимого лечения. Данный препарат уже с успехом применяется в европейских странах и включен в качестве стартовой терапии в клинические рекомендации ряда стран. Препарат прошел испытания в международных многоцентровых исследованиях и доказал свою эффективность и безопасность.
Глюкофаж – единственный из антидиабетических препаратов, который прошел клинические испытания и утвержден к применению у детей старше 10 лет, страдающих СД типа 2. Разрешенная доза препарата составляет 1000–2000 мг/сут.
Доказанная эффективность в лечении и профилактике сахарного диабета, уменьшение неблагоприятных кардиоваскулярных исходов на фоне терапии, относительная безопасность метформина даже при использовании высоких доз, невысокая стоимость препарата – все это делает метформин препаратом первого выбора в лечении СД типа 2.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.