Должны ли препараты сульфонилмочевины остаться? Возможности гликлазида МВ
- Аннотация
- Статья
- Ссылки
- English
В статье подробно рассматривается один из препаратов данной группы – гликлазид МВ. Его отличает высокая селективность в отношении бета-клеток, обратимость взаимодействия с рецептором, антиоксидантные свойства и, как следствие, наименьший риск гипогликемических состояний. Представлены доказательства его кардиоваскулярной безопасности и нефропротективного действия при длительном применении.
Гликлазид МВ не только возможно, но и необходимо использовать на ранних этапах лечения больных сахарным диабетом 2 типа.
В статье подробно рассматривается один из препаратов данной группы – гликлазид МВ. Его отличает высокая селективность в отношении бета-клеток, обратимость взаимодействия с рецептором, антиоксидантные свойства и, как следствие, наименьший риск гипогликемических состояний. Представлены доказательства его кардиоваскулярной безопасности и нефропротективного действия при длительном применении.
Гликлазид МВ не только возможно, но и необходимо использовать на ранних этапах лечения больных сахарным диабетом 2 типа.
Сахарный диабет (СД) – тяжелое, хроническое и прогрессирующее заболевание.
Развитие СД 2 типа связано с неуклонным снижением функции бета-клеток. Так, в пятилетнем исследовании с применением клемп-метода изменение углеводного обмена (от нормальной толерантности к глюкозе до развития СД 2 типа) коррелировало со снижением секреции инсулина [1]. Среди причин нарушения секреторной способности бета-клеток выделяют генетическую предрасположенность, наличие глюкозо- и липотоксичности, нарушение эмбриогенеза.
Неблагоприятный прогноз у пациентов с СД 2 типа обусловлен развитием микро- и макрососудистых осложнений. Результаты многочисленных проспективных исследований свидетельствуют, что основную роль в их развитии играет гипергликемия. Именно хроническая гипергликемия является мощным индуктором окислительного стресса, продукции и активации ростовых факторов, в том числе факторов роста фибробластов, клеток иммунной системы, приводит к изменениям сосудистой стенки, инициации атеросклероза, тромбообразования.
Частота развития микрососудистых осложнений напрямую зависит от длительности заболевания. Однако, по результатам исследования NATION, более половины страдающих СД 2 типа [2] не знают о наличии у себя заболевания. При этом среднее значение гликированного гемоглобина (HbA1c) в данной когорте составляет 7,9%. Это во многом объясняет, что определенный процент пациентов с СД 2 типа на момент постановки диагноза уже имеет те или иные осложнения.
Согласно данным Государственного регистра больных сахарным диабетом, при СД 2 типа длительностью менее пяти лет микроальбуминурия, как маркер диабетической нефропатии, выявляется в 32,4% случаев, протеинурия – в 5,0%. Это гораздо чаще, чем при СД 1 типа такой же продолжительности [3]. При увеличении длительности заболевания от пяти до девяти лет распространенность микроальбуминурии повышается до 37,6%, от 15 до 20 лет – до 43,1%.
Частота встречаемости микроальбуминурии также возрастает при неудовлетворительном контроле углеводного обмена и артериального давления. Отмечается постепенный рост протеинурии. Через 20 лет ее распространенность достигает 17,3%.
В исследовании UKPDS при дебюте СД 2 типа первый признак диабетической ретинопатии – появление микроаневризм отмечался у 39% мужчин и 35% женщин [4], более серьезные изменения – интраретинальные микрососудистые аномалии и мягкие экссудаты – у 8% мужчин и 4% женщин. Многочисленные исследования свидетельствуют об эффективности скрининга, ранней профилактики микрососудистых осложнений именно на начальных стадиях, до появления тяжелых морфологических изменений [5, 6].
Результаты исследования DCCT, в которое были включены больные с впервые выявленным СД 1 типа [7], продемонстрировали, что строгий и постоянный контроль гликемии (средний уровень HbA1c ~ 7,0% в течение 6,5 года) – основа профилактики прогрессирования микрососудистых осложнений. Согласно результатам исследования UKPDS (длительность около 20 лет) тактика интенсивного контроля гликемии (снижение уровня HbA1c с 7,9 до 7,0%) приводит к уменьшению риска развития любого осложнения или смерти, связанных с СД, на 12% (р = 0,029), микроангиопатий на 25% (р = 0,0099), инфаркта миокарда на 16% (р = 0,052), экстракции катаракты на 24% (р = 0,046), ретинопатии в течение 12 лет на 21% (р = 0,015), альбуминурии в течение 12 лет на 33% (р = 0,000054).
Если важность интенсивного контроля с достижением показателей гликемии, максимально приближенных к нормальным, для первичной и вторичной профилактики микрососудистых осложнений доказана во многих исследованиях, то для макрососудистых – вопрос по-прежнему обсуждается.
Интерес также представляет феномен метаболической памяти [8, 9], под которой понимают сохранение эффекта предшествующего гликемического контроля (хорошего или неудовлетворительного) в отношении развития и прогрессирования сосудистых осложнений. Так, продолжавшееся с 1997 по 2007 г. наблюдение за пациентами исследования UKPDS показало, что преимущества строгого гликемического контроля, достигнутые в первой части исследования, со временем утрачиваются. Суммированные данные о 1525 пациентах продемонстрировали, что через десять лет уровень общей смертности достигает 44%, ведущими ее причинами являются сердечно-сосудистые (51,5%) и онкологические (24,2%) заболевания. Однако хороший контроль гликемии в первые годы заболевания сохранял свою значимость. В группе интенсивного контроля отмечены более низкая смертность и меньшее количество как микро-, так и макрососудистых осложнений. Так, у пациентов из группы интенсивного контроля даже спустя десять лет после завершения рандомизированной контролируемой части исследования отмечалось снижение риска смерти от любых причин на 13% (р = 0,007), связанных с СД любых исходов на 9% (р = 0,04), инфаркта миокарда на 15% (р = 0,01) и микроангиопатий на 24% (р = 0,04).
В настоящее время для лечения СД 2 типа помимо инсулина применяются восемь классов сахароснижающих препаратов, разработаны международные и национальные алгоритмы по инициации и стратификации терапии. Однако адекватного гликемического контроля удается достичь только у 30–40% пациентов.
По данным Государственного регистра больных сахарным диабетом, последние годы отмечается тенденция к улучшению показателей углеводного обмена: доля пациентов с уровнем НbА1с < 7,0% достигла 52,1%, уменьшилось количество лиц с выраженной декомпенсацией СД (НbА1с > 9,0 и ≤ 22,1%). Однако экстраполяция этих данных на общую популяцию больных невозможна, так как рассматриваемый показатель исследуется и вводится в регистр только для 29,3% пациентов [10].
Таким образом, несмотря на появление новых классов гипогликемизирующих препаратов, эффективность контроля уровня глюкозы в крови остается одной из главных целей терапии.
Взаимодействие производных сульфонилмочевины с сигнальными путями циклического аденозинмонофосфата в процессе секреции инсулина
С 1950-х гг. производные сульфонилмочевины (ПСМ) широко используются во всем мире для лечения больных СД 2 типа. Согласно международным рекомендациям они являются препаратами первой или второй линии вследствие эффективности, хорошей переносимости и доступности.
Сахароснижающий эффект ПСМ обусловлен стимуляцией секреции инсулина. Известно, что нарушение секреции инсулина – одно из основных звеньев патогенеза СД 2 типа.
ПСМ эффективны только тогда, когда есть достаточное количество функционально активных бета-клеток поджелудочной железы. Их стимулирующее влияние на секрецию и высвобождение инсулина усиливается в присутствии глюкозы.
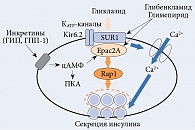
Препараты сульфонилмочевины связываются с АТФ-чувствительными калиевыми каналами (КATP-каналы) на поверхности бета-клеток с помощью рецептора сульфонилмочевины (SUR) и закрывают КATP-каналы.
КATP-канал представляет собой октамерный комплекс, включающий SUR-субъединицы (SUR1 или SUR2) и Kir6.х-субъединицы, формирующие пору для переноса ионов калия (Kir6.1 или Kir6.2). Через изменение мембранного потенциала КATP-каналы участвуют в регуляции обменных процессов в разных клетках и тканях. Речь, в частности, идет о бета-клетках, сердечной и скелетной мышечной тканях, гладкомышечной ткани сосудов, тканях мозга. КATP-каналы обладают тканевой специфичностью – в зависимости от структуры и молекулярной массы составляющих их субъединиц. В стенке сосудов КATP-каналы участвуют в регуляции мышечного тонуса, в коронарных артериях – в вазодилатации в ответ на ишемию. КATP-каналы (Kir6.2/SUR1) гипоталамуса задействованы в регуляции секреции глюкагона в ответ на гипогликемию, а также продукции глюкозы печенью.
Препараты инкретиновой группы также оказывают влияние на секрецию инсулина, однако в большей степени оно носит глюкозозависимый характер [11–13]. Так, ингибиторы дипептидилпептидазы 4 (ДПП-4) способствуют увеличению секреции глюкагоноподобного пептида 1 (ГПП-1), вырабатываемого L-клетками подвздошной кишки в ответ на поступление пищи. ГПП-1 и глюкозозависимый инсулинотропный полипептид (ГИП) усиливают стимулированную глюкозой секрецию инсулина через активацию сигнального пути циклического аденозинмонофосфата (цАМФ) в бета-клетках поджелудочной железы. При этом существует два механизма повышения секреции инсулина: зависящий от протеинкиназы А (ПКА) и не зависящий от ПКА, который включает цАМФ-связыващий белок Epac2А. Epac2A напрямую активируется цАМФ. Данный белок участвует в обмене гуаниновых нуклеотидов и необходим цАМФ для усиления стимуляции первой фазы секреции инсулина.
Установлено, что Epac2A является одной из мишеней ПСМ и для индуцированной ими секреции инсулина необходима активация сигнального пути Epac2A/Rap1.
Таким образом, Epac2A – мишень как для сигнального пути инкретинов/цАМФ, так и для ПСМ.
В клинических условиях для достижения контроля СД 2 типа часто используют комбинированную терапию, в частности препаратами инкретинов и ПСМ. Однако в ряде случаев такое лечение приводит к развитию гипогликемических состояний.
Одновременное назначение препарата, воздействующего на инкретины, и ПСМ усиливает секрецию инсулина (рис. 1). Экспериментальные данные и результаты клинических наблюдений позволили понять, почему активация сигнальных путей инкретинов ингибиторами ДПП-4 усиливает индуцированную ПСМ секрецию инсулина бета-клетками поджелудочной железы, причем даже у пациентов с вторичной резистентностью к ПСМ.
Гликлазид в отличие от глибенкламида и глимепирида не взаимодействует с Epac2A. Как следствие, риск гипогликемических состояний при комбинации гликлазида с препаратами инкретиновой группы снижается.
Нарушение секреции инсулина – одно из патогенетических звеньев СД 2 типа, поэтому применение препаратов, влияющих на его секрецию, является необходимым условием эффективной терапии.
Риск гипогликемий
Гипогликемии – основной нежелательный эффект терапии ПСМ. Гликемии, несомненно, представляют реальную опасность для пациентов, особенно пожилого возраста. Однако данные о частоте их встречаемости у пациентов с СД 2 типа немногочисленны.
Для оценки распространенности гипогликемических состояний при лечении ПСМ проведен метаанализ 25 рандомизированных клинических исследований продолжительностью ≥ 12 недель [14].
Всего в работу было включено 6000 пациентов с СД 2 типа, получавших ПСМ и метформин. Большая часть участников не испытывали гипогликемических состояний. Легкие гипогликемии отмечены у 10% больных, значимые у 0,8%. Реже всего эпизоды гипогликемии фиксировались при приеме гликлазида.
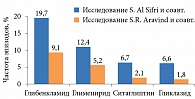
Результаты исследований, проведенных в период Рамадана (повышенный риск гипогликемий), свидетельствуют, что применение гликлазида МВ связано с очень низким риском эпизодов гипогликемии по сравнению с использованием глибенкламида и глимепирида. В группах гликлазида МВ и ингибиторов ДПП-4 симптоматические гипогликемии отмечались с одинаковой частотой (рис. 2) [15, 16]. Достоверной разницы не получено.
Добавление гликлазида (по сравнению с добавлением глибенкламида) в схему лечения пациентов, получавших метформин, ассоциировалось с достоверно меньшими рисками как обращений в больницу по поводу гипогликемии, так и смерти от любой причины [17].
Низкий риск гипогликемий на фоне терапии гликлазидом по сравнению с приемом других ПСМ может быть обусловлен высокой обратимостью его связывания с SUR1 на бета-клетках, что сопровождается уменьшением чрезмерной стимуляции поджелудочной железы.
В исследованиях с использованием клэмп-метода установлено, что гликлазид МВ повышает чувствительность бета-клеток к стимуляции глюкозой и восстанавливает физиологически важный ранний пик секреции инсулина [18].
Для молекулы гликлазида характерна высокая селективность в отношении КATP-каналов поджелудочной железы. Препарат интактен в отношении кардиомиоцитов и гладкомышечных клеток сосудов. Во многих экспериментальных и клинических работах продемонстрировано, что другие ПСМ – глибенкламид, толбутамид, глимепирид – обладают значительно меньшей селективностью и способны оказывать влияние на кардиомиоциты, нарушая процессы ишемического прекондиционирования [19]. Физиологический смысл заключается в том, что в результате повторяющихся кратковременных эпизодов сублетальной ишемии, чередующихся с периодами реперфузии, включаются механизмы защиты от инфаркта. Важную роль при этом играют именно КATP-каналы. Блокада КATP-каналов препаратами может стать пагубной для миокарда в состоянии ишемии вследствие подавления ишемической предподготовки. Глибенкламид и толбутамид упраздняют кардиопротективный эффект ишемической предподготовки, поскольку способствуют закрытию калиевых каналов [20].
Обратимость взаимодействия с рецептором сульфонилмочевины и высокая селективность в отношении бета-клетки, скорее всего, связаны с особенностью строения молекулы гликлазида МВ. В ней отсутствует бензамидная группа, которая обеспечивает связывание других ПСМ с рецепторами миокарда. Еще одна особенность молекулы – наличие азотсодержащего гетероциклического кольца с эндоциклической связью. Предполагают, что оно может нейтрализовать свободные радикалы. Этим объясняется способность гликлазида уменьшать окислительный стресс.
Сердечно-сосудистые и нефропротективные эффекты
Данные о сердечно-сосудистых эффектах ПСМ противоречивы. В ретроспективном когортном исследовании применение больших доз ПСМ ассоциировалось с высоким риском развития застойной сердечной недостаточности по сравнению с использованием больших доз метформина [21].
Однако разные представители ПСМ продемонстрировали различное действие на сердечно-сосудистую систему.
N. Katakami и соавт. [22] изучали способность ПСМ или их комбинации с метформином предотвращать развитие атеросклероза, в частности влиять на такой суррогатный маркер, как толщина комплекса «интима – медиа» (ТКИМ). Участников исследования разделили на три группы: группа глибенкламида (n = 59), группа гликлазида (n = 30) и группа «глибенкламид + метформин» (n = 29). Период наблюдения составил три года.
Применение гликлазида достоверно значимо замедляло прогрессивное увеличение ТКИМ по сравнению с использованием глибенкламида.
Было также показано, что гликлазид снижает окислительный стресс и таким образом защищает эндотелиальные клетки от индуцированного глюкозой апоптоза.
M. Corgnali и соавт. оценивали влияние отрицательной метаболической памяти (гипергликемии на начальных этапах исследования) на функцию и апоптоз эндотелиальных клеток и способность гликлазида воздействовать на данные изменения [23]. Эндотелиальные клетки пупочной вены человека инкубировали в течение 21 дня в среде с нормальным уровнем глюкозы (5 ммоль/л), с высоким уровнем глюкозы (30 ммоль/л) или высоким уровнем глюкозы в течение 14 дней, затем в среде с нормальным уровнем глюкозы еще семь дней.
Гликлазид (10 мкмоль/л) и глибенкламид (1 мкмоль/л) добавляли в культуральную среду рано (в первые 14 дней), позднее (в последние семь дней) или во время исследования.
Изучали параметры окислительного стресса и апоптоза эндотелиальных клеток.
В условиях гипергликемии увеличивалось количество активных форм кислорода, 8-OHdG, нитротирозина, каспазы 3. Эти отрицательные изменения сохранялись и после нормализации гликемии.
Применение гликлазида в разные периоды исследования ассоциировалось с улучшением всех изучаемых показателей. В то же время глибенкламид не оказывал на них существенного влияния.
Был сделан вывод: гликлазид способен предотвращать апоптоз эндотелиальных клеток за счет снижения окислительного стресса, в том числе при наличии отрицательной метаболической памяти.
Анализ Датского национального регистра (6448 пациентов с СД 2 типа и перенесенным инфарктом миокарда) показал, что среди препаратов ПСМ только гликлазид МВ снижает сердечно-сосудистую смертность на 13% (p = 0,40) – при сопоставлении с метформином, выбранным в качестве референтного препарата [24].
Принимая во внимание, что глибенкламид взаимодействует с КATP-каналами как в сердце, так и в поджелудочной железе, тогда как гликлазид более селективен в отношении бета-клеток, предположили, что риск острого коронарного синдрома (ОКС) будет выше у пациентов, получавших глибенкламид. Для подтверждения гипотезы проанализировали данные Канадского национального регистра [25]. В анализ было включено 21 325 пациентов с СД 2 типа: 13 884 получали глибенкламид и 7441 – гликлазид. Средний возраст участников был 75,5 ± 6,6 года. Период наблюдения – 5,5 года.
Основную группу составили 4239 пациентов, госпитализированных или умерших от ОКС. Группу контроля – остальные больные. Прием глибенкламида по сравнению с использованием гликлазида ассоциировался с более высоким риском госпитализации или смерти от ОКС (ОР 1,14 при 95%-ном доверительном интервале 1,06–1,23).
Убедительным доказательством сердечно-сосудистой безопасности гликлазида МВ при длительном применении являются результаты исследования ADVANCE-ON [26, 27]. По его окончании еще в течение пяти лет продолжалось наблюдение врачами общей практики за пациентами как группы контроля, так и группы интенсивного лечения. Применение гликлазида МВ в течение десяти лет у пациентов с исходной длительностью заболевания около восьми лет не только было безопасным, но и не приводило к увеличению неблагоприятных макрососудистых событий.
В рандомизированном исследовании ADVANCE интенсивный гликемический контроль с постепенным достижением уровня HbA1c 6,5% был безопасен для пациентов с высоким сердечно-сосудистым риском.
Кроме того, была доказана важность интенсивного контроля гликемии для профилактики и прогрессирования диабетической нефропатии. По сравнению со стандартной терапией риск впервые возникшей микроальбуминурии и макроальбуминурии снизился на 9 и 30% соответственно, а частота развития терминальной стадии почечной недостаточности – на 65%. Через пять лет наблюдения после ухудшения показателей гликемии частота развития терминальной стадии хронической почечной недостаточности в группе интенсивного контроля оставалась достоверно ниже, чем в группе обычного контроля, – на 46%.
Таким образом, интенсивный гликемический контроль является основой профилактики микрососудистых осложнений.
Успешная реализация данной стратегии в дебюте заболевания позволяет сделать вывод о надежности первичной профилактики и на более поздних этапах заболевания, возможности снизить темпы прогрессирования осложнений и развития терминальных форм, особенно диабетической нефропатии.
Заключение
Гликлазид МВ существенно отличается от других представителей ПСМ. Он обладает высокой селективностью к бета-клеткам, обратимостью взаимодействия с рецептором сульфонилмочевины. Кроме того, препарат оказывает антиоксидантное действие. Как следствие, – наименьший риск гипогликемических состояний, сердечно-сосудистые и нефропротективные эффекты.
Доказательная база, полученная в исследованиях, позволила экспертам Всемирной организации здравоохранения в 2013 г. рекомендовать гликлазид для включения в перечень жизненно необходимых и важнейших лекарственных средств для использования у пожилых пациентов с СД 2 типа.
Подтвержденные нефропротективные свойства и сердечно-сосудистая безопасность позволяют рассмотреть целесообразность назначения гликлазида МВ уже в дебюте заболевания, при сохранной функции бета-клеток.
Вопрос о влиянии препаратов на прогрессирующее снижение функции бета-клеток остается открытым. Активно изучаются процессы и механизмы регенерации бета-клеток, участие в этом процессе иммунной системы, влияние симпатической и парасимпатической регуляции, эффектов глюкозы и липотоксичности [28].
Трудно определить, какую именно роль в снижении не только функции, но и массы бета-клеток играют сахароснижающие препараты. Не только ПСМ и глиниды, но и ингибиторы ДПП-4 и агонисты рецепторов ГПП-1 реализуют свое сахароснижающее действие через усиление секреции инсулина, то есть являются секретогенами.
В экспериментальных исследованиях отмечено влияние ГПП-1 на рост и дифференцировку бета-клеток, однако клинических данных, подтверждающих преимущество инкретинов в отношении протективного действия на бета-клетку, пока не получено.
Специфическая защита бета-клеток, оказываемая гликлазидом МВ, продемонстрирована на культуре клеток на основании отсутствия апоптоза бета-клеток в условиях гипергликемии при добавлении в среду гликлазида [29]. Добавление глибенкламида и глимепирида не обеспечивало защищу клеток от окислительного стресса и апоптоза, вызванного гиперликемией.
Применение гликлазида МВ наряду с интенсивным контролем позволит снизить риск развития микрососудистых осложнений и сохранить секреторную способность бета-клеток на длительное время.
Гликлазид МВ может быть востребован у лиц пожилого и старческого возраста, если учитывать особенности секреции у них инсулина, низкий риск гипогликемических состояний на фоне такой терапии и высокую вероятность противопоказаний к назначению других сахароснижающих препаратов.
I.V. Kononenko, O.M. Smirnova
National Medical Research Centre for Endocrinology
Contact person: Irina Vladimirovna Kononenko, shakhtarina@bk.ru
In connection with the new classes of hypoglycemic drugs emergence the attitude to sulfonylurea derivatives (PSM) is being revised. The main undesirable side effect of drugs of this class is hypoglycemia. However, PSM significantly differ in their effects.
One of the drugs of this group – glyclazide MV is being discussed in the article in details. It is distinguished by high selectivity in relation to beta-cells, reversibility of interaction with the receptor, antioxidant properties and, as a consequence, the lowest risk of hypoglycemic conditions. Provided the evidence of its cardiovascular safety and renal protection actions in the case of long-term use.
Glyclazide MV is not only possible, but also necessary to be applied in the early stages of patients with type 2 diabetes treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.