Иммуногенность препаратов биологической терапии
- Аннотация
- Статья
- Ссылки
- English
В статье приведены данные о механизмах развития иммуногенности, а также результаты исследований иммуногенности и сывороточной концентрации разных генно-инженерных биологических препаратов.
В статье приведены данные о механизмах развития иммуногенности, а также результаты исследований иммуногенности и сывороточной концентрации разных генно-инженерных биологических препаратов.

Введение
Псориаз – хроническое воспалительное иммуноопосредованное заболевание, которое поражает 0,2–8,5% населения [1] и значительно ухудшает качество жизни пациентов [2]. Исследования иммунопатогенеза псориаза свидетельствуют, что провоспалительный цитокин интерлейкин (ИЛ) 17A, продуцируемый различными подтипами Т-хелперных клеток, а также другими врожденными и адаптивными иммунными клетками, играет ключевую роль в развитии псориаза [3].
Секукинумаб – полностью человеческое моноклональное антитело (мАТ), которое избирательно блокирует ИЛ-17A. Это высокоэффективный препарат для лечения псориаза средней и тяжелой степени, а также псориатического артрита, обеспечивающий устойчивый результат при долгосрочном применении [4]. Препарат обладает благоприятным профилем безопасности: большинство побочных эффектов, зафиксированных в клинических исследованиях, характеризовались как легкие или умеренные [5].
На сегодняшний день зарегистрировано несколько групп генно-инженерных биологических препаратов (ГИБП), отличающихся по структуре и механизму действия. ГИБП, как правило, очень эффективны при иммуноопосредованных заболеваниях, однако до 30% больных псориазом, получавших терапию ингибиторами фактора некроза опухоли альфа (ФНО-альфа), прекращали лечение в течение 12–29 месяцев из-за отсутствия первичной эффективности (первичные «неответчики»), или из-за потери эффективности (вторичные «неответчики»), или из-за их непереносимости (развитие побочных эффектов) [6]. Безусловно, биологические препараты в той или иной степени являются иммуногенными. Иммуногенность зависит от ряда факторов, многие из которых изучены недостаточно [7]. Так, использование ГИБП приводит к выработке антител в ответ на мАТ, которые могут влиять на фармакокинетику лекарственного средства, снижать его эффективность или вызывать развитие нежелательных явлений. Образование анти-мАТ отмечается преимущественно после первого введения в сроки от двух – четырех недель до шести месяцев.
Неэффективность ГИБП при псориазе – один из актуальных вопросов, связанных с использованием препаратов данной группы. При первичной неэффективности в большей степени это может объясняться исходными различиями в преимущественных путях развития псориаза на уровне цитокинового профиля, другими словами, различными генотипами заболевания. Вторичная неэффективность, или ускользание терапевтического эффекта, может развиваться вследствие образования антител к мАТ (иммуногенность препаратов), снижения уровня сывороточного препарата и инактивации рецепторов к препарату [8].
Моноклональные антитела и понятие иммуногенности
Моноклональные антитела – крупные молекулы, разработанные для лечения разных патологий иммунной системы. При обусловленных иммунными нарушениями заболеваниях мАТ способны связываться и с растворимыми мишенями (например, цитокины, в том числе ИЛ-17A), и с рецепторами (например, ИЛ-17Р).
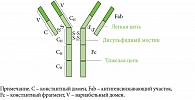
Моноклональные антитела состоят из двойных вариабельных цепей: легкой (например, иммуноглобулины G 1, 2 или 4) и тяжелой (например, каппа или лямбда), формирующих два идентичных антигенсвязывающих участка. Данные цепи соединяются посредством внутренних дисульфидных мостиков (S-S) (рис. 1).
Каждая цепь состоит из складчатых фрагментов, которые называются вариабельным и константным доменами иммуноглобулина. Моноклональные антитела могут связываться со многими потенциальными мишенями при заболеваниях, обусловленных нарушениями иммунной системы (ревматоидный и псориатический артрит, псориаз, красная волчанка, атопический дерматит и др.). Речь, в частности, идет о цитокинах, путях активации или ко-стимуляции, адгезивных молекулах, факторах роста и гликопротеинах. Данные мишени могут быть растворимыми молекулами (например, цитокины плазмы крови или ткани-мишени) или рецепторами, подвергающимися воздействию тех типов клеток, появление которых связано с развитием иммуноопосредованных заболеваний [9].
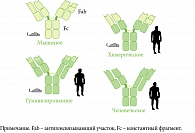
Первые технологии производства были ограничены получением антител грызунов: в 1980-х гг. 80% мАТ получали от мышей. В дальнейшем были разработаны химерические мАТ, которые получали путем комбинирования аминокислотных остатков более одного вида. Химерические мАТ, как правило, содержали аминокислотные остатки вариабельных антигенсвязывающих участков антител мыши (грызуна) и аминокислотные остатки константных фрагментов антител человека. Понимание структуры антитела и преимуществ молекулярной биологии способствовало моделированию гуманизированных и даже полностью человеческих мАТ. При производстве гуманизированных АТ последовательности аминокислот антитела грызуна замещаются последовательностями человека с целью повышения их сходства с последовательностями аминокислот антител человека, после чего модифицированные последовательности пересаживаются на домен антитела человека. Гуманизированные мАТ содержат меньше чужеродных компонентов (гипервариабельные участки (ГВУ) антител грызунов), чем химерические мАТ, однако также могут вызывать реакцию иммуногенности. Для получения полностью человеческих мАТ используют трансгенные мышиные технологии (например, секукинумаб) или банк человеческих фаговых отображений (например, адалимумаб) [10] (рис. 2).
Если антитела грызунов содержат 100% чужеродного белка, то химерические антитела – ≈25% белка грызунов, гуманизированные – от 5 до 10%. Человеческие мАТ содержат 100% человеческого белка, поэтому в наименьшей степени провоцируют иммуногенные реакции. Хотя человеческие антитела являются наименее иммуногенными, даже они могут вызывать образование анти-мАТ.
На сегодняшний день под иммуногенностью понимается способность мАТ провоцировать образование противолекарственных антител (анти-мАТ). Присутствие анти-мАТ можно рассматривать как результат иммунного ответа на лекарственный препарат.
Анти-мАТ способны негативно влиять на эффективность ГИБП за счет связывания активного центра агента, таким образом они напрямую воздействуют на способность мАТ связываться с мишенью. Кроме того, анти-мАТ могут связываться с участками мАТ, отличными от участков, которые обусловливают их терапевтическую активность. За счет этого обеспечивается непрямое воздействие на их терапевтические свойства (в том числе изменение фармакокинетики или конформационные изменения мАТ). Необходимо отметить, что иммуногенность может быть как транзиторной, так и постоянной. Транзиторные АТ обладают низкой аффинностью при связывании с лечебным белком (мАТ), имеют незначительное или нулевое клиническое значение и, как следует из названия, не персистируют постоянно. Персистирующие АТ (долгосрочная иммуногенность) способны влиять на клиническую эффективность мАТ и вызывать серьезные, даже угрожающие жизни побочные реакции [11].
В зависимости от механизма формирования выделяют два типа иммуногенного ответа: образование нейтрализующих и образование ненейтрализующих анти-мАТ. Нейтрализующие анти-мАТ связываются с участками мАТ, отвечающими за связывание цитокина-мишени. Это препятствует нейтрализации цитокина и, как следствие, влияет на терапевтический эффект. Ненейтрализующие анти-мАТ связываются с участками мАТ, не участвующими в связывании цитокина-мишени. Однако они могут влиять на фармакокинетические свойства лечебного антитела, в том числе период его полувыведения [12].
Помимо влияния на эффективность (первичная неэффективность, эффект ускользания) и фармакокинетические свойства иммуногенность ассоциируется с множеством других негативных последствий, включая острые и неострые реакции. При этом у пациентов, у которых регулярно вырабатываются антитела, инфузионные реакции отмечаются реже. Отсроченная гиперчувствительность может быть обусловлена иммунными комплексами, способными накапливаться в тканях. К острым последствиям иммуногенности относятся инфузионные и аллергические реакции, а также анафилаксия. Неострые реакции могут быть представлены отсроченной гиперчувствительностью и аутоиммунными реакциями. Последние – в форме перекрестной реактивности анти-мАТ в отношении эндогенного белка, ведущей к истощению или подавлению физиологической активности данного белка [13].
Существует несколько групп факторов, предрасполагающих к развитию реакции иммуногенности в ответ на введение мАТ [13]:
- пациент-специфические факторы (например, иммунный статус);
- заболевание-специфические факторы (например, коморбидность);
- процесс-специфические факторы (например, примеси при производственном процессе);
- антитела или связанные с мишенью факторы (например, сочетание мАТ, растворимые мишени против рецептора-мишени);
- наличие или отсутствие сопутствующей медикаментозной терапии (например, прием метотрексата).
Помимо иммунного статуса пациента, наличия у него сопутствующих заболеваний, сопутствующей терапии, генетического фона необходимо принимать во внимание историю использования родственных групп биологических препаратов, в частности, в отношении возможности развития перекрестной реактивности с уже имеющимися анти-мАТ, образовавшимися в ответ на проводившуюся ранее терапию. Иммуносупрессивные препараты, такие как метотрексат, могут снижать иммуногенность.
Биологические молекулы обладают сложной структурой, помимо посттрансляционных модификаций последовательностей аминокислот (гликозилирование или формирование дисульфидных мостиков) вся структура биологического препарата может подвергаться конформации и укладке. Отклонения в процессе производства, например изменение рН, температуры, состава клеточной среды, могут повлиять на структуру молекулы и, следовательно, лечебного препарата, что приведет к нестабильности всей серии средства вследствие агрегации. Данный факт необходимо учитывать при регистрации биоаналогов (биосимиляров) на территории стран Евросоюза и Америки. Биоаналоги должны регистрироваться по отдельным правилам, с отдельным торговым наименованием. Кроме того, должны быть представлены результаты проведенных клинических исследований.
Структура антитела (полная длина, фрагменты, слияние), состав/композиция, объем дозы и способ введения также могут влиять на иммуногенность.
Мишень антитела сама по себе может являться фактором риска развития иммуногенности, при этом мАТ к растворимым мишеням (внеклеточное связывание) могут быть менее иммуногенными, чем мАТ к мишеням, расположенным на поверхности клеток (например, рецепторам), особенно если рецептор находится на поверхности антигенпрезентирующих клеток или интернализирован (эндоцитирован) [12, 14].
Исследование иммуногенности и сывороточной концентрации ГИБП
В настоящее время накоплено большое количество данных об иммуногенности и о сывороточной концентрации ГИБП. Наиболее полный системный обзор, в котором проанализирована 21 тыс. публикаций с последующим включением еще 443, был опубликован в 2017 г. [15]. Показатели анти-мАТ широко варьировались у разных биологических агентов и при разных заболеваниях (в обзор включали статьи о применении ГИБП в ревматологии, дерматологии, гастроэнтерологии, иммунологии) и не были сопоставимыми из-за неоднородности иммуноанализа и других методологических особенностей. Однако самые высокие показатели сывороточных анти-мАТ были зарегистрированы при применении инфликсимаба (0–83%), адалимумаба (0–54%) и биосимиляра инфликсимаба CT-P13 (21–52%), самые низкие – секукинумаба (0–1%), устекинумаба (1–11%), этанерцепта (0–13%) и голимумаба (0–19%). Большинство анти-мАТ были нейтрализующими, за исключением относящихся к абатацепту и этанерцепту. Поскольку образование анти-мАТ может увеличить риск потери ответа на терапию, иммуногенность этих препаратов является важным (хотя и не единственным) фактором при решении вопроса об их назначении. Более частые инфузионные реакции были зарегистрированы при использовании инфликсимаба и его биосимиляра CT-P13. Кроме того, был сделан вывод, что фоновые иммунодепрессанты/антипролиферативные препараты (например, метотрексат) уменьшают биологическую иммуногенность при всех заболеваниях.
У ВИЧ-позитивных пациентов анти-мАТ образовывались значительно чаще: у 50% пациентов на фоне применения адалимумаба, инфликсимаба и его биосимиляра CT-P13, у 20% – секукинумаба, устекинумаба, этанерцепта и голимумаба. Следует отметить, что образование анти-мАТ было связано с уменьшением клинической эффективности нескольких ГИБП/биосимиляра, включая адалимумаб, голимумаб, инфликсимаб, ритуксимаб, устекинумаб и биосимиляр CT-P13.
Анализ иммуногенности ГИБП при ревматоидном артрите проведен по результатам проспективного когортного исследования (с февраля 2004 г. по сентябрь 2008 г. плюс период наблюдения, продолжавшийся до сентября 2010 г.). Все участники исследования (n = 272) получали адалимумаб. Только 148/272 (55%) пациентов завершили все его этапы. В течение 156-недельного периода наблюдения антитела к адалимумабу были выявлены у 76 (28%) пациентов. У 67% из них образование антител началось в первые 28 недель терапии. Пациенты с антителами к адалимумабу выбывали из исследования в связи с неэффективностью терапии чаще, чем пациенты без таковых, – 29 (38%) против 28 (14%) соответственно. У 95/196 (48%) лиц без АТ к адалимумабу отмечалась минимальная активность заболевания. Таковая фиксировалась только у 10/76 (13%) пациентов с антителами к адалимумабу. Образование анти-мАТ часто сопровождалось снижением остаточного уровня адалимумаба и отсутствием ответа на проводимую терапию [16, 17].
Еще в одном рандомизированном двойном слепом двухгодичном исследовании фазы III установлено, что у пациентов с псориазом (n = 618) эффективность этанерцепта с учетом ответа на проводимую терапию не зависела от наличия антител к нему. Для оценки использовали индекс тяжести поражения псориазом (Psoriasis Area Severity Index – PASI) и дерматологический индекс качества жизни (Dermatology Life Quality Index – DLQI). Профили анти-мАТ-положительной и анти-мАТ-отрицательной когорт оказались аналогичными. Присутствие антител к этанерцепту не оказывало значительного влияния на безопасность такого лечения. АТ к энатерцепту квалифицировались как ненейтрализующие [18].
Иммуногенность изучалась в многоцентровом двойном слепом исследовании фазы III с участием 378 пациентов, страдавших вульгарным псориазом (от средней степени тяжести до тяжелой). Все больные были распределены в соотношении 4:1 для получения инфузий либо инфликсимаба 5 мг/кг, либо плацебо исходно, на второй и шестой неделях, затем каждую восьмую неделю до 46-й недели исследования. Наличие антител к инфликсимабу оценивалось на 66-й неделе, поддержание ответа на проводимую терапию – в течение 50 недель.
У 56 из 75 пациентов, в отношении которых была доступна информация по исходной постинфузионной концентрации препарата в крови и которым удалось достичь PASI 75 к десятой неделе, отмечалось улучшение по PASI на протяжении 50 недель наблюдения. У больных уже к 30-й неделе срединная прединфузионная концентрация инфликсимаба в сыворотке крови составляла более 1,0 мкг/мл. Указанные значения сохранялись и в последующие недели. У 19 пациентов, у которых ответ на проводимую терапию снизился к 50-й неделе, срединная концентрация инфликсимаба в сыворотке крови составляла менее 1,0 мкг/мл. Оценка фармакокинетических свойств показала, что у пациентов с неопределяемой концентрацией инфликсимаба в сыворотке крови (< 0,1 мкг/мл), включая тех, у кого отмечалось образование антител к инфликсимабу, поддержание ответа на проводимую терапию на уровне PASI 75 было наименее вероятным [19].
Основные данные по иммуногенности и сывороточной концентрации секукинумаба представлены K. Reich и соавт. (2017). Исследователи проанализировали данные шести клинических исследований фазы III с длительностью общего наблюдения до 60 недель (контроль 12, 24, 52, 60 недель) [20]. В шести исследованиях средняя концентрация секукинумаба в сыворотке крови у пациентов составляла ≤ 53,8 мг/мл в течение большей части наблюдения – 24–52 недель. Средние значения концентрации секукинумаба в сыворотке крови на 52-й неделе были выше, чем концентрации секукинумаба в сыворотке до 24-й недели.
Исследование на наличие анти-мАТ к секукинумабу проводилось в три этапа: скрининг, подтверждение и титрование. В трех исследованиях (ERASURE, FIXTURE и SCULPTURE) из шести среди 2842 пациентов, получавших секукинумаб, у 11 (0,4%) были обнаружены анти-мАТ, у трех – нейтрализующие, все, кроме одного пациента, были бионаивными. Связь с дозой или режимом введения препарата не зафиксирована. У десяти пациентов анти-мАТ были обнаружены через 52 недели наблюдения, у одного – через 60. Семь больных получали секукинумаб в дозе 150 мг, четыре – в дозе 300 мг.
В 11 положительных образцах образование анти-мАТ на 52-й и 60-й неделях отмечалось реже, чем на 12-й и 24-й.
Процесс образования анти-мАТ был временным: в течение 52 недель у девяти из десяти пациентов положительный результат зафиксирован в ранние сроки лечения (12-я и 24-я недели), у одного – в поздние (на 52-й неделе). У одного пациента с ранним положительным результатом на 24-й неделе таковой отмечался и на 52-й неделе, пять больных с ранним положительным результатом вернулись к серонегативному состоянию в более поздние сроки лечения. Кроме того, не было доказательств увеличения титра до 52-й недели.
Следует отметить, что ни у одного пациента образование анти-мАТ, в том числе нейтрализующих, не ассоциировалось с потерей эффективности и не требовало пересмотра тактики лечения [20].
Обобщенные данные по иммуногенности ГИБП, зарегистрированных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для лечения псориаза, представлены в таблице. Источники уровней иммуногенности приведены в протоколах клинических исследований или в инструкциях по медицинскому применению препарата [19, 21–25].
Заключение
За время активного использования биологических препаратов медицина совершила значительный прорыв в лечении иммуновоспалительных заболеваний. Биологические препараты представлены Т-клеточным активатором-ингибитором/ко-стимуляционным модулятором, моноклональными антителами против цитокинов и рецепторов к ним. Все они обладают уникальными белковыми структурами и разной способностью индуцировать иммунные реакции.
Результаты рандомизированных контролируемых исследований подтверждают эффективность биологических препаратов при разных иммуноопосредованных заболеваниях. В то же время установлено, что часть пациентов не реагирует или неадекватно реагирует на лечение (первичные «неответчики», парадоксальная реакция), теряет ответ на него (эффект ускользания). У некоторых больных развиваются потенциально ограничивающие терапию побочные эффекты.
Наличие антител к ГИБП было идентифицировано как важный (хотя и не единственный) фактор неэффективности лечения и повышенного риска развития побочных эффектов [26]. Формирование иммунных комплексов может увеличить клиренс и снизить биологические уровни мАТ, оказать прямое нейтрализующее действие.
Моноклональные антитела – белки, созданные для лечения различных иммунопатологий. Так как все мАТ (даже полностью человеческие) являются чужеродными белками, они могут распознаваться иммунной системой и их введение способно вызывать иммуногенные реакции разной степени тяжести. Иммуногенность также может быть связана с функциональным иммунным статусом пациента и коморбидностью, применением сопутствующей терапии, взаимодействием мАТ и терапевтической мишени. Последствия иммуногенности могут варьироваться от полного отсутствия клинических последствий до неуспешности проводимой терапии и серьезных, даже угрожающих жизни состояний (хотя они и редки). Полностью человеческие мАТ относятся к новейшим технологическим разработкам. Таковые ассоциируются с наименьшим риском развития иммуногенной реакции [20, 26].
Отсутствие АТ у «неответчиков» с адекватными концентрациями лекарственного препарата в сыворотке может свидетельствовать о том, что реакции на препарат не было [12, 19]. Таким образом, невосприимчивый пациент без АТ к одному ингибитору ФНО-альфа может быть нечувствителен и к другому препарату данной группы [12, 19].
Оценка сывороточного уровня препарата в большей степени способствует пониманию причин неэффективности терапии, чем определение уровня анти-мАТ. Если у «неответчика» на ГИБП отмечается низкая концентрация лекарственного средства в сыворотке, может быть рассмотрен вопрос о его переводе на другую терапию, если высокая – перевод на другой препарат (с тем же или другим механизмом действия) может быть затруднен.
Кроме того, измерение сывороточного содержания некоторых биологических препаратов в начале лечения позволяет определить долгосрочность результата. Так, у пациентов с тяжелым вульгарным псориазом, получавших лечение адалимумабом или этанерцептом (n = 56) [27], сывороточная концентрация адалимумаба через четыре недели была прогностической в отношении ответа на лечение через шесть месяцев. Однако уровень этанерцепта в сыворотке не был таковым.
Согласно результатам последних исследований, ИЛ-17A играет ключевую роль в патогенезе псориаза. Одним из современных эффективных препаратов для лечения среднетяжелого и тяжелого псориаза является секукинумаб – полностью человеческое моноклональное антитело. Препарат отличается избирательным действием в отношении ИЛ-17А.
В клинических исследованиях фазы III у пациентов с умеренным и тяжелым псориазом секукинумаб продемонстрировал минимальную иммуногенность до 12-й недели (первичная конечная точка) – от 0 до 0,41% [4, 5, 28, 29].
Кроме того, при объединенном анализе результатов исследований фазы III установлено, что секукинумаб поддерживал низкий уровень (0,5%) анти-мАТ в течение двух лет [28].
В прогностическом плане весьма ценными могут быть данные об иммуногенном потенциале моноклонального антитела в условиях in vitro. В то же время приходится констатировать, что многие вопросы, касающиеся чувствительности, стандартизации, до сих пор не решены.
Необходимо отметить, что уже проводятся пилотные исследования потенциальной иммуногенности ГИБП. Так, A. Karle и соавт. (2016) сравнили иммуногенный потенциал секукинумаба и других ГИБП (адалимумаба, инфликсимаба, ритуксимаба, устекинумаба и этанерцепта), используемых при псориазе. Для этого были применены два вида анализа в условиях in vitro: анализ активации Т-клеток и анализ основных антител, связанных с комплексом гистосовместимости II [30]. При проведении первого анализа секукинумаб в целом продемонстрировал очень компактное распределение ответов, при этом у 46 из 50 доноров ответ был ниже, у остальных он лишь немного превышал порог ответа (индекс стимуляции (Stimulation index – SI) 1,9, p < 0,05). Аналогичные результаты получены в отношении этанерцепта и устекинумаба – ответы выше порога SI для этанерцепта у четырех доноров, устекинумаба – у трех. Инфликсимаб, адалимумаб и ритуксимаб продемонстрировали большую вариабельность распределения ответов – 11, десять и семь доноров соответственно с ответами выше порога SI. При оценке результатов второго анализа в отношении секукинумаба также отмечено компактное распределение ответа, причем только у четырех доноров ответ превышал порог SI. Для устекинумаба и этанерцепта значения SI были превышены у четырех и пяти доноров соответственно. Ритуксимаб, напротив, показал переменное распределение ответа, причем у шести доноров он был выше порогового. Для инфликсимаба и адалимумаба таковых было десять и восемь доноров соответственно. В целом количество доноров с положительным ответом при выполнении обоих тестов варьировалось от 6 до 20%: 20% (для инфликсимаба), 14% (для адалимумаба), 10% (для ритуксимаба), 8% (для этанерцепта), 6% (для секукинумаба и устекинумаба).
С учетом всех факторов риска развития иммуногенности линейная корреляция между иммуногенностью в условиях in vitro и клинической иммуногенностью невозможна, однако возможна приблизительная корреляция. На основании зарегистрированной клинической иммуногенности оцениваемые ГИБП можно разделить на две основные группы:
- с низкой иммуногенностью (секукинумаб, устекинумаб и этанерцепт);
- с высокой иммуногенностью (ритуксимаб, адалимумаб и инфликсимаб).
Таким образом, хотя точно предсказать частоту клинической иммуногенности на данном этапе невозможно, полученные результаты для секукинумаба и ряда других ГИБП позволяют предположить приблизительную корреляцию между потенциалом антигенпрезентации in vitro и ответом Т-клеток, наблюдаемым в клинической практике. Дальнейшие исследования, скорее всего, прольют больше света на механизмы, приводящие к иммуногенности, и будут способствовать лучшему пониманию прогностической способности анализов, используемых для ее оценки. В частности, можно сравнить ответы, наблюдаемые в клетках, полученных от здоровых добровольцев и пациентов, которые лечились ГИБП.
L.S. Kruglova, A.A. Khotko
Central State Medical Academy the Department of Affairs of the RF President
Contact person: Larisa Sergeyevna Kruglova, kruglovals@mail.ru
One of the relevant issues of the use of genetically engineered biological drugs is their inefficiency for psoriasis, the causes of which have not been completely researched. To a greater extent, primary inefficiency can be explained by the initial differences in the predominant ways of psoriasis development at the level of cytokine profile, in other words, by different genotypes of the disease. Secondary inefficiency, or slipping therapeutic effect, can be caused by a number of reasons, such as: the formation of antibodies to monoclonal antibodies (immunogenicity of drugs), the decrease in the level of serum drug and inactivation of receptors to the drug.
The article provides data on the mechanisms of immunogenicity development, as well as the results of studies of immunogenicity and serum concentrations of different genetic engineering biological preparations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.