Клинический случай лечения распространенной меланомы вульвы
- Аннотация
- Статья
- Ссылки
- English
После 18 месяцев терапии отмечалось прогрессирование заболевания. Приведенный клинический случай демонстрирует возможности таргетной терапии генерализованной меланомы.
После 18 месяцев терапии отмечалось прогрессирование заболевания. Приведенный клинический случай демонстрирует возможности таргетной терапии генерализованной меланомы.



Актуальность
Злокачественные опухоли женских наружных половых органов не самая распространенная патология. Заболеваемость злокачественными опухолями вульвы в Российской Федерации, по данным различных авторов, в среднем не превышает двух случаев на 100 тыс. населения. В России в 2018 г. выявлено всего 2068 пациенток со злокачественными новообразованиями вульвы. Пик заболеваемости приходился на возраст 75–79 лет. Удельный вес составил 0,61%.
Менее 10% всех злокачественных опухолей наружных половых органов у женщин связано с такими нозологиями, как меланома, саркома, рак из клеток Меркеля, рак бартолиновой железы.
Меланомы женских наружных половых органов локализуются главным образом на вульве и влагалище – 95 и 3% соответственно. Меланома вульвы – второй по распространенности после плоскоклеточного рака тип злокачественных опухолей женских половых органов. На меланому, по данным различных авторов, приходится до 7–10% всех злокачественных новообразований вульвы. Эта локализация встречается у женщин всех возрастов, пик заболеваемости приходится на возраст 70 лет [1, 2]. Более 90% случаев меланомы вульвы регистрируются у светлокожих женщин [2].
Некоторые авторы разделяют меланому вульвы на два отдельных вида – меланому кожи и слизистой оболочки. По локализации меланома распределяется следующим образом: большие половые губы – 5%, малые половые губы – 11%, обе половые губы – 5%, клитор – 26% [3, 4].
Встречаются как пигментные, так и беспигментные формы – 73 и 27% соответственно. Сателлиты отмечаются в 20% наблюдений. Пятилетняя выживаемость при меланоме вульвы всех стадий составляет 21,7–54%.
Факторы, влияющие на прогноз, схожи с факторами при меланоме кожи. Толщина опухоли по Breslow, наличие изъязвления безусловно влияют на прогноз при меланоме вульвы. По данным многих авторов, метастатическое поражение регионарных лимфатических узлов относится к наиболее неблагоприятным прогностическим факторам [5–7].
В исследовании SEER (Surveillance, Epidemiology, and End Results) с участием 644 пациенток общая пятилетняя выживаемость составила 61% [8]. Пожилой возраст, наличие местнораспространенной опухоли, толщина по Breslow, регионарные метастазы являлись независимыми неблагоприятными прогностическими факторами.
Одним из важных факторов, влияющих на выбор терапии распространенной меланомы, считается BRAF-мутация (serine/threonine-protein kinase B-Raf). Частота встречаемости мутации в гене BRAF при меланоме варьируется от 30–40 до 70%. Самой частой разновидностью BRAF-мутации является V600E – замена валина глутамином в 600-м кодоне – до 94% случаев, по данным разных авторов. Реже встречается мутация V600К (5–10%), еще реже мутации V600D и V600R (рис. 1) [9, 10].
В настоящее время таргетная терапия генерализованной меланомы признана наиболее эффективным методом. Зарегистрированы несколько препаратов ингибиторов BRAF/MEK. Препараты этой группы применяются для неоперабельной или метастатической меланомы, содержащей мутации в киназном домене, BRAF V600E и BRAF V600E или V600K [11, 12].
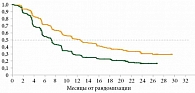
В исследовании BREAK-3 – Тафинлар vs дакарбазин (DTIC) в первой линии терапии метастатической меланомы продемонстрирована эффективность таргетной терапии (рис. 2) [11].
Результаты рандомизированных исследований показали, что двойное ингибирование сигнального пути MAРK, которое достигается при одновременном использовании ингибиторов BRAF и MEK, обладает более высокой эффективностью по сравнению с ингибитором BRAF в монорежиме [13–15].
Исследование COMBI-V (дабрафениб + траметиниб vs монотерапия вемурафенибом) продемонстрировало лучшие результаты в группе комбинированной терапии по сравнению с группой вемурафениба без ингибитора MEK (рис. 3) [16].
Таким образом, ингибиторы киназ BRAF/MEK являются основными компонентами лечения распространенной меланомы при наличии в опухоли мутации в гене BRAF V600. Опухолевый материал, предпочтительно метастатического происхождения, должен быть исследован на наличие мутации BRAF V600 [17–20].
В отсутствие мутации BRAF V600 рекомендуется определение мутаций NRAS, c-KIT (для меланомы слизистой оболочки и акрально-лентигинозной меланомы кожи), GNA11 и GNAQ (для увеальной меланомы).
Цель исследования – проанализировать и описать редкий случай терапии генерализованной меланомы вульвы.
Материал и методы
По данным Республиканского клинического онкологического диспансера МЗ РБ, в период с 2014 по 2019 г. с диагнозом «меланома вульвы» наблюдались семь пациенток. Медиана возраста составила 54,3 года (+13,2–16,5). Стадирование проводилось согласно TNM/AJCC (8-е издание Классификации злокачественных опухолей 2017 г.). Данная система стадирования предназначена для кожных меланом, ведущая прогностическая роль отводится толщине опухоли по Breslow, уровню инвазии по Кларку и изъязвлениям.
Распределение по стадиям было следующим:
- T1AN2M1 – одна пациентка;
- T1BN0M0 – две пациентки;
- T2N0M0 – одна пациентка;
- T2N0M1 – одна пациентка;
- T3N1M0 – две пациентки.
Клиническое наблюдение
Пациентка Х., 59 лет, поступила в отделение оперативной онкогинекологии РКОД МЗ РБ 2 сентября 2017 г. При поступлении – жалобы на наличие опухоли мягких тканей поясничной области. Рост образования в течение шести месяцев. При цитологическом исследовании обнаружен метастаз меланомы.
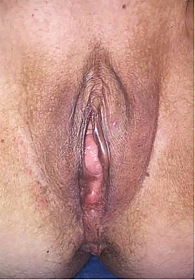
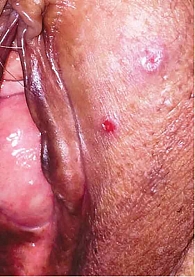
Клинически на момент начала лечения выявлено на вульве, в области левой большой половой губы неправильной формы два опухолевидных образования – 6 и 4 мм (рис. 4 и 5). Результат цитологического исследования – меланома.
В мягких тканях поясничной области на уровне крестца – плотное опухолевидное образование до 5 × 6 см с участками прорастания кожи. В левой паховой области два увеличенных подвижных лимфоузла до 2 см в наибольшем измерении. Цитологически в лимфоузле метастаз меланомы.
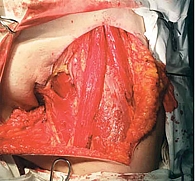
14 сентября 2017 г. под интубационным наркозом проведена комбинированная операция: вульвэктомия, пахово-бедренная лимфаденэктомия слева, широкое иссечение метастатической опухоли мягких тканей поясничной области с пластикой дефекта местными тканями и свободным кожным лоскутом (рис. 6 и 7).
При гистологическом исследовании выявлена меланома вульвы. Метастазы в паховые лимфоузлы, мягкие ткани поясничной области. При ИГХ-исследовании в клетках опухоли установлена экспрессия HMB45, меланина А. Не обнаружена экспрессия р53, виментина, цитокератина 5, EMA, BerEp4. Стадия заболевания по TNM/AJCC – T1AN2M1.
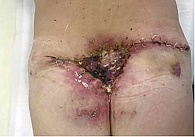
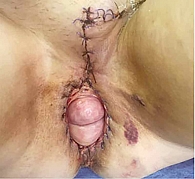
Заживление послеоперационных ран проходило с некоторыми сложностями, рана в поясничной области с вторичным натяжением (рис. 8 и 9).
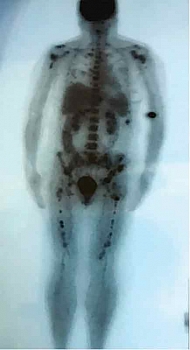
С ноября 2017 г. отмечалось прогрессирование заболевания. При позитронно-эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ КТ)/GE Discovery 610, с использованием РФП 18F – ФДГ, выявлен распространенный процесс (рис. 10).
При молекулярно-генетическом исследовании методом ПЦР с высокоразрешающим плавлением, прямым секвенированием, выполненным на приборах PCR Biorad CFX и ABI 3500, образца опухоли обнаружена активирующая мутация в экзоне гена BRAF типа V600E (c. 1799T>A) (NM_004333). При исследовании полученного образца ДНК не зафиксировано активирующих мутаций в 2-м и 3-м экзонах гена NRAS (NM_002542). Не выявлено также активирующих мутаций в исследуемых экзонах гена KIT (NM_001093772).
Согласно клиническим рекомендациям, в связи с наличием активирующих мутаций BRAF пациентке начата таргетная терапия препаратами дабрафениб 150 мг два раза в сутки, траметиниб 2 мг один раз в сутки.
Эффективность проводимой терапии оценивали методом ПЭТ КТ – GE Discovery 610 с использованием РФП 18F – ФДГ с 12-недельным интервалом.
Безопасность проводимого лечения контролировалась физикальными осмотрами, оценкой клинических анализов (гематологический, биохимический анализы крови, коагулограмма, общий анализ мочи). Осмотр с клиническими анализами проводился один раз в две недели. На ЭКГ в 12 стандартных отведениях оценивался интервал QT. ЭКГ проводилась с четырехнедельным интервалом. Нежелательные явления оценивали по шкале CTCAE (Common Terminology Criteria for Adverse Events), версия 5.0.
Результаты и обсуждение
Во время проводимой терапии комбинацией «дабрафениб и траметиниб» отмечались следующие нежелательные явления: пирексия, слабость, кожная токсичность, гиперкератоз, алопеция, ладонно-подошвенный синдром.
Распределение нежелательных явлений по степени выраженности представлено в таблице.
Зафиксировано два эпизода нежелательных явлений, потребовавших хирургического лечения.
На пятый месяц терапии на коже спины зарегистрирован рост экзофитной опухоли (рис. 11). Опухоль иссечена в пределах здоровых тканей. Морфологически – плоскоклеточный рак.
Аналогичная опухоль кожи нижней трети правой голени удалена на 11-м месяце терапии. Морфологическое заключение идентично предыдущему.
Длина интервала QT на ЭКГ в 12 стандартных отведениях не превышала 480 мс. Фракция выброса левого желудочка на момент начала лечения – 59%. Во время лечения данный показатель не снижался. Клинических признаков кардиотоксичности во время лечения не наблюдалось.
Дважды за период лечения пациентке проводилось офтальмологическое обследование. Офтальмологической токсичности не выявлено.
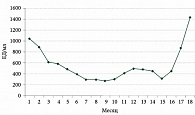
Динамика уровня лактатдегидрогеназы (ЛДГ) на фоне терапии оценивалась ежемесячно. Уровень ЛДГ на момент начала терапии составил 1044 ЕД/мл, отмечался самый низкий уровень на девятом месяце терапии – 275 ЕД/мл, рост с 17-го месяца до 870 ЕД/мл, на момент зарегистрированного прогрессирования – 1428 ЕД/мл (рис. 12).
Нежелательные явления корректировались в соответствии с клиническими рекомендациями. Кожная токсичность купировалась с помощью антигистаминных препаратов и увлажняющих кремов.
При первом эпизоде лихорадки 1-й степени, отмеченном на третьей неделе приема дабрафениба и траметиниба, исключена инфекционная этиология. Длительность эпизода – семь суток. Максимальная температура тела – 38,7 °С. Купировалась на фоне применения парацетамола 500 мг два раза в сутки.
Алопеция 1-й степени и слабость 2-й степени не потребовали медикаментозной коррекции.
За период лечения редукции доз и пропусков приема препаратов не отмечалось.
Прогрессирование заболевания зарегистрировано после 18 месяцев терапии. Данные контрольной ПЭТ КТ: массивное поражение мягких тканей туловища, новые очаги в костях, паренхиматозных и полых органах брюшной полости. По данным фиброгастроскопии, выявлены метастазы меланомы в слизистой оболочке желудка. Результаты морфологического исследования биоптата подтвердили метастатический процесс. Пациентка умерла на фоне генерализации заболевания.
Выводы
Таргетная терапия ингибиторами BRAF-мутации увеличила продолжительность жизни пациентки с диссеминированной меланомой вульвы с мутацией BRAF V600.
K.V. Menshikov, PhD, A.V. Sultanbayev, PhD, A.V. Pushkarev, I.A. Menshikova, PhD, D.O. Lipatov, K.T. Akhmetgareyeva
Bashkir State Medical University
Republican Clinical Oncology Center, Ufa
Contact person: Konstantin V. Menshikov, kmenshikov80@bk.ru
Malignant tumors of female external genitals are rare pathology. Less than 10% of all malignant tumors of the external woman genitals are accounted for melanoma, sarcoma, cancer from Merkel cells, and Bartholin cancer. External genital melanoma is localized on vulva and vagina. Vulvar melanoma is common type of malignant tumor after squamous cancer. By the authors, about 7-10% of cases neoplasms of the vulva are accounted for melanoma. Nowadays target therapy of generalized melanoma is the most successful treatment. BRAF mutation is the one of important factor that can help to choice tactics of treatment. The frequency of mutation in the BRAF gene in melanoma ranges from 30–40% to 70%. BRAF/MEK kinase inhibitors are the main components of the treatment of advanced melanoma in the presence of a mutation in the BRAF V600 gene in the tumor. In this article, we present clinical case of treatment of advanced vulvar melanoma. Patient had got vulvectomy, left inguinal-femoral lymphadenectomy, wide excision of a metastatic tumor of the soft tissues of the lumbar region with plastic defect local tissues and a free skin flap. An activating mutation in the exon of the BRAF gene type V600E was detected. After disease progression, patient was treated by dabrafenib 150 mg. 2 twice daily, trametinib 2 mg. once a day. Disease progression is recorded after 18 months of therapy. This clinical case demonstrates the possibilities of targeted therapy for advanced melanoma.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.