Клиническое значение ключевых компонентов адипо-сердечно-сосудистой оси у пациентов с сахарным диабетом 2 типа и неалкогольной жировой болезнью печени
- Аннотация
- Статья
- Ссылки
- English
Избыток RBP-4 ассоциируется с инсулинорезистентностью, что позволяет признать его лабораторным маркером метаболического синдрома в связи с влиянием на основные дефиниции последнего – висцеральное ожирение, инсулинорезистентность, артериальную гипертензию, дислипидемию.
Выявлена высокая степень корреляции уровня RBP-4 с метаболической функцией короткоцепочечных жирных кислот и свободных жирных кислот. Избыток свободных жирных кислот способствует формированию резистентности к инсулину гепатоцитов и других тканей, что приводит к компенсаторной гиперинсулинемии.
RBP-4 регулирует действие инсулина в скелетных мышцах и печени, влияет на маркеры воспаления – эндотоксин и оксид азота, липопротеин-ассоциированную фосфолипазу А2, которая является липолитическим ферментом, вызывающим модификацию липидов и стимулирующим развитие воспаления.
Степень инсулинорезистентности может быть обусловлена концентрацией продуктов избыточного гликозилирования, в частности повышенным содержанием метилглиоксаля, который характеризует метаболическую память клетки и регулируется RBP-4, вызывает увеличение уровня маркеров воспаления, сопровождается усилением активности печеночных ферментов, тяжестью морфологических изменений гепатоцитов, что негативно сказывается на эффективности сахароснижающих препаратов, метаболизирующихся в печени, а также может вызывать непредсказуемое лекарственное поражение печени, что в свою очередь будет способствовать более тяжелому клиническому течению СД 2 типа и его множественным осложнениям.
Метаболизирующая функция RBP-4, как непосредственная, так и опосредованная, реализуется путем активации процессов хронического, субклинически протекающего системного воспаления, эндотоксин-опосредованным повышением активности липопротеин-ассоциированной фосфолипазы А2, которая также признана независимым фактором риска кардиоваскулярных событий, является прогностическим и диагностическим критерием их осложнений.
Динамическое исследование содержания RBP-4 позволяет осуществлять контроль эффективности сахароснижающих препаратов различных фармакологических групп, а также развития кардиоваскулярных событий и своевременно проводить профилактические мероприятия в их отношении.
Избыток RBP-4 ассоциируется с инсулинорезистентностью, что позволяет признать его лабораторным маркером метаболического синдрома в связи с влиянием на основные дефиниции последнего – висцеральное ожирение, инсулинорезистентность, артериальную гипертензию, дислипидемию.
Выявлена высокая степень корреляции уровня RBP-4 с метаболической функцией короткоцепочечных жирных кислот и свободных жирных кислот. Избыток свободных жирных кислот способствует формированию резистентности к инсулину гепатоцитов и других тканей, что приводит к компенсаторной гиперинсулинемии.
RBP-4 регулирует действие инсулина в скелетных мышцах и печени, влияет на маркеры воспаления – эндотоксин и оксид азота, липопротеин-ассоциированную фосфолипазу А2, которая является липолитическим ферментом, вызывающим модификацию липидов и стимулирующим развитие воспаления.
Степень инсулинорезистентности может быть обусловлена концентрацией продуктов избыточного гликозилирования, в частности повышенным содержанием метилглиоксаля, который характеризует метаболическую память клетки и регулируется RBP-4, вызывает увеличение уровня маркеров воспаления, сопровождается усилением активности печеночных ферментов, тяжестью морфологических изменений гепатоцитов, что негативно сказывается на эффективности сахароснижающих препаратов, метаболизирующихся в печени, а также может вызывать непредсказуемое лекарственное поражение печени, что в свою очередь будет способствовать более тяжелому клиническому течению СД 2 типа и его множественным осложнениям.
Метаболизирующая функция RBP-4, как непосредственная, так и опосредованная, реализуется путем активации процессов хронического, субклинически протекающего системного воспаления, эндотоксин-опосредованным повышением активности липопротеин-ассоциированной фосфолипазы А2, которая также признана независимым фактором риска кардиоваскулярных событий, является прогностическим и диагностическим критерием их осложнений.
Динамическое исследование содержания RBP-4 позволяет осуществлять контроль эффективности сахароснижающих препаратов различных фармакологических групп, а также развития кардиоваскулярных событий и своевременно проводить профилактические мероприятия в их отношении.

Введение
Согласно данным экспертов Международной федерации диабета (International Diabetes Federation – IDF) и Американской диабетической ассоциации, количество пациентов с сахарным диабетом (СД) за последние десять лет увеличилось более чем в два раза. Столь стремительный рост заболеваемости стал причиной принятия в 2006 г. Организацией Объединенных Наций резолюции о сахарном диабете [1], в 2011 г. – политической декларации [2], призывающей создавать многопрофильные стратегии для профилактики развития неинфекционных заболеваний и борьбы с ними, в частности СД, осложнения которого являются одной из ведущих причин инвалидизации и смерти пациентов [3–5].
В 2017 г. количество больных СД превысило 425 млн [6]. В 2019 г. патология была выявлена уже у 463 млн.
Если в 2017 г. эксперты IDF прогнозировали рост заболеваемости к 2045 г. до 629 млн [6], то в 2019 г. – уже до 700 млн [7].
Установлено, что СД 2 типа связан со значительным риском развития ишемической болезни сердца, хронической сердечной недостаточности, инсульта, артериальной гипертензии, хронической болезни почек, ампутации нижних конечностей, слепоты [8–10]. При постановке диагноза в возрасте 40 лет ожидаемая продолжительность жизни пациентов уменьшается в среднем на 14 лет. При этом более чем у 50% больных причиной смерти являются именно кардиоваскулярные заболевания [11, 12].
Не менее значимо у пациентов с СД 2 типа при выборе сахароснижающей терапии учитывать наличие плейотропного кардиопротективного действия.
Появление ингибиторов натрий-глюкозного котранспортера 2 (НГЛТ-2), механизм действия которых не зависит от функции β-клеток и инсулина, внесло существенный вклад в повышение эффективности лечения СД 2 типа и профилактику кардиоваскулярных рисков у таких больных. Установлено, что снижение чувствительности инсулиновых рецепторов обусловливает развитие инсулинорезистентных форм сахарного диабета и уменьшение числа рецепторов к инсулину, что прежде всего связано с ожирением и эндотоксин-опосредованным хроническим субклинически протекающим воспалением. Именно от жировой массы зависит степень инсулинорезистентности [13–16]. Кроме того, мутации гена, контролирующего чувствительность клеточных рецепторов к липопротеинам низкой плотности, лежат в основе возникновения не только гиперхолестеринемии, но и опосредованно инсулинорезистентности. Эта цепь представляет собой аккордно развивающиеся события у пациентов с метаболическим синдромом и СД 2 типа.
При ожирении нарушаются структура и функция клеточной мембраны, повреждаются сигнальная и транспортная системы, блокируется поступление в клетки глюкозы и жирных кислот, в результате в крови повышается уровень свободных жирных кислот [14–19].
Формирование оксидативного стресса и хронического, субклинически протекающего воспаления сопровождается усиленным образованием метилглиоксаля (метаболита гликолиза), который инициирует реакцию гликозилирования протеинов [8, 19, 20].
При хронической гипергликемии содержание метилглиоксаля значительно повышается [18, 21]. Он взаимодействует с аминогруппами лизина и аргинина, что связано с нарушением передачи инсулинового сигнала, антиоксидантного равновесия, ингибированием ферментов с образованием конечных продуктов гликирования – эндогенных флогогенов, которые вызывают воспаление. Гликирование обусловлено способностью глюкозы образовывать с аминогруппами белков необратимые химические соединения – конечные продукты гликирования. Количество конечных продуктов гликирования прямо пропорционально уровню глюкозы в крови. Конечные продукты гликирования участвуют в экспрессии генов, активируют экспрессию ядерного фактора. Отмечена достоверная положительная корреляция между уровнями метилглиоксаля и гликированного гемоглобина (HbA1c) в крови, который в свою очередь зависит от длительности гипергликемии. При воспалении метилглиоксаль ковалентно связывается с белками, ферментами, липидами, ДНК, нарушая их физиологические функции [22, 23]. Конечные продукты гликирования вызывают повреждение белков в клубочках почек, сетчатке глаза и периферических нервах. Формирование ковалентных связей с четырьмя аминогруппами коллагена является причиной потери эластичности сосудов. Конечные продукты гликирования повреждают почти все типы клеток и вызывают сосудистые осложнения СД.
Как было отмечено ранее, метилглиоксаль – активный дикарбонильный метаболит, который инициирует реакцию гликозилирования протеинов и ковалентно реагирует со многими белками, ферментами, липидами, ДНК и РНК с нарушением их физиологических функций. Глутатион может влиять на химическую активность метилглиоксаля при участии глиоксалаз [24–26]. Необходимо отметить, что существует комплекс ферментов, осуществляющих метаболическую детоксикацию метилглиоксаля с участием тиолсодержащих ферментов: глиоксалазы 1 и глиоксалазы 2. Активация карбонильных протеинов считается начальным этапом апоптоза клеток. Патологические карбонильные формы протеинов образуются под действием метилглиоксаля при циррозе печени, патологии почек, метаболическом синдроме, СД, ожирении [21–23].
В последние годы значительное внимание уделяется роли клеточной рецепции для антигенов в развитии воспалительных заболеваний. Связывание антигенов с рецепторами влечет за собой ускорение процессов метилирования мембранных фосфолипидов (преобразование фосфатидилэтаноламина в фосфатидилхолин), что ведет к снижению микровязкости липидов мембран, ускорению трансмембранного перехода ионов кальция. Это обусловливает активацию фосфолипазы А2 (ФЛА2), в результате чего образуются лизолецитины, резко изменяющие текучесть клеточных мембран и способствующие высвобождению медиаторов воспаления [8–12], приводящих к развитию оксидативного стресса [8, 21] и накоплению свободных радикалов, которые вызывают нарушение кровообращения, усиливают воздействие токсинов на межклеточные контакты эндотелия с развитием эндотелиальной дисфункции. Тканевое повреждение или повреждение эндотелия сосудов увеличивает перекисное окисление липидов. Как следствие, повышается уровень малонового диальдегида в крови. Малоновый диальдегид, конечный продукт перекисного окисления липидов, – обязательный компонент воспалительного процесса любого генеза [21, 25, 26]. Уровень малонового диальдегида в крови напрямую связан с клиническими проявлениями заболевания. Помимо выраженного повреждающего воздействия на клеточные структуры малоновый диальдегид обладает иммунорегуляторными свойствами: повышает численность и функциональную активность лимфоцитов, отвечает за пролиферацию В-лимфоцитов и эозинофилию [25–27].
Причина этих нарушений также может быть связана с нарушением метаболической функции желчных кислот и свободных жирных кислот. Изучение патологии клеточных контактов способствует разработке методов диагностики ряда заболеваний, поиску фармакологических средств, способных изменять состояние межклеточных взаимодействий. В описанном каскаде патогенетических событий важная роль принадлежит липопротеин-ассоциированной фосфолипазе А2.
ФЛА2 – липолитический фермент, вызывающий модификацию липидов и стимулирующий развитие воспаления. ФЛА2 гидролизует окисленный фосфатидилхолин с образованием окисленной жирной кислоты и лизофосфатидилхолина (лизо-ФХ), который играет ключевую роль в атерогенезе. Лизо-ФХ резко изменяет текучесть мембран, стимулирует образование активных форм кислорода клетками эндотелия, изменяет активность синтазы оксида азота (NO), количество оксида азота или снижает его биодоступность [27–29]. ФЛА2 является маркером воспалительной реакции при кардиоваскулярном риске, специфичным в отношении сосудистого воспаления. При попадании в кровоток ФЛА2 связывается и транспортируется с атерогенными частицами липопротеинов низкой плотности [20, 21].
Важно подчеркнуть, что ФЛА2 синтезируется в печени и очерчивает гепатопанкреатическую ось в развитии СД 2 типа. Наиболее выраженная патогенетическая связь обнаружена у пациентов с неалкогольной жировой болезнью печени (НАЖБП) на фоне СД 2 типа [21, 23]. В 95% случаев НАЖБП протекает на фоне ожирения и СД 2 типа или нарушения толерантности к глюкозе, артериальной гипертензии и сердечной недостаточности [13, 14, 16, 17, 19, 22, 30–32].
Абдоминальное ожирение приводит к накоплению свободных жирных кислот, которые индуцируют развитие инсулинорезистентности в условиях гипергликемии и гиперинсулинемии. Этот метаболический каскад вызывает воспаление сосудистой стенки с отложением липидов, развитием макрофагальной инфильтрации и образованием пенистых клеток, составляющих основу атеросклеротических бляшек. Гиперсекреция инсулина продолжается до предела компенсаторных возможностей β-клеток поджелудочной железы с последующим их истощением.
Ретинол-связывающий белок 4 (Retinol Binding Protein 4 – RBP-4) является единственным носителем ретинола (спирта витамина А) в крови и служит для его транспортировки из печени в периферические ткани. RBP-4 преимущественно производится гепатоцитами, зрелыми адипоцитами [24, 33] и активированными макрофагами [34] в жировой ткани. Это установленный биомаркер массы жировой ткани, ожирения и хронического субклинического воспаления.
Ассоциация RBP-4 с ожирением изучалась и была распространена на различные, связанные с ожирением метаболические и кардиоваскулярные заболевания [19, 24, 33]. Последние являются основной причиной смерти лиц с ожирением, СД, НАЖБП, метаболическим синдромом. У таких пациентов данный показатель возрастает в пять раз [19, 24]. Несколько адипокинов, секретируемых избыточной массой жировой ткани вместе с инфильтрирующими макрофагами, идентифицированы как ключевые компоненты адипо-сердечно-сосудистой оси, а также патогенеза атеросклероза и других кардиоваскулярных заболеваний [17, 18]. Среди всех адипокинов именно белки семейства липокаина, FABP-4, LCN-2 и RBP-4, были определены как адипокины, связанные с ожирением, СД 2 типа, метаболическим синдромом и НАЖБП.
FABP-4 – липид-связывающий шапероновый белок для жирных кислот. Он является одним из белков, секретируемых зрелыми адипоцитами [23], а также макрофагами [22]. В эпидемиологических исследованиях в разных этнических группах отмечена тесная связь между уровнем FABP-4 в сыворотке крови и группой кардиометаболических факторов риска, связанных с ожирением [20, 35–38]. В частности, уровень FABP-4 в плазме положительно коррелировал со степенью эндотелиальной дисфункции [17], коронарного атеросклероза [18] и различных кардиоваскулярных заболеваний [15, 31, 38, 39]. Значения FABP-4 были значительно выше у пациентов с ожирением и СД 2 типа, НАЖБП и кардиоваскулярной патологией, чем у не страдавших ожирением, но имевших СД 2 типа.
Показатели LCN-2 были выше у пациентов с кардиоваскулярными заболеваниями, однако разница между группами не достигла статистической значимости (p = 0,46).
LCN-2 представляет собой гликопротеин с молекулярной массой 25 кДа. Он обильно выделяется жировыми клетками и, следовательно, повышен в условиях ожирения и СД 2 типа [16, 27]. В клинических исследованиях продемонстрированы его провоспалительные свойства и участие в связанных с ожирением метаболических аномалиях, в том числе НАЖБП [8, 16, 27, 29].
В настоящее время известно, что жировая ткань является не просто пассивным хранилищем энергетического материала. Это активный эндокринный и паракринный орган, который вырабатывает большое количество биологически активных соединений, влияющих на кардиоваскулярную систему [4, 11]. Так, у пациентов с кардиоваскулярной патологией уровень RBP-4 в сыворотке крови оказался значительно выше, чем в любой другой группе.
Повышение уровня RBP-4 в сыворотке крови приводит к системной инсулинорезистентности, тогда как снижение – усиливает действие инсулина. Таким образом, RBP-4 вносит свой вклад в патогенез СД 2 типа, поэтому снижение его концентрации может стать новой стратегией в таргетной терапии заболевания.
Определение уровня RBP-4 в сыворотке крови может быть полезным для понимания нарушения метаболизма, при артериальной гипертензии и ожирении в том числе [1–5, 12].
Американские ученые из медицинской школы Гарварда пришли к выводу, что уровень RBP-4, продуцируемого адипоцитами, позволяет определить риск и возможность прогрессирования инсулинорезистентности, СД 2 типа и некоторых кардиоваскулярных заболеваний [13, 20]. Изучение дополнительных факторов риска и маркеров неблагоприятного прогноза у данной категории пациентов представляется чрезвычайно важным для ранней диагностики кардиоваскулярных событий и их адекватной медикаментозной и немедикаментозной коррекции [14, 20].
Изучение маркеров неблагоприятного прогноза у пациентов с СД 2 типа и НАЖБП
Цель и задачи исследования
Целью настоящей работы стало уточнение роли RBP-4 в оценке клинического течения СД 2 типа и кардиометаболических рисков, его прогностической ценности у пациентов с СД 2 типа и НАЖБП в зависимости от стадии (стеатоз или стеатогепатит).
Установлено, что повышенный уровень RBP-4 напрямую связан с возрастом, индексом массы тела (ИМТ), длительностью артериальной гипертензии и повышенным уровнем мочевой кислоты. Только у лиц с повышенным уровнем RBP-4 в анамнезе отмечено наличие острого нарушения мозгового кровообращения и других кардиоваскулярных событий. В ряде исследований уровень RBP-4 сопоставлялся с клиническим течением СД, в частности с достижением целевых уровней HbA1c.
Известно, что СД 2 типа в 76% случаев сопровождается ожирением, что, по мнению экспертов, приводит к увеличению риска кардиоваскулярной смерти в четыре раза и смерти в результате онкологических заболеваний в два раза [17, 18]. Накопление жировой ткани ассоциируется с активацией липолиза, высвобождением свободных жирных кислот, которые снижают утилизацию глюкозы в печени, вызывают ее жировую инфильтрацию с развитием инсулинорезистентности и компенсаторной гиперинсулинемией. Последняя активирует симпатическую нервную систему, способствуя развитию сосудистого спазма, пролиферации гладкомышечных клеток и гипертрофии сосудистой стенки, задержке натрия, снижению почечного кровотока и активации ренин-ангиотензин-альдостероновой системы. Кроме того, при ожирении увеличивается продукция адипоцитами ангиотензиногена с последующим образованием ангиотензина I и его конверсией в ангиотензин II – мощный вазоконстриктор, способствующий развитию артериальной гипертензии [23, 25, 37].
В исследовании были поставлены следующие задачи.
- Определить содержание RBP-4 у больных СД 2 типа и оценить его в качестве маркера таких метаболических нарушений, как инсулинорезистентность, хроническое системное воспаление, ожирение и НАЖБП в стадии стеатоза и стеатогепатита (НАСГ).
- Определить содержание инсулина и метилглиоксаля в сыворотке крови страдающих ожирением, СД и НАЖБП.
- Оценить возможность использования уровня метилглиоксаля (кетоальдегид пировиноградной кислоты) в качестве маркера глюкозотоксичности и накопления конечных продуктов гликирования [23, 24, 25, 40, 41].
- Изучить роль ФЛА2 в формировании системного воспаления у больных СД и НАЖБП, а также возможные его корреляционные связи с RBP-4.
Недавно идентифицирован рецептор клеточной поверхности RBP-4, который угнетает экспрессию белка-переносчика глюкозы – глюкозного транспортера 4 и приводит к инсулинорезистентности, эндотелиальной дисфункции. При повышении RBP-4 отмечена положительная корреляция со степенью выраженности воспаления и фиброза.
Кроме того, предстояло определить связь фосфолипазной активности с медиаторами биологической реакции воспаления – NO. Оксид азота, образующийся в ходе NO-синтазной реакции, обладает высокой проникающей способностью. Попадая в гладкомышечные клетки, он приводит к вазодилатации.
Оксид азота регулирует сосудистый тонус и микроциркуляцию, а также участвует в регуляции синтеза инсулина. Инсулин в свою очередь через протеинкиназу стимулирует высвобождение эндотелиального NO и тем самым тормозит пролиферацию коллагена. Гликирование синтазы NO у больных СД 2 типа может приводить к уменьшению ее активности и развитию осложнений диабета, нарушению чувствительности рецепторов к инсулину. В виде транспортной формы NO выступает нитроальбумин, который переносит NO от стенки сосуда к эритроцитам, где и депонируется [27, 29, 38]. NO – важнейший фактор сосудистого гомеостаза, поддерживающий необходимый уровень микроциркуляции, а также регулирующий сосудистый тонус, апоптоз и пролиферацию эндотелиальных клеток [19, 27, 29, 34, 42–44].
Оксид азота синтезируется из атома L-аргинина синтазой оксида азота. Кроме того, NO является важным фактором регуляции печеночного кровотока [27, 29, 36]. При нарушении внутрипеченочного кровотока развивается фиброз. NO тормозит пролиферацию коллагена, являясь противофиброзной молекулой. Продукты неферментативного гликозилирования белков крови, накапливающиеся при гипергликемии, связывают NO и препятствуют функционированию механизмов ауторегуляции кровотока [19]. Сахарный диабет сопровождается нарушением функции эндотелия, что проявляется снижением синтеза оксида азота [33].
Активация синтазы оксида азота наблюдается при кардиоваскулярной патологии, злокачественных новообразованиях, острых и хронических воспалениях. Макрофаги синтезируют оксид азота и уничтожают опухолевые клетки. Помимо вазодилататорного эффекта NO регулирует секрецию инсулина.
Материал и методы
Обследовано 208 пациентов с НАЖБП и нарушениями углеводного обмена, из них с СД 2 типа 76 пациентов, с нарушенной толерантностью к глюкозе – 132. Индекс массы тела больных составил 34,85 ± 1,79 кг/м2.
Средний возраст участников – 57,3 ± 5,2 года.
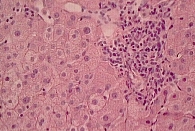
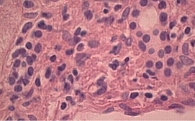
Диагноз верифицирован клиническими, биохимическими, инструментальными и морфологическими методами. Основные морфологические изменения печени у больных СД 2 типа отличались от других вариантов НАЖБП. При анализе биохимических показателей в 40% случаев отмечено повышение уровней аминотрансфераз и γ-глутамилтрансферазы в три раза. Липидный спектр характеризовался увеличением уровня общего холестерина, холестерина липопротеинов низкой плотности, триглицеридов и уменьшением уровня холестерина липопротеинов высокой плотности. Основные морфологические изменения у обследованных были представлены крупнокапельной жировой инфильтрацией гепатоцитов, при НАСГ – наличием внутридольковых воспалительных инфильтратов, центрилобулярной локализации, матовостекловидных гепатоцитов и оптически пустых ядер, у части больных пролиферацией дуктул (рис. 1 и 2).
Содержание RBP-4 определили у 89 пациентов иммуноферментным методом в сыворотке крови, инсулина – у 74 пациентов методом хемилюминесцентного иммунного анализа на приборе Simensу. Метилглиоксаль оценивали хроматографическим методом [24].
Уровень ФЛА2 исследовали иммуноферментным методом с помощью диагностических наборов PLAC Test Elisa Kit (США). Количество метаболитов оксида азота определяли методом скрининга в биологических жидкостях. Статистическую обработку данных проводили с использованием программ Statistica и BioStat [33].
Результаты и их обсуждение
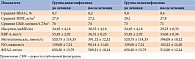
В таблице 1 представлены результаты обследования 74 пациентов с НАЖБП на содержание инсулина в сыворотке крови, из них 40 с СД 2 типа и НАЖБП на стадии стеатоза (p = 0,001 по сравнению с группой контроля), 34 с СД 2 типа и НАЖБП на стадии НАСГ (р = 0,001 по сравнению в группой стеатоза). Контрольную группу составили 16 человек.
У больных СД 2 типа и НАСГ отмечено значительное повышение уровня инсулина, что свидетельствует о развитии гиперинсулинемии в зависимости от степени воспалительных изменений в печени.
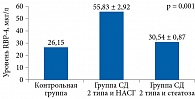
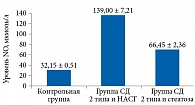
Содержание RBP-4 в сыворотке крови представлено на рис. 3. В контрольной группе (n = 16) уровень RBP-4 составил 26,15 ± 1,31 мкг/л, в группе СД 2 типа и НАСГ (n = 34) – 55,83 ± 2,92 мкг/л (р = 0,001 по сравнению с контрольной группой), в группе СД 2 типа и стеатоза печени (n = 40) – 30,54 ± 0,87 мкг/л (р = 0,001 по сравнению с контрольной группой). Таким образом, RBP-4 достоверно был повышен у больных СД 2 типа и НАЖБП на стадии НАСГ и положительно коррелировал со степенью выраженности воспалительного процесса и фиброза по данным пункционной биопсии печени.
Связывание RBP-4 с инсулиновыми рецепторами гепатоцитов индуцирует экспрессию печеночного глюконеогенного фермента фосфоинозитол-3-киназы, нарушает передачу сигналов инсулина в клетках и уменьшает стимулированное инсулином поглощение глюкозы [20, 24, 33].
RBP-4 может вызывать нарушение тканевой чувствительности к инсулину путем связывания с собственными рецепторами клеточной поверхности либо через рецепторы ретиноевой кислоты [20, 24, 33].
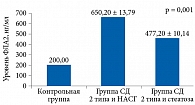
На рисунке 4 представлены показатели метилглиоксаля. Наиболее высокие выявлены у пациентов с СД 2 типа и НАСГ (p = 0,001).
На рисунке 5 представлены результаты исследования уровня оксида азота в сыворотке крови. В отличие от контрольной группы в группах НАЖБП, особенно на стадии стеатогепатита, зафиксированы достоверно более высокие показатели (p = 0,001). Повышенное содержание NO у пациентов с СД 2 типа и НАСГ может объяснять развитие эндотелиальной дисфункции и множественной политопной резистентности к регуляторным механизмам. Реализация данного эффекта происходит на уровне гепатоцитов. Чем выше степень нарушения функции печени, тем более выражен полиморфизм рецепторной резистентности.
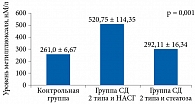
У больных СД 2 типа и НАСГ отмечено достоверное повышение ассоциированной с липопротеинами фосфолипазы А2 (рис. 6).
Активность ФЛА2 свидетельствует о высоком кардиоваскулярном риске и риске кардиоваскулярных событий у больных данной группы. Кроме того, у них же отмечены наиболее высокие показатели RBP-4, что доказывает прямую связь между значениями RBP-4 и ФЛА2 при СД 2 типа, протекающем в сочетании с НАСГ.
Далее представлены результаты исследования метаболитов кишечной микрофлоры у больных СД 2 типа со стеатозом печени и НАСГ.
В исследование было включено 37 больных СД 2 типа, у 18 из которых был диагностирован НАСГ, у 19 – стеатоз печени.
У всех больных исследовали метаболическую активность микрофлоры толстой кишки по данным концентраций фекальных короткоцепочечных жирных кислот (КЖК): уксусной (ацетата), пропионата, масляной (бутирата), валериановой, капроновой кислот и их изомеров – методом газожидкостной хроматографии.
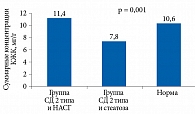
В группе СД 2 типа и стеатоза печени зафиксировано повышение суммарной метаболической активности бактерий толстой кишки относительно контрольной группы (n = 16) – 12,1 ± 4,1 vs 10,6 ± 2,5 мг/г. В группе СД 2 типа и НАСГ она, наоборот, оказалась ниже, чем в контрольной группе, – 7,8 ± 1,0 vs 10,6 ± 2,5 мг/г (p < 0,05) (рис. 7).
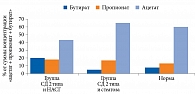
В структуре метаболитов кишечной микрофлоры у пациентов с СД 2 типа и стеатозом печени отмечалось увеличение абсолютных концентраций и доли пропионата и ацетата, доля бутирата оказалась сниженной и составила 38,3% от нормальных значений (p < 0,05) (рис. 8). Кроме того, в группах СД 2 типа с НАСГ и стеатозом наблюдалось существенное повышение доли изокислот – метаболитов условно патогенной микрофлоры – 15,4 и 10,2% соответственно при норме 6,1% (p < 0,05).
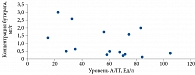
Четко прослеживалась обратная отрицательная корреляция концентраций бутирата и аланинаминотрансферазы (АЛТ) (r = - 0,4355; p < 0,05) (рис. 9), свидетельствующая о роли бутирата в развитии так называемого эндотоксин-опосредованного перекисного окисления липидов клеточных мембран в условиях оксидативного стресса с последующим развитием НАСГ.
Выводы
У пациентов с СД 2 типа и НАСГ наблюдается достоверное увеличение уровней RBP-4 и метилглиоксаля в сыворотке крови по сравнению с контролем. Метилглиоксаль повреждает аргининовые остатки белков, нарушает передачу инсулинового сигнала, ингибирует ферменты и играет ключевую роль в развитии инсулинорезистентности и гипергликемии.
Высокая активность маркеров воспаления у пациентов с СД 2 типа и НАСГ является диагностическим и прогностическим критерием активности воспалительного процесса в печени, а также ассоциируется с высоким риском кардиоваскулярных осложнений.
Гипергликемия индуцирует выработку свободных радикалов, снижает активность синтазы оксида азота и нарушает чувствительность рецепторов к инсулину с развитием эндотелиальной дисфункции.
Поддержание целевой гликемии и ингибиторы НГЛТ-2
Поддержание целевой гликемии у подавляющей части пациентов с СД 2 типа остается серьезной проблемой. Патология характеризуется прогрессирующим течением, что в первую очередь связано с нарастанием дисфункции β-клеток и, как следствие, необходимостью интенсификации терапии из-за невозможности удержать гликемический контроль. Другой проблемой современной фармакотерапии являются такие нежелательные явления, как гипогликемия и увеличение массы тела, которые значительно ухудшают качество жизни пациентов, влияют на их приверженность лечению и снижают значимость его результатов. Необходимо также учитывать, что лекарственные препараты, метаболизирующиеся в печени, при ее заболеваниях нередко менее эффективны и могут вызывать непредсказуемое лекарственное поражение печени.
Инновационные препараты – ингибиторы НГЛТ-2 не метаболизируются в печени, поэтому их можно рассматривать в качестве препаратов выбора у больных СД 2 типа и НАСГ. У пациентов с СД 2 типа серьезный вклад в поддержание гипергликемии вносит повышенная реабсорбция глюкозы в почках, обусловленная повышенной экспрессией транспортного белка НГЛТ-2. Ингибиторы НГЛТ-2 блокируют реабсорбцию глюкозы в почках, способствуя выведению в среднем 50–80 г глюкозы в сутки, что позволяет снизить уровень глюкозы в крови [45]. Дополнительное выведение глюкозы почками вызывает потерю калорий, что сопровождается уменьшением объема жировой ткани и снижением массы тела. Как уже было сказано ранее, механизм действия ингибиторов НГЛТ-2 не зависит от функционального состояния β-клеток поджелудочной железы и метаболизма инсулина, что обусловливает низкий риск гипогликемий. Кроме того, отмечено положительное влияние ингибиторов НГЛТ-2 на суррогатные маркеры функции β-клеток, включая индекс HOMA-B и соотношение «проинсулин/инсулин» [46]. Во многих исследованиях оценивалось влияние ингибиторов НГЛТ-2 на гликемический контроль как в виде монотерапии, так и в виде комбинированной терапии. Установлено, что данный класс препаратов улучшает контроль не только СД, но и массы тела, а также артериального давления.
Ингибиторы НГЛТ-2 способны улучшать прогноз у пациентов с кардиоваскулярными заболеваниями и множественными факторами риска. Доказано, что ингибиторы НГЛТ-2 снижают частоту развития сердечно-сосудистых осложнений по сравнению с плацебо у пациентов с СД 2 типа и установленным атеросклеротическим сердечно-сосудистым заболеванием или множественными факторами риска сердечно-сосудистых заболеваний [47–52].
Эмпаглифлозин был первым ингибитором НГЛТ-2, продемонстрировавшим снижение кардиоваскулярной смертности и числа госпитализаций по причине сердечной недостаточности у пациентов с СД 2 типа и установленным кардиоваскулярным заболеванием в исследовании EMPA-REG OUTCOME [52].
В настоящее время исследования и разработка методов лечения данной группой препаратов нацелены на восстановление баланса между сердечно-сосудистой, метаболической и почечной системами, взаимосвязь которых уже не вызывает сомнений, и снижение риска серьезных осложнений.
Так, в 2019 г. получены первые результаты исследований ингибиторов НГЛТ-2 у пациентов с сердечной недостаточностью со сниженной фракцией выброса, согласно которым дапаглифлозин, назначенный в дополнение к стандартному лечению, снижал комбинированный показатель кардиоваскулярной смертности и частоты случаев ухудшения течения сердечной недостаточности у пациентов с и без СД 2 типа [53]. Уже через год, в августе 2020 г., были представлены полные данные исследования EMPEROR-Reduced фазы III с участием взрослых пациентов с сердечной недостаточностью со сниженной фракцией выброса с и без СД. Прием эмпаглифлозина ассоциировался со значимым, 25%-ным снижением относительного риска кардиоваскулярной смерти и госпитализаций по причине сердечной недостаточности. Кроме того, было продемонстрировано существенное замедление снижения функции почек на фоне терапии эмпаглифлозином [54].
Клиническая инертность относительно контроля кардиоренальных рисков, особенно учитывая исторический характер дефицита внимания к сердечно-сосудистому риску в руководствах по лечению сахарного диабета, остается существенной проблемой [55, 56]. Важно подчеркнуть, что в России ингибиторы НГЛТ-2 зарегистрированы с августа 2014 г., при этом уровень назначения этого класса препаратов остается низким как в нашей стране, так и во всем мире. По данным 2019 г., приблизительно у одного из трех взрослых пациентов с СД 2 типа, обратившихся за первичной или специализированной медицинской помощью, ранее было диагностировано кардиоваскулярное заболевание, но менее чем у одного из четырех взрослых с СД 2 типа и кардиоваскулярным заболеванием применялось сахароснижающее средство с доказанной пользой для сердечно-сосудистой системы. В связи с этим результаты текущего исследования по выявлению предикторов сердечно-сосудистых осложнений и группы пациентов, нуждающихся в такой терапии в первую очередь, представляются актуальными.
Исследование влияния ингибиторов НГЛТ-2 на компоненты адипо-сердечно-сосудистой оси
Проведено открытое проспективное исследование. Под наблюдением находилось 27 пациентов с СД 2 типа и НАСГ, 19 из них получали дапаглифлозин в дозе 10 мг (первая группа), 8 – эмпаглифлозин (вторая группа). В первой группе было 8 мужчин (средний возраст 57 ± 7 лет) и 11 женщин (средний возраст 62 ± 7 лет), во второй – 5 мужчин (средний возраст 56 ± 7 лет) и 3 женщины (средний возраст 61 ± 7 лет). Длительность лечения составила 12 недель (табл. 2).
Маркеры воспаления и показатели метаболизма адипо-сердечно-сосудистой оси у получавших дапаглифлозин и эмпаглифлозин статистически значимо не различались в период наблюдения (р > 0,001).
Эффективность ингибиторов НГЛТ-2 была очевидной в обеих группах. Выявлена четкая тенденция к снижению концентрации инсулина, RBP-4, метилглиоксаля и ФЛА2 после лечения.
Между группами выявлены различия лишь по содержанию ФЛА2. Через 12 недель в группе дапаглифлозина уровень ФЛА2 составил 589,21 ± 10,24 нг/мл, в группе эмпаглифлозина – 512,00 ± 12,24 нг/мл (р = 0,001). Следует отметить, что ФЛА2, которая является липолитическим ферментом, вызывающим модификацию липидов и стимулирующим развитие воспаления, на фоне приема эмпаглифлозина снизилась достоверно. Известно, что фосфолипазная активность митохондрий играет ведущую роль в развитии апоптоза, в частности в кардиомиоцитах, поэтому она признана независимым фактором риска развития кардиоваскулярных событий.
Что касается КЖК, то через 12 недель после приема препарата статистически значимых отклонений от исходного уровня в обеих группах не зафиксировано. Содержание КЖК было наиболее рефрактерным показателем.
Отмечена прямая корреляция между содержанием RBP-4 и ФЛА2, метилглиоксаля и инсулина. У больных СД 2 типа и НАСГ выявлена обратная связь между уровнями RBP-4 и бутирата (по содержанию КЖК). RBP-4 является показателем нарушения тканевого метаболизма, ранним диагностическим критерием факторов риска кардиоваскулярных событий, диагностическим критерием хронического, субклинически протекающего системного воспаления, локальным проявлением которого признано развитие и прогрессирование НАСГ, а также целого ряда метаболических заболеваний и формирование множественной политопной рецепторной резистентности у больных СД 2 типа.
Полученные нами данные свидетельствуют, что метаболическая стабильность и устойчивость кишечной микробиоты – более постоянные величины, чем тканевой метаболизм, и разрушить метаболическую память кишечной микробиоты в соответствии с заданными конечными целевыми точками достаточно сложно. Связь этих двух аспектов метаболизма является новым и малоизученным аспектом и требует дальнейших исследований, которые позволят управлять процессами метаболизма кишечной микробиоты и предотвращать развитие целого кластера метаболических заболеваний.
Заключение
Результаты нашего исследования в полной мере согласуются с немногочисленными литературными данными. В частности, высокий уровень RBP-4 можно рассматривать в качестве маркера неблагоприятного прогноза у пациентов с СД 2 типа и НАЖБП, а также высоким кардиоваскулярным риском. Ингибиторы НГЛТ-2 эффективны в отношении снижения уровня RBP-4 у больных СД 2 типа и НАСГ, что способно уменьшить риск развития кардиоваскулярных заболеваний. Достоверное снижение уровня ФЛА2 на фоне терапии ингибиторами НГЛТ-2 позволяет сделать вывод о подавлении апоптоза кардиомиоцитов и, как следствие, о профилактике сердечной недостаточности у больных СД 2 типа. Наиболее выраженным данный эффект был при приеме эмпаглифлозина.
L.A. Zvenigorodskaya, MD, PhD, Prof., A.M. Mkrtumyan, MD, PhD, Prof., M.V. Shinkin, T.V. Nilova, S.Yu. Silverstova, PhD, G.G. Varvanina, A.V. Petrakov
A.S. Loginov Moscow Clinical Scientific and Practical Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Mikhail V. Shinkin, jendis@yandex.ru
Retinol-binding protein 4 (RSP-4) – a member of the adipokine family, synthesized in hepatocytes and adipocytes, is a transport protein for retinol; increases in patients with obesity, type 2 diabetes mellitus, non-alcoholic fatty liver disease, indicates high cardiometabolic risks.
RSP-4 is recognized as a hormone of metabolic syndrome due to its effect on the main definitions of metabolic syndrome – visceral obesity, insulin resistance, arterial hypertension, dyslipidemia.
A high associative relationship of RSP-4 with the metabolic function of short-chain fatty acids and free fatty acids was revealed. With an excess of free fatty acids, the binding of insulin to receptors of hepatocytes and other tissues decreases, hyperinsulinemia develops in conditions of insulin resistance. RSP-4 regulates the action of insulin in tissues, skeletal muscles and liver, has competence in relation to markers of inflammation – endotoxin and nitric oxide, lipoprotein-associated phospholipase A2, which is a lipolytic enzyme that causes lipid modification and stimulates development of inflammation. The degree of insulin resistance may be due to the content of products of excessive glycosylation, in particular, an increased content of methylglyoxal, which characterizes the metabolic memory of the cell and is regulated by the activity of RSP-4, causes an increase in the content of inflammatory markers, is accompanied by an increase in the activity of liver enzymes, the severity of morphological changes in hepatocytes, which negatively affects on the effectiveness of hypoglycemic drugs metabolizing in the liver, and can also cause unpredictable drug damage to the liver, which can lead to a more severe clinical course of type 2 diabetes and its multiple complications. The metabolizing function of RSP-4, both direct and indirect, is realized by activating the processes of chronic subclinical systemic inflammation, endotoxin-mediated increase in the activity of lipoprotein-associated phospholipase A2, which is recognized as an independent risk factor for cardiovascular events, is a prognostic and diagnostic criterion of their complications.
A dynamic study of the content of RSP-4 will allow monitoring the effectiveness of antihyperglycemic drugs of various pharmaceutical groups, monitoring and anticipating the development of negative cardiovascular events and timely prophylaxis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.