Коморбидность когнитивных нарушений у пожилого пациента: анализ наиболее частых причин когнитивных нарушений в пожилом возрасте с разбором клинического случая
- Аннотация
- Статья
- Ссылки
- English
Причины когнитивных нарушений в пожилом возрасте
Распространенность когнитивных нарушений у пациентов старших возрастных групп высока и увеличивается с возрастом. Так, частота тяжелых когнитивных нарушений у пациентов 65–69 лет составляет 1,5%, в то время как у пациентов 70–74 лет – 3,5%, а у пациентов 75–80 лет – 6,3%. Частота малых нейрокогнитивных нарушений еще выше. По данным R.C. Peterson и соавт., малые или умеренные нейрокогнитивные расстройства могут обнаруживаться у 11–17% пожилых людей [1, 2].
Столь высокая распространенность служит основанием для формирования популярной обывательской точки зрения о том, что когнитивные нарушения вызваны естественным старением. Эта точка зрения, конечно, неверна и базируется на неправильном статистическом анализе внешне зависимых друг от друга переменных. Когнитивные нарушения – симптом декомпенсации познавательных функций при ряде заболеваний, которые имеют свойство с течением времени становиться тяжелее. Соответственно когнитивные нарушения – следствие не возраста, а накопления дефекта и декомпенсации при прогрессировании заболевания.
Возрастные когнитивные изменения, обусловленные снижением массы мозга, числа нейронов, синапсов, церебральных медиаторов, особенно дофамина и его производных, не миф и объективно существуют. Однако возрастные когнитивные изменения обнаруживаются не болезненными симптомами, а некоторым изменением личности, характерным в той или иной степени для всех людей. С возрастом становится труднее приобретать новые навыки, переключаться с одного вида деятельности на другой, а также адаптироваться к меняющимся обстоятельствам, перестраивать восприятие и представления в изменившейся ситуации – развивается так называемая когнитивная ригидность. Вместе с когнитивной появляется и поведенческая ригидность – привязанность к месту жительства, вещам, привычкам. Но это не болезнь. Человек в старости так же, как и в молодости, способен научиться чему-то новому (водить машину, освоить компьютер, выучить новый язык), но ему потребуется несколько больше времени. Овладев навыком, пожилой человек будет применять его так же, как и молодой. Описанные выше симптомы не приводят к дизадаптации – человек ведет привычный образ жизни и не нуждается в посторонней помощи. Если выраженность или качество когнитивных симптомов выходят за пределы возрастной нормы, значит, имеет место болезнь, лежащая в их основе и оказывающая серьезное влияние на головной мозг [3, 4]. Тогда необходимо проводить обследование и устанавливать причины когнитивного снижения.
Самая частая причина когнитивного снижения в пожилом возрасте – болезнь Альцгеймера (БА). Начинаясь за 10–15 лет до развития объективной симптоматики с легкого, но клинически значимого снижения памяти, заболевание вызывает массовую гибель нейронов мозгового плаща, преимущественно коры височных, теменных и затылочных долей, а также структур гиппокампова круга. БА проявляется прогрессирующим снижением памяти, диспраксией, дисгнозией, афазией, а на более поздних стадиях нарушением исполнительных функций, утратой контроля за физиологическими отправлениями, поведенческими нарушениями. Дебют заболевания обычно приходится на возраст 60–70 лет. Различают раннюю (до 65 лет) и позднюю (после 65 лет) БА.
Возраст дебюта БА влияет на скорость развития симптомов: при раннем появлении типичных нарушений памяти заболевание прогрессирует быстрее. Эта особенность связана с сочетанием генетической предрасположенности и влиянием факторов окружающей среды. Иногда БА обусловлена преимущественно генетическими факторами. Тогда заболевание имеет аутосомно-доминантный тип наследования, дебютирует рано, симптомы развиваются быстро, а эффект от лечения низкий или отсутствует. Однако в большинстве случаев (по некоторым данным, до 90%) генетический дефект при БА не столь выражен, заболевание имеет спорадический характер, симптомы появляются поздно, пациенты хорошо отвечают на базисную симптоматическую терапию [3, 5, 6]. При подобном течении заболевания на скорость прогрессии симптомов значительно влияют внешние и внутренние факторы:
- плотность нейрональных церебральных сетей и соответственно количество клеток и синапсов, вовлеченных в когнитивные процессы (когнитивный и церебральный резерв);
- сердечно-сосудистая патология, нарушения сна, депрессия, апатия;
- количество и тяжесть перенесенных черепно-мозговых травм, наркозов;
- прием препаратов, оказывающих негативное влияние на когнитивные функции (барбитуратов, бензодиазепинов, антидепрессантов и снотворных и любых других препаратов с седативным действием) [7].
В патогенезе БА в настоящее время ведущее значение придается нарушению метаболизма предшественника амилоидного белка [8]. При нарушении его ферментативного расщепления в мозге (во внеклеточном пространстве и стенке мелких сосудов) откладываются и накапливаются токсические нерастворимые фрагменты (бета-амилоид) сначала не локализованно (диффузный амилоидоз), а затем в виде так называемых сенильных бляшек. Ряд исследователей предполагают, что формирование сенильных бляшек – защитный механизм головного мозга, позволяющий ограничить нейротоксическое воздействие амилоидного белка. Вероятно, во многом благодаря этому механизму начальные морфологические стадии БА протекают бессимптомно, и нет достоверных корреляций между числом сенильных бляшек и клинической симптоматикой заболевания.
Другой морфологический маркер болезни Альцгеймера – белок тау-протеин, накапливающийся внутри нейронов в форме сплетений фибрилл (нейрофибриллярных сплетений), что свидетельствует о необратимом морфологическом повреждении нейрона. Результатом прогрессирующей гибели нейронов в коре головного мозга становится диффузный атрофический процесс, преобладающий в медиобазальных отделах лобных долей, гиппокампе, ассоциативных зонах височной и теменной коры (так называемая деменция заднего типа). Подобная локализация первых и наиболее грубых изменений ведет к формированию выраженного ацетилхолинергического церебрального дефицита. Ацетилхолинергические пути проходят в составе восходящей ретикулярной формации, проецируются на медиобазальное ядро Майнерта, цингулярную извилину, структуры гиппокампова круга и далее на кору височных, теменных и затылочных долей – то есть именно там, где выраженность нейродегенеративного процесса максимальна.
Основное клиническое проявление БА – специфические нарушения памяти, что позволяет отличить это заболевание от большинства других, обусловливающих развитие тяжелых нейрокогнитивных расстройств. Так, при БА в большей степени страдает эпизодическая память на недавние события, а события отдаленного времени пациент на ранних стадиях болезни припоминает без проблем. В дебюте заболевания не затрагиваются процедурная память (навыки, способность к обучению) и семантическая память (общие знания и представления) [3]. Нарушения эпизодической памяти носят гиппокампальный характер:
- пациент воспроизводит заученную информацию (список слов) сразу (непосредственное воспроизведение) значительно лучше, чем через некоторое время – пять минут и более (отсроченное воспроизведение);
- помощь при заучивании и подсказки при воспроизведении слов не облегчают задачу пациенту и не способствуют существенному увеличению количества воспроизведенных слов;
- пациент испытывает трудности не только при активном воспроизведении заученных слов, но и при выборе их из списка похожих слов;
- при попытке вспомнить заученную информацию появляются «вплетения», то есть слова, которые пациент не учил.
Прогрессирующие, несмотря на усилия пациента, нарушения памяти неизбежно приводят к развитию депрессии на ранних стадиях болезни. Депрессия в свою очередь в значительной степени усиливает выраженность когнитивных расстройств – образуется замкнутый круг. В этой связи лечение симптомов БА не может быть эффективным без коррекции депрессии и чаще всего сопутствующих нарушений сна.
Инсомния часто сопутствует депрессии и тревоге. Трудности при засыпании у пациента с БА и депрессией – еще один фактор ухудшения памяти. Во-первых, во время сна происходит переработка информации, полученной в течение дня, соответственно неполноценный сон будет способствовать дальнейшим трудностям запоминания и воспроизведения недавней информации. Во-вторых, согласно результатам недавних исследований, во время сна возрастает клиренс амилоидного белка [9]. Таким образом, сон – время не только для усвоения информации, но и для специфической «церебральной уборки». Отсутствие сна или снижение его качества будет в значительной степени влиять на скорость амилоидогенеза и прогрессии БА. В-третьих, к сожалению, большая часть пациентов с инсомнией для купирования нарушений сна выбирают препараты, негативно влияющие на когнитивные функции: Феназепам, антигистаминные препараты со снотворным побочным действием, Валокордин (содержит фенобарбитал). В подобном случае неправильное лечение инсомнии становится причиной нарастания выраженности у пациента когнитивных расстройств.
Важнейшими факторами, дополнительно ухудшающими память при БА, являются тревога и связанные с ней психогенные нарушения памяти. Как ни удивительно, но психогенные и органические нарушения памяти обычно сочетаются: пациент боится плохо запомнить материал, что часто приводит к отказу от запоминания вообще.
Гиппокампальные нарушения памяти могут быть следствием не только БА, но и децифита витаминов группы В (В1, В6, В12), вызванного алкоголизмом, голоданием, неупотреблением в пищу продуктов, содержащих витамины этой группы, синдрома мальабсорбции. Последний может возникнуть в результате значительного числа заболеваний, поражающих желудочно-кишечный тракт. Зачастую пациент никак не связывает симптомы поражения желудочно-кишечного тракта и нарушения памяти или вовсе не знает об имеющихся проблемах со стороны желудочно-кишечного тракта. Все это затрудняет диагностику когнитивных нарушений, обусловленных дефицитом витаминов группы В, и делает ее практически невозможной без определения их уровня в крови. Таким образом, при выявлении гиппокампальных нарушений памяти целесообразно обязательно обследовать пациента, чтобы установить возможный дефицит витаминов группы В. Если он подтвердится, то необходимо назначить лечение, в ряде случаев постоянную замещающую терапию. Ответ на лечение у пациентов с дефицитарными когнитивными расстройствами хороший, вплоть до полного их исчезновения когнитивных симптомов.
Чрезвычайно важна связь БА и сопутствующей сердечно-сосудистой патологии. Как уже упоминалось, только в 10% случаев БА вызвана генетическими факторами. В остальных 90% случаев время дебюта заболевания определяется выраженностью сопутствующей сердечно-сосудистой патологии и сосудистых факторов риска.
На поздних стадиях БА примерно у 25% пациентов развивается инсульт, что дополнительно усиливает выраженность деменции [3]. Следует отметить, что на любых этапах развития БА сочетание сосудистых и нейродегенеративных расстройств взаимно утяжеляет клинические проявления. В последнем случае речь идет о так называемых смешанных когнитивных нарушениях, на долю которых приходится 15–20% всех случаев деменции [10, 11]. Возможно, смешанный тип распространен еще шире и даже опережает другие типы в структуре когнитивных нарушений. Например, при клинико-морфологическом сопоставлении у 77% пациентов с прижизненным диагнозом «сосудистая деменция» были обнаружены сенильные бляшки и нейрофибриллярные клубочки, в то время как у 16–48% пациентов с прижизненным диагнозом БА – лакунарные инфаркты и лейкоареоз [3, 5, 12–14].
Сосудистые когнитивные расстройства (СКР) занимают второе место после БА по частоте встречаемости среди причин тяжелых нейрокогнитивных расстройств и, возможно, лидируют среди причин малых нейрокогнитивных расстройств. Термин СКР был введен V. Hachinski в 1994 г. [3, 15]. Под СКР понимают когнитивные нарушения любой степени выраженности (легкие, умеренные, тяжелые), причиной которых стало сосудистое поражение головного мозга.
Популяционные исследования показали ряд закономерностей. Частота СКР зависит от возраста и удваивается каждые пять лет. СКР чаще встречаются у мужчин. Имеются значительные различия в распространенности СКР между нациями и странами в результате как культуральных особенностей (режима питания, привычки к жирной и сладкой пище, традиционной физической активности), так и совершенствования диагностики сердечно-сосудистой патологии, своевременности и правильности оказания медицинской помощи [16–18].
Различают несколько вариантов формирования СКР.
- Острое нарушение мозгового кровообращения с поражением так называемых стратегических зон – структур мозга, важных для когнитивного функционирования (ствола мозга, гиппокампа, таламуса, базальных ганглиев, лобных долей) [19–21]. В этом случае когнитивные нарушения развиваются остро, дальнейшее их течение при однократном инсульте обычно стационарное. Иногда их выраженность со временем уменьшается.
- Мультиинфарктное поражение белого вещества головного мозга и подкорковых структур. Развитие когнитивных нарушений постепенное, прогредиентное, иногда ступенеобразное. Зачастую пациент не знает о перенесенных нарушениях мозгового кровообращения (так называемые немые инфаркты). Сердечно-сосудистая патология характеризуется поражением малых сосудов – артериальной и венозной сети малого калибра и капиллярного русла (артериальная гипертензия, сахарный диабет, коллагенозы).
- Диффузное поражение белого вещества (лейкоареоз) без перенесенных острых нарушений мозгового кровообращения. Сходное с мультиинфарктным поражением мозга течение болезни. На фоне прогредиентного ухудшения когнитивных функций отмечаются колебания выраженности когнитивных, эмоциональных и поведенческих расстройств (флуктуации). Чаще всего колебание выраженности нейрокогнитивных нарушений становится результатом отрицательной динамики соматических показателей (уровня артериального давления, частоты сердечных сокращений, ритма сердца, уровня сахара в крови, лактатацидоза, гиповолемии и т.д.) [3].
- Развитие когнитивных нарушений после перенесенного пациентом большого по объему инсульта. Характер когнитивных нарушений определяется локализацией инсульта. Течение когнитивных нарушений – стационарное. Иногда их выраженность со временем уменьшается.
Необходимо отметить, что инсульт может быть фактором, инициирующим развитие когнитивных расстройств не только сосудистой, но и иной этиологии. После инсульта у пациента могут развиться типичные гипокампальные нарушения памяти. При отсутствии структурного поражения гиппокампа вследствие перенесенного пациентом острого нарушения мозгового кровообращения появление таких симптомов с высокой степенью вероятности говорит о том, что БА, видимо, уже находилась на доклинической стадии и трансформировалась на фоне инсульта в клиническую стадию [3].
В.А. Парфенов и соавт. установили, что трансформация БА в клиническую стадию после перенесенного острого нарушения мозгового кровообращения – довольно частый феномен [22]. Так, когнитивные нарушения наблюдались у 68% пациентов с легким неврологическим дефицитом и без афазии в остром периоде инсульта, в то время как в постинсультном периоде их частота составила 83%. При этом в 53% случаев нарушения соответствовали критериям умеренных когнитивных расстройств, а в 30% – деменции. Ретроспективный анализ показал достоверное нарастание выраженности когнитивных нарушений у пациентов после инсульта: 26% до инсульта по сравнению с 60% через три месяца после него [19, 23]. По данным подробного анализа качественных характеристик когнитивных нарушений, в 32% случаев когнитивные нарушения в постинсультном периоде соответствовали БА. Таким образом, проведенные исследования убедительно свидетельствуют о том, что в трети случаев когнитивные нарушения после острого нарушения мозгового кровообращения – результат не перенесенного инсульта, а манифестации БА. Сходные данные получены и другими исследователями [24].
В развитии СКР, как и БА, важнейшая роль отводится сопутствующим тревоге, депрессии и нарушениям сна. Депрессия при СКР распространена чрезвычайно широко и, по разным данным, встречается у 30–60% пациентов [3, 25–27]. Однако выявить депрессию у пациентов с СКР часто сложнее, чем у пациентов с БА, поскольку пациенты с СКР редко предъявляют жалобы на депрессию. Среди основных клинических симптомов так называемой сосудистой депрессии – снижение настроения, психической и физической активности без ощущения самой депрессии. Тоска, чувство вины отсутствуют, а когнитивные и соматические симптомы депрессии, напротив, выражены. Пациенты жалуются на снижение уровня внимания, памяти, невозможность сосредоточиться, ощущение «неясной головы», апатию, дневную сонливость, часто в сочетании с отсутствием ночного сна. Отношение к своему состоянию нередко спокойное, безэмоциональное – «жизнь прошла, мне уже много лет, хотеть больше нечего, все уже сделал, осталось просто доживать». Часто депрессия при СКР может быть выявлена только при прицельном расспросе пациента или анкетировании.
Инсомния отмечается у каждого второго пациента с СКР или даже чаще. В основе такой распространенности инсомнии – апатия, низкая физическая активность в течение дня, дневной сон, синдром апноэ во сне, часто встречающийся у пациентов с лишним весом и сопутствующей сердечно-сосудистой патологией. Отсутствие ночного сна в свою очередь негативно сказывается на выраженности сердечно-сосудистой патологии. В ночное время у пациента с инсомнией не происходит естественного физиологического снижения артериального давления, частоты сердечных сокращений, частоты дыхания, уровня сахара. Дополнительный негативный фактор в отношении СКР – лечение нарушений сна препаратами со снотворным эффектом, негативно влияющими на когнитивные функции.
Таким образом, у пожилого пациента часто наблюдается сразу несколько состояний, которые могут приводить к когнитивным расстройствам: сосудистое поражение головного мозга, текущий нейродегенеративный процесс, дефицит витаминов группы В, депрессия, апатия, инсомния. Кроме того, он может принимать препараты, негативно влияющие на когнитивные функции. Подобная коморбидность диктует необходимость чрезвычайно тщательного сбора анамнеза, проведения дополнительных исследований, оценки результатов нейропсихологического тестирования, в том числе повторного, активного выявления депрессии, апатии и инсомнии, а также строгой очередности в алгоритме лечения и, к сожалению, иногда делает невозможным назначение того или иного вида лекарственной терапии.
Клинический случай
Пациентка М.З., 85 лет. В клинику приведена дочерью, которая обратила внимание на прогрессирующее снижение памяти у матери за последний год, в течение которого они живут вместе. До этого мать жила в Венгрии с мужем, после его смерти решила вернуться в Россию.
Анамнез. Длительное время страдает артериальной гипертензией (до 170/100 мм рт. ст.), постоянно принимает антигипертензивные препараты, на фоне лечения адаптирована к 130–140/80–85 мм рт. ст. Атриовентрикулярная блокада второй степени. Около двух лет назад диагностирована язва желудка, пролечена. В настоящее время по этому поводу терапии не получает. Около пяти лет назад выявлена гиперхолестеринемия, с повышением уровня холестерина до 6,8, коэффициент атерогенности 4,1. Длительно принимает аторвастатин 20 мг/сут, Кардиомагнил по одной таблетке в сутки. На фоне лечения показатели липидного спектра в пределах нормы. Кроме того, пять лет назад обнаружены двусторонние атеросклеротические бляшки в зоне бифуркации сонной артерии, переходящие на внутреннюю сонную артерию, с нестабильной, рыхлой поверхностью и гемодинамически незначимым стенозом просвета сосудов – 25% слева и 30% справа.
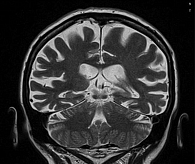
Нейровизуализационное исследование. На магнитно-резонансной томограмме (МРТ) (рисунок) – диффузный атрофический процесс, преимущественно теменных, височных и затылочных долей с двух сторон. Перивентрикулярный и единичный субкортикальный лейкоареоз.
Соматическое обследование. Пациентка повышенного питания, вес 92 кг при росте 182 см. Артериальное давление 130 и 80 мм рт. ст., частота сердечных сокращений – 62 в минуту, частота дыхания – 16 в минуту. Гипертрофия левых отделов сердца. Живот мягкий, безболезненный, не вздут. Физиологические отправления в норме.
Неврологический статус. Рефлексы орального автоматизма – хоботковый, Маринеску – Радовичи с двух сторон. Оживленный нижнечелюстной рефлекс. Другой патологии со стороны черепно-мозговых нервов нет. Парезов нет, мышечный тонус не изменен, сухожильные рефлексы живые, симметричные, патологических знаков нет. Чувствительных, координаторных нарушений нет.
Нейропсихологическое тестирование. Правильно ориентирована в месте. Однако путается при рассказе, как проехать от клиники до дома, объясняя это тем, что долго жила не в России. Дезориентирована во времени – не смогла правильно назвать дату, запуталась с определением года. Проблему отрицает, считает, что большая часть людей ее возраста тоже не смогут вспомнить правильную дату. Свою память считает хорошей. В тесте «12 слов» при непосредственном воспроизведении назвала семь слов и три с подсказкой. При отсроченном воспроизведении самостоятельно припомнила три слова и два слова с подсказкой. Имело место одно постороннее вплетение («яблоко» вместо «абрикос»). Не смогла правильно выполнить тест копирования пятиугольников, в одном из пятиугольников четыре угла, ошибку не увидела и не смогла исправить. Запуталась с определением времени на часах. Самостоятельно часы нарисовала с ошибкой (неправильно расставила цифры, не смогла исправить ошибку, не смогла поставить стрелки так, чтобы часы указывали названное исследователем время). Снижена беглость психических процессов (тест «литеральные ассоциации» – 10 слов, тест «категориальные ассоциации» – 11 слов). Пробу «кулак – ребро – ладонь» выполняет с упрощением как «кулак – ладонь», склонна к обратному развороту кисти. В целом состояние соответствует легкой деменции. Результат по Краткой шкале оценки психического статуса – 24 балла.
Наличие депрессии отрицает, настроение считает хорошим, ровным. Отмечает нарушения сна – трудно засыпает, лежит и думает о прошедших днях, просыпается рано, иногда среди ночи без видимых причин, ходит по дому, долго лежит в постели, не может заснуть. Храпа нет. Для «хорошего сна» принимает 20–30 капель Валокордина перед сном. Днем по большей части ничем не занята, иногда гуляет во дворе или в окрестностях дома, смотрит телевизор, спит. Анкетирование по шкале депрессии Гамильтона выявило субклиническую депрессию.
Анализ уровня витаминов В1, В6, В12 показал достоверное снижение концентрации витаминов В1 и В12 в крови.
Лечение. С пациенткой проведена беседа о правильном режиме сна и бодрствования, обсуждены правила гигиены сна. Получено согласие отменить Валокордин и при нарушениях сна принимать мелатонинсодержащие препараты курсом, но не более 21 дня. Назначены витамины В1 и В12. В рамках терапии депрессии назначен Феварин 50 мг/сут.
На фоне указанного лечения через две недели у пациентки развился эпизод галлюцинаций. Дочь, вернувшись с работы, обнаружила мать сидящей за сервированным столом и разливающей по чашкам чай, которая сообщила, что в гости пришли ее муж, отец и мать – все давно умершие. В неврологическом статусе – без динамики. Пациентке выполнена МРТ, по сравнению с предыдущим исследованием – без динамики.
Подробный анализ приема препаратов выявил, что пациентка по-прежнему эпизодически принимает Валокордин «от перебоев в сердце». Необходимость контроля за лечением дополнительно обсуждена с дочерью, запасы Валокордина изъяты, Феварин отменен, назначен Ципралекс 5 мг с утра. Галлюцинации прекратились на вторые сутки после пересмотра терапии.
Осмотр через месяц. Состояние пациентки удовлетворительное. Сообщила об улучшении состояния, стала активнее, бодрее, больше гуляет, занимается домашними делами. Уровень витаминов группы В в крови в пределах нормы. Нейропсихологическое тестирование – результаты прежние. Деменция легкой степени с преобладанием в клинической картине первичных гиппокампальных нарушений памяти в сочетании со зрительно-пространственными расстройствами и снижением беглости психических процессов. Последняя, однако, стала несколько выше – тест «литеральные ассоциации» – 16 слов, тест «категориальные ассоциации» – 16 слов.
Профиль когнитивных нарушений у пациентки соответствует БА. Отмечались прогрессирующие нарушения памяти гиппокампального характера в сочетании с апракто-агностическим синдромом. МРТ также подтвердила диагноз (атрофию коры височных, теменных, затылочных отделов головного мозга). Ухудшали состояние пациентки такие факторы, как депрессия, нарушения сна, прием препаратов, усиливающих когнитивные нарушения. Дополнительная соматическая отягощенность (гиперхолестеринемия, артериальная гипертензия, нарушение внутрисердечной проводимости), вероятно, не проявлялась СКР, но ускоряла развитие БА. Эпизод галлюцинаций, видимо, связан со случайным сочетанием приема Феварина и Валокордина.
Пациентке были показаны препараты базовой симптоматической терапии – ингибиторы ацетилхолинэстеразы или антагонисты NMDA-рецепторов. Однако из-за атриовентрикулярной блокады второй степени прием препаратов из группы ингибиторов ацетилхолинэстеразы невозможен. Пациентке назначен Акатинол Мемантин с повышением дозы по стандартной схеме до 20 мг/сут с утра.
Контрольный осмотр через полтора месяца стабильной терапии. Пациентка получала антигипертензивные препараты, аторвастатин 20 мг/сут, Кардиомагнил одну таблетку в сутки, мелатонинсодержащие препараты при нарушении сна не более 21 дня подряд, Ципралекс 5 мг с утра, Акатинол Мемантин 20 мг с утра. Состояние пациентки хорошее. Дочь сообщила об отчетливом уменьшении выраженности когнитивных расстройств. Пациентка стала активнее, начала писать мемуары, гуляет, занимается домашним хозяйством. Настроение ровное, сон хороший. При осмотре – состояние соответствует малым нейрокогнитивным расстройствам. Результат по Краткой шкале оценки психического статуса – 27 баллов. Сохраняются первичные гиппокампальные нарушения памяти: по результатам теста «12 слов» – непосредственное воспроизведение семи слов и двух с подсказкой, отсроченное воспроизведение – пять слов и одно с подсказкой. Часы рисует правильно. Тест копирования пятиугольников выполняет без ошибок. Испытывает легкие трудности при назывании даты. Беглость психических процессов по сравнению с предыдущим визитом не изменилась.
Таким образом, тщательный анализ факторов и заболеваний, сыгравших роль в развитии когнитивных нарушений, и оптимальный подбор препаратов позволили назначить достаточно эффективную терапию, значительно уменьшить выраженность когнитивных и эмоциональных расстройств, улучшить качество жизни пациентки и ее дочери.
Алгоритм терапии когнитивных нарушений
Исходя из представленных данных, можно предложить следующий алгоритм лечения пациента с когнитивными нарушениями.
Первое. Оценить выраженность потенциально обратимых состояний и факторов риска и по возможности устранить их. К потенциально обратимым состояниям и факторам риска относятся:
- депрессия;
- нарушения сна;
- дефицит витаминов группы В;
- нарушения зрения;
- нарушения слуха;
- артериальная гипертензия;
- нарушения ритма сердца; гиперхолестеринемия; гипергликемия;
- субклинический или клинический гипотиреоз; гемодинамически значимый стеноз сонных артерий;
- курение;
- избыточный вес; гиподинамия;
- низкая когнитивная активность;
- прием препаратов, усиливающих когнитивные нарушения.
Второе. Оценить возможность лечения болезни и перспективы патогенетической терапии, которая как для СКР, так и для БА состоит в своевременном выявлении и коррекции сердечно-сосудистой патологии и сосудистых факторов риска. Необходимо подробно осмотреть и обследовать пациента, проанализировать эффективность проводимого лечения (уровень на его фоне артериального давления, глюкозы крови, липидов крови, частоту сердечного ритма), узнать, имеет ли место прием препаратов, улучшающих показатели свертываемости крови, и т.д. По данным многочисленных клинических исследований, адекватная коррекция сердечно-сосудистой и иной соматической патологии, даже без дополнения схемы лечения препаратами базовой симптоматической терапии, позволяет достичь существенной положительной динамики когнитивных функций как при СКР, так и при БА, а помимо того отсрочить риск дальнейшего развития когнитивных нарушений [6, 28].
В настоящее время на стадии клинических исследований находится ряд препаратов, предположительно влияющих на амилоидогенез и соответственно способных воздействовать на патогенез БА.
Третье. Назначить препараты базовой симптоматической терапии: ингибиторы ацетилхолинэстеразы или антагонисты NMDA-рецепторов.
У пациентов с СКР применение ингибиторов ацетилхолинэстеразы спорно. Учитывая морфологию ацетилхолинергических путей (они локализованы преимущественно в перивентрикулярных отделах белого вещества головного мозга и соответственно могут страдать как вследствие лейкоареоза, так и при образовании лакун и инфарктов большого объема в этих областях), можно предположить дефицит ацетилхолина при СКР разной степени выраженности. Тем не менее преимущественный эффект ингибиторов ацетилхолинэстеразы отмечается у пациентов с сосудистой деменцией легкой и умеренной степени выраженности при сопутствующем нейродегенеративном заболевании [29]. Многочисленные рандомизированные плацебоконтролируемые исследования показали достоверную эффективность ингибиторов ацетилхолинэстеразы при БА [3, 30, 31], но только на стадии деменции. К сожалению, данные о применении препаратов этой фармакотерапевтической группы в качестве препаратов базовой симптоматической терапии у пациентов с легкими и умеренными когнитивными нарушениями неутешительны: их эффективность при когнитивных нарушениях, не достигающих стадии деменции, как при БА, так и при СКР не установлена.
Кроме того, в ряде случаев назначение ингибиторов ацетилхолинэстеразы сопряжено с трудностями или вовсе неосуществимо. Так, рекомендуется назначать их в максимально высоких дозах. Однако побочные эффекты (тошнота, рвота, диарея, боли в животе) дозозависимы и связаны с ацетилхолинергической активностью. Поэтому в ряде случаев нежелательные явления, развивающиеся на фоне повышения дозы, делают дальнейшее наращивание дозы невозможным. Один из методов преодоления или минимизации побочных эффектов – применение пролонгированных форм с медленным высвобождением активного вещества.
Иногда назначение ингибиторов ацетилхолинэстеразы противопоказано, например, при атриовентрикулярной блокаде второй степени. С осторожностью их применяют у пациентов с замедлением внутрисердечной проводимости другой природы. Совместный прием ингибиторов ацетилхолинэстеразы и антиаритмических препаратов (Кордарон и его аналоги) усиливает действие и побочные эффекты антиаритмической терапии.
Для анализа эффективности второй группы препаратов базовой симптоматической терапии – антагонистов NMDA-рецепторов необходимо подробнее остановиться на строении и функции глутаматергической системы. Глутаматергический синапс включает два типа ионных каналов: медленные и быстрые. Первые снабжены NMDA-рецепторами и открываются только при активации вторых, снабженных AMPA-рецепторами, что в свою очередь приводит к изменению мембранного потенциала клетки [32–35]. Мемантин – обратимый блокатор NMDA-рецепторов облегчает прохождение импульса по активным и функционально значимым нейрональным сетям [36, 37]. В условиях нарушения синаптической передачи в глутаматергических синапсах постсинаптическая потенциация развивается и в функционально значимых, и в функционально незначимых синапсах, тем самым затрудняя процессы восстановления и обучения. В таком случае Акатинол Мемантин способствует нормализации синаптической передачи, дозированно повышая порог чувствительности постсинаптической мембраны [30, 38].
Препарат хорошо переносится и обладает сравнительно малым числом побочных эффектов и противопоказаний, что немаловажно для лекарственного средства, используемого у пожилых пациентов с большим спектром соматической патологии.
Многочисленные клинические исследования убедительно продемонстрировали эффективность Акатинола Мемантина в лечении сосудистой и смешанной деменции, а также деменции при БА любой степени выраженности (легкой, умеренной и тяжелой). Все выполненные исследования были рандомизированными двойными слепыми плацебоконтролируемыми. На фоне применения Акатинола Мемантина отмечено достоверное уменьшение выраженности когнитивных расстройств (согласно данным J.M. Orgogozo и соавт. [39], G. Wilcock и соавт. [40] – в среднем на 2 балла по когнитивной субшкале Шкалы оценки когнитивных нарушений при болезни Альцгеймера (Alzheimer's Disease Assessment Scale-Cognitive Subscale – ADAS-Cog) и нарушений поведения. Пациенты стали испытывать меньше затруднений в повседневной жизни, у них в целом улучшилось качество жизни. Проведенные исследования показали также хороший эффект мемантина в лечении недементных (умеренных) когнитивных нарушений, особенно при преобладании нарушений управляющих лобных функций [41, 42]. Отмечена эффективность Акатинола Мемантина у пациентов с БА на стадии малых нейрокогнитивных расстройств. Эти результаты позволяют считать Акатинол Мемантин средством выбора в терапии умеренных когнитивных нарушений, вызванных как сердечно-сосудистыми заболеваниями, так и БА.
Интересны результаты применения Акатинола Мемантина в раннем и восстановительном периоде инсульта. Как установили В.А. Парфенов и соавт., на фоне терапии Акатинолом Мемантином в восстановительном периоде острого нарушения мозгового кровообращения наблюдалась не только положительная динамика когнитивных функций, но и уменьшение инвалидизации в целом. Сходные результаты были получены S. Petril и соавт. [43, 44]. Анализ эффективности использования Акатинола Мемантина в остром периоде ишемического инсульта показал достоверное положительное влияние препарата как на скорость и качество восстановления когнитивных функций, так и на качество реабилитации. Полученные данные позволяют рекомендовать использование Акатинола Мемантина в качестве средства базовой симптоматической терапии, способствующего быстрой и качественной реабилитации пациентов на фоне острого нарушения мозгового кровообращения.
Четвертое. Определить и применить нелекарственные методы: когнитивный тренинг, когнитивно-моторный тренинг, когнитивную стимуляцию, психотерапию [20, 45–49]. Указанные методы высокоэффективны у пациентов с малыми нейрокогнитивными расстройствами и включены в рекомендации по ведению таких пациентов. При тяжелых когнитивных нарушениях когнитивный тренинг может быть эффективным на начальных стадиях деменции. Необходимость психотерапии обусловлена частым развитием депрессии и тревожных расстройств как реакции на нарушение когнитивных функций и утрату независимости. Показана эффективность когнитивного стимулирования – обучения пациента и ухаживающих за ним лиц стратегиям преодоления социальных трудностей и дизадаптации за счет сохранных когнитивных функций, вспомогательных методов и алгоритмов. Не менее важно проводить обучение сиделок и ухаживающих лиц, не допуская у них профессионального выгорания и депрессии.
Пятое. Рассмотреть возможность проведения неспецифической терапии. Лечение когнитивных нарушений не может начинаться с препаратов неспецифической терапии, но в ряде случаев они могут использоваться в качестве дополнения. Преимущество имеют лекарственные средства с доказанной эффективностью, прошедшие достаточное количество двойных рандомизированных плацебоконтролируемых клинических исследований.
I.S. Preobrazhenskaya
I.M. Sechenov First Moscow State Medical University
Contact person: Irina Sergeyevna Preobrazhenskaya, irinasp2@yandex.ru
The article discusses the causes of cognitive disorders in the elderly, their possible combinations, as well as the features of therapy in the polyetiological nature of cognitive impairment. Analyzed features of diagnosis and therapy in a patient with cognitive impairment in the framework of combination of cardiovascular and neurodegenerative pathology on the example of a clinical case.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.