Коррекция метаболических расстройств у больных раком поджелудочной железы
- Аннотация
- Статья
- Ссылки
- English

Введение
Рак поджелудочной железы (РПЖ) – одно из самых неблагоприятных злокачественных новообразований. В настоящее время отмечается устойчивый рост РПЖ во всем мире [1]. РПЖ является четвертой по распространенности причиной смерти от рака в западных странах с общей двухлетней выживаемостью менее 10% [2, 3]. Так, во Франции РПЖ занимает 13-е место по распространенности и восьмое по смертности среди всех видов рака [4]. В США РПЖ среди причин смерти от рака занимает четвертое место и, по прогнозам, к 2030 г. выйдет на третье [5]. В России также отмечается рост заболеваемости РПЖ: если в 2012 г. на долю РПЖ в структуре смертности приходилось 5,4%, то в 2015 г. – 5,9% [6], а в 2017 г. – 6,2%, что соответствует пятому месту после рака легкого, желудка, ободочной кишки и молочной железы [7]. Данная тенденция связана с трудностями и несвоевременной диагностикой РПЖ, что нередко приводит к тому, что оперативное лечение уже невозможно либо откладывается в случае погранично резектабельной опухоли.
В настоящее время одним из наиболее эффективных методов лечения РПЖ считается хирургическое. Однако примерно у 80% пациентов с РПЖ на момент постановки диагноза имеется нерезектабельный местнораспространенный рак [8]. В данной ситуации первым этапом лечения является полихимиотерапия (ПХТ) [9]. При проведении неоадъювантной ПХТ необходима оценка ее эффективности по данным мультиспиральной компьютерной томографии (МСКТ) или магнитно-резонансной томографии (МРТ) каждые 6–8 недель [10].
Несмотря на преимущества химиотерапии, она вызывает разнообразные побочные эффекты из-за неселективного действия на клетки. К ним относятся потеря аппетита, тошнота, рвота и стоматит, которые могут нарушать пероральное потребление пищи и нормальное всасывание питательных веществ [11]. В связи с этим нарастает потеря веса, снижение скорости реакции на противоопухолевые препараты, повышение их токсичности [12] и, как следствие, снижается качество жизни пациентов [13]. Рак ПЖ и желчных протоков занимает второе место по частоте дефицита питания больных (47,6%) [14] среди всех случаев рака.
Кроме того, учитывая, что в 95% всех экзокринных новообразований ПЖ представлены протоковой аденокарциномой – быстро прогрессирующей опухолью, возрастает число пациентов с внешнесекреторной недостаточностью ПЖ, усугубляющей нутриционную недостаточность. При прогрессировании онкологических заболеваний ПЖ, по мнению некоторых авторов, развивается экзокринная, а зачастую и эндокринная недостаточность ПЖ [15], что приводит к мальдигестии. Мальдигестия наиболее часто проявляется астенией (86%), анорексией (85%), потерей веса (85%), болями в животе (79%) [16, 17].
Таким образом, постоянный мониторинг и раннее диетологическое вмешательство имеют решающее значение для профилактики недостаточности питания у онкологических больных, получающих химиотерапию [18, 19].
Развитие нутриционной недостаточности у пациентов с РПЖ происходит через несколько механизмов, в связи с чем возникает вопрос об эффективности нутриционной коррекции и пути введения нутриентов. При определенном клиническом течении РПЖ у пациентов может развиваться хронический воспалительный процесс (холангит) на фоне механической желтухи. В условиях длительно существующей желтухи вторичный холестатический гепатит будет негативно влиять на нутриционный статус пациента.
Одним из методов оценки нутриционного статуса и соответственно основным из показателей, влияющих на стратегию лечения, является биоимпедансный анализ состава тела (БИМ). В основе метода лежит оценка электрической проводимости различных тканей тела, которые имеют два компонента: активное R и реактивное сопротивление Xc. Субстратом активного сопротивления служат жидкости (клеточная и внеклеточная), а реактивного – клеточные мембраны. Фазовый угол – это арктангенс отношения реактивного и активного сопротивления для некоторой частоты тока. Значение фазового угла характеризует емкостные свойства клеточных мембран и жизнеспособность биологических тканей. При его снижении менее 4,4°, например, у больных циррозом печени или онкологическими заболеваниями некоторых локализаций сокращается время дожития.
Таким образом, определение фазового угла методом БИМ при РПЖ может служить прогностическим фактором дожития [20]. Однако следует понимать, что применение БИМ у кахектичных больных может быть затруднено, поскольку сопоставление референсных (формульных значений) может быть некорректно [21].
Потребность в нутриционной поддержке у онкологических больных будет варьировать на протяжении всего периода лечения в зависимости от того, проходят ли пациенты активное онкологическое лечение (операция, химиотерапия), находятся ли в ремиссии или в паллиативной стадии (проведение только химиотерапии).
Первая линия периоперационного нутриционного лечения для хирургических онкологических больных, нуждающихся в искусственном питании, – энтеральное питание (ЭП) [22, 23]. И европейские, и американские рекомендации предлагают у онкологических больных, перенесших серьезные операции на голове, шее или брюшной полости, предоперационную подготовку осуществлять ЭП с иммуностимулирующими формулами, содержащими аргинин, омега-3 жирные кислоты и нуклеотиды [2, 4]. Правда, степень этой рекомендации еще обсуждается. Послеоперационное ЭП показано хирургическим пациентам с недостаточным питанием на момент вмешательства, тем, кто не может возобновить пероральное питание рано или когда ожидается, что оно будет недостаточным в течение десяти дней [22–24]. Рутинное применение парентерального питания в период лечения рака категорически не рекомендуется, поскольку должно подбираться индивидуально [23, 25], чтобы не усугубить метаболические нарушения. Каждый клинический случай должен быть стратегически продуман и составлена персональная программа нутриционной поддержки.
Клинический случай
Больная А., 55 лет, в феврале 2020 г. была госпитализирована в отделение патологии поджелудочной железы и желчевыводящих путей Московского клинического научно-практического центра (МКНЦ) им. А.С. Логинова с жалобами на давящие боли в правом подреберье, эпигастрии, отрыжку воздухом, вздутие, урчание в животе, общую слабость, снижение веса на 13 кг за шесть месяцев.
Из анамнеза известно, что в мае 2019 г. пациентка отмечала появление чувства дискомфорта в эпигастральной области, тошноту, снижение аппетита. В июле 2019 г. появилась желтушность кожных покровов и склер. За период с середины июня до начала августа 2019 г. масса тела снизилась на 12 кг. 1 августа 2019 г. с клинической картиной механической желтухи в экстренном порядке больная была госпитализирована в хирургическое отделение стационара.
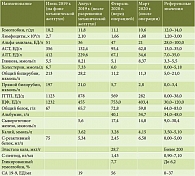
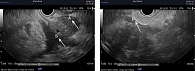
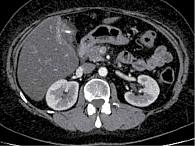
При обследовании, по данным ультразвукового исследования (УЗИ), МСКТ с внутривенным контрастированием, результатам лабораторных исследований, выявлено новообразование головки ПЖ, сдавление дистального отдела общего желчного протока, механическая желтуха. Показатели холестаза: общий билирубин – 213 мкмоль/л, прямой – 197 мкмоль/л, щелочная фосфатаза (ЩФ) – 1232 ЕД/л, гамма-глутамилтранспептидаза (ГГТП) – 1123 ЕД/л и цитолиза: аспартатаминотрансфераза (АСТ) – 356 ЕД/л, аланинаминотрансфераза (АЛТ) – 412 ЕД/л были превышены более чем в 10–11 раз (таблица). Тогда же выявлена гипергликемия – 8,21 ммоль/л, установлен диагноз сахарного диабета и назначена инсулинотерапия. С учетом выраженного холестаза и цитолиза пациентке была выполнена пункционная холецистостомия под ультразвуковым контролем. После разрешения механической желтухи пациентка с рекомендациями была выписана из стационара и 16 августа 2019 г. госпитализирована в МКНЦ им. А.С. Логинова для верификации новообразования головки поджелудочной железы. Под контролем эндосонографии была выполнена видеоэндоскопическая тонкоигольная пункция. В проекции головки поджелудочной железы визуализируется гипоэхогенное новообразование с неровными нечеткими контурами размером 2,8 × 3,2 см. Главный панкреатический проток в структуре опухоли не прослеживается, обрывается на уровне тела, где имеет диаметр 3,8 мм. Парапанкреатическая клетчатка инфильтрирована. Верхняя брыжеечная вена вовлечена в новообразование на протяжении 1,5 см (рис. 1). Результаты цитологического исследования – аденокарцинома головки ПЖ (рис. 2).
У пациентки опухоль была погранично резектабельной (по данным эндоскопической ультрасонографии, вовлечение верхней брыжеечной вены в новообразование на протяжении 1,5 см), в связи с чем на онкологическом консилиуме было принято решение на первом этапе провести неоадъювантную ПХТ в режиме mFOLFIRINOX каждые две недели с оценкой эффекта после четырех введений и определением дальнейшей тактики лечения.
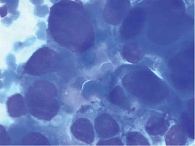
После первого курса ПХТ пациентке была выполнена МСКТ с внутривенным контрастированием, по данным которой в головке ПЖ определялось образование неправильной формы, с неровным нечетким контуром, гиподенсной структуры во все фазы исследования, размером 32 × 22 × 29 мм, накапливающее контрастный препарат с 30–30 Н в начальной фазе до 70–75 Н в поздней артериальной фазе с медленным вымыванием до 65 Н в отсроченной фазе, блокирующее главный панкреатический проток. Главный панкреатический проток расширен до 4 мм на уровне перешейка и тела, на уровне хвоста до 3,5 мм; с блоком на уровне образования. Перипанкреатическая клетчатка уплотнена в верхней части образования, без выраженной инфильтрации. Верхняя брыжеечная вена контактирует с новообразованием на протяжении 23 мм, охват окружности менее 180°. Контур вены не деформирован, сохранена четкость наружного контура ее стенки. Аорта, нижняя полая вена, чревный ствол, селезеночные сосуды, общая печеночная артерия, верхняя брыжеечная артерия непосредственно с новообразованием не контактируют (рис. 3). С учетом данной рентгенологической картины – сохранение контакта верхней брыжеечной вены с новообразованием головки ПЖ – ПХТ продолжена.
В феврале 2020 г., по завершении 11 курсов mFOLFIRINOX, пациентка повторно госпитализирована в отделение патологии поджелудочной железы и желчевыводящих путей МКНЦ им. А.С. Логинова для оценки эффективности ПХТ и определения дальнейшей тактики лечения.
По результатам проведенного обследования отмечалась положительная динамика в виде уменьшения размеров образования головки ПЖ и выраженности инфильтрации окружающей клетчатки (в том числе на верхнюю брыжеечную вену) по результатам МСКТ (рис. 4).
Проведены эндоскопические исследования:
- эзофагогастродуоденоскопия: диагностированы поверхностный гастрит и деформация луковицы двенадцатиперстной кишки за счет компрессии извне;
- ректосигмоколоноскопия: выявлены единичные дивертикулы сигмовидной кишки.
По данным лабораторных исследований, у больной сохранялся умеренный цитолиз и выраженный холестаз, а также изменения нутриционного статуса: гипокалиемия, снижение гемоглобина, лимфоцитопения (таблица). Низкий уровень эластазы кала (28,7 мкг/г) свидетельствовал о наличии внешнесекреторной недостаточности ПЖ, а высокий уровень глюкозы крови (8,37 ммоль/л) и гликированного гемоглобина (7,7%) – о панкреатогенном сахарном диабете. В связи с этим пациентке проведена коррекция экскреторной и инкреторной недостаточности ПЖ: начата заместительная ферментная терапия микрокапсулированными препаратами панкреатина с энтеросолюбильной оболочкой в суточной дозе 170 000 ЕД липазы и продолжена ранее назначенная инсулинотерапия. Значимого повышения уровня СА 19-9 не наблюдалось (таблица). Для выявления признаков и степени тяжести белково-энергетической недостаточности исследовали нутриционный статус пациентки.
Антропометрические показатели: рост – 168 см, вес – 96 кг, индекс массы тела – 34,3 кг/м2; окружность плеча – 32,5 см, толщина жировой складки над трицепсом – 12 мм, окружность мышц плеча – 28,7 см.
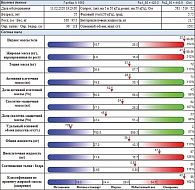
Данные соответствовали ожирению 2-й степени, что и подтвердили биоимпедансным анализом состава тела (рис. 5), где также выявили сохраненную тощую массу тела – 53,4 кг, скелетно-мышечную массу – 24,3 кг. Однако с учетом ожирения было нарушено перераспределение жидкости с ее задержкой во внеклеточном пространстве. Удельный основной обмен был крайне низким – 739,4 ккал/м2/сут (при минимальной индивидуальной расчетной норме – 792,5 ккал/м2/сут).
Биохимические показатели в отношении нутриционного статуса (таблица) имели отклонения в виде гипокалиемии (минимальное значение – 3,28 ммоль/л), снижения гемоглобина до 11,1 г/дл, лимфоцитопении – 1,66 тыс. в мкл, повышения маркеров цитолиза и холестаза: АСТ – 95 ЕД/л, АЛТ – 67,1 ЕД/л, ГГТП – 569 ЕД/л, ЩФ – 753 ЕД/л.
Таким образом, с учетом редукции веса в течение девяти месяцев признаки белкового дефицита, проявляющиеся лимфоцитопенией, отклонения нутриционного статуса соответствовали белково-энергетической недостаточности 1–2-й степени тяжести с явлениями гипокалиемии, гипохромной анемии легкой степени тяжести, дегидратации.
Все эти данные, а также редукция массы тела на 25 кг за девять месяцев от начала болезни, предстоящее оперативное вмешательство явились показанием для назначения нутриционной коррекции смешанного типа.
Программа нутриционной коррекции на дооперационном этапе включала:
- стол с исключением легкоусвояемых углеводов;
- рекомендуемый калораж 1800 ккал/сут (на идеальный вес 62 кг), потребность в белке 62 г/сут;
- пероральный прием смеси (сипинг) составом, не нарушающим углеводный обмен;
- парентеральное введение аминокислотных растворов с гепатопротективным эффектом, антиоксидантами и повышенным уровнем калия.
Дополнительно вводились препараты железа.
По результатам повторной БИМ подтвердили ожирение 2-й степени. Тощая масса тела сохранена, несмотря на значительное снижение веса (25 кг за девять месяцев). Удельный основной обмен снижен до 739,4 ккал/м2/сут. Отмечалось повышенное содержание внеклеточной жидкости до 17,4 кг, что, по-видимому, обусловлено ее задержкой в жировой клетчатке. Фазовый угол равен значению 5,75° (норма – 5,4–7,8°), что отражает стабильный уровень состояния клеточных мембран.
Учитывая данные анамнеза, результаты проведенного обследования, пациентке установили заключительный клинический диагноз: Рак головки ПЖ сT4N1М0, 11 курсов mFOLFIRINOX, частичный ответ.
Осложнения основного: Механическая желтуха. Холецистостомия в августе 2019 г. Вторичный холестатический гепатит умеренной биохимической активности. Панкреатическая гипертензия. Внешнесекреторная недостаточность поджелудочной железы тяжелой степени. Панкреатогенный сахарный диабет, целевой уровень НbА1с менее 8%. Белково-энергетическая недостаточность 1–2-й степени тяжести. Гипохромная анемия легкой степени тяжести. Дегидратация.
Сопутствующий: Дивертикулярная болезнь толстой кишки. Ожирение 2-й степени.
Онкологический консилиум принял решение провести радикальное оперативное лечение в объеме панкреатодуоденальной резекции, учитывая частичный ответ на ПХТ: отсутствие инфильтрации на верхней брыжеечной артерии, уменьшение опухоли в размерах, уменьшение распространенности на верхнюю брыжеечную вену, локализованный характер опухоли, восстановленный нутриционный статус пациентки.
20 февраля 2020 г. выполнена лапароскопическая гастропанкреатодуоденальная резекция.
Данные морфологического исследования операционного материала: протоковая аденокарцинома головки ПЖ с признаками неполного терапевтического регресса TRS 2 (по модифицированной системе Ryan), периневральным ростом, лимфатической инвазией, без метастазов в 24 регионарных лимфатических узлах, удаленная в пределах не контаминированных опухолью тканей.
Оперативное лечение – без осложнений.
Данные лабораторных исследований: цитолиза нет, холестаз уменьшился.
Контрольный биоимпедансный анализ состава тела после операции выявил положительные сдвиги в метаболизме пациентки: уменьшилась степень ожирения в виде редукции жировой ткани на 3,7 кг. В то же время в условиях операционного и постоперационного стресса отмечалась редукция тощей массы тела на 2,3 кг. При этом скелетно-мышечная масса снизилась лишь на 1 кг. Произошла активация удельного основного обмена до 760,6 ккал/м2/сут. Частично уменьшилась внеклеточная жидкость (на 0,9 кг). Увеличился показатель фазового угла до 6,18°, отражающего состояние клеточных мембран (норма – 5,4–7,8°).
После проведенного лечения повторный онкологический консилиум рекомендовал динамическое наблюдение каждые три месяца в течение первых двух лет, далее – каждые полгода.
Обсуждение
В большом количестве случаев РПЖ манифестирует механической желтухой и гипергликемией, что демонстрирует представленная клиническая ситуация. По данным различных авторов, желтуха при раке головки ПЖ возникает в 82–93% случаев [26, 27]. Развитие механической желтухи приводит к возникновению холестатического гепатита с выраженным цитолизом и холестазом, что обусловливает снижение белково-синтетической функции печени. В подобной ситуации необходима нутриционная поддержка пациента для улучшения метаболизма и подготовки к оперативному лечению.
У 50% больных РПЖ с локализацией опухоли в головке развивается панкреатогенный сахарный диабет [28], что имело место в рассмотренном случае. Оба состояния усугубляют степень нутриционной недостаточности. Таким образом, постоянный мониторинг и раннее назначение препаратов, влияющих на состояние нутриционного статуса, имеют решающее значение для профилактики недостаточности питания у онкологических больных [18]. Европейское общество клинического питания и метаболизма (ESPEN) в Австралии, Европе, Великобритании и США рекомендует ЭП для улучшения нутритивного статуса у больных раком ПЖ с нутриционной недостаточностью [23, 29–31]. БИМ состава тела может быть использован для оценки влияния оперативного вмешательства на состав тела пациента [32].
В течение многих лет дискутируется использование энтерального и парентерального питания. Каждый вид питания имеет свои плюсы и минусы. Не следует забывать о таких факторах, как ожирение и сахарный диабет, которые сопровождают РПЖ и влияют на метаболизм [33].
Эффективность нутриционной программы базируется на правильном расчете калорий и потребностей в белке, особенно в условиях хронического воспалительного онкологического процесса, холестатического гепатита, ожирения, инсулинзависимого сахарного диабета и тяжелой внешнесекреторной недостаточности ПЖ, а также выборе оптимальных питательных сред.
Оценка эффективности нутриционной поддержки в рассмотренном случае подтверждена клиническими данными (стабилизация состояния пациентки), положительными сдвигами биохимических показателей (уменьшением выраженности холестаза, цитолиза, устойчивыми показателями белково-энергетического, электролитного обмена) и с помощью БИМ.
Заключение
Адекватная программа нутриционной коррекции способна улучшить состояние нутриционного статуса больного, перенесшего комплексное лечение РПЖ (полихимиотерапию, операцию), обеспечить раннюю реабилитацию и предупредить развитие осложнений.
K.A. Nikolskaya, PhD, T.N. Kuzmina, PhD, Ye.A. Dubtsova, PhD, M.A. Kiryukova, K.K. Noskova, PhD, Ye.V. Bistrovskaya, PhD, V.V. Shchadrova, P.S. Feoktistova, PhD, D.S. Bordin, PhD, Prof., I.Ye. Khatkov, Member-Corr. RAS, PhD, Prof.
A.S. Loginov Moscow Clinical Research and Practical Center
Research Institute of Health Organization and Medical Management
Tver State Medical University
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Karine A. Nikolskaya, k.nikolskaya@mknc.ru
Presented the case of complex examination of a patient with pancreatic cancer using a bioimpedance method for assessing the nutritional status before and after surgical treatment. Provided the literature data related to this problem. The presented clinical case demonstrates the features of correction of the nutritional status of a patient with conditionally resectable pancreatic cancer in conditions of cholestasis, severe external pancreatic insufficiency and pancreatogenic diabetes mellitus on the background of constitutional obesity.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.