Костнопротективный эффект агонистов рецепторов глюкагоноподобного пептида 1 у пациенток с сахарным диабетом 2 типа в постменопаузальном периоде
- Аннотация
- Статья
- Ссылки
- English
В статье разбирается клинический случай с пациенткой 55 лет, страдавшей СД 2 типа и остеопенией. Возраст наступления менопаузы – 52 года. При обращении масса тела больной составила 94,5 кг, индекс массы тела – 35,1 кг/м2, окружность талии – 101,2 см. Гликированный гемоглобин был выше индивидуального целевого значения (7,4%), выявлен дефицит витамина D (18,4 нг/мл). Показатели фосфорно-кальциевого обмена, маркеры костного ремоделирования – в пределах референсных значений. По результатам обследования костной ткани установлена остеопения с низким десятилетним риском остеопоротических переломов и частичным нарушением микроархитектоники (TBS – 1,28). Пациентке рекомендован лираглутид для коррекции углеводного обмена и борьбы с ожирением. На фоне терапии оценена динамика показателей углеводного обмена, массы тела, костного метаболизма и костной массы. Проводилась коррекция дефицита витамина D.
За два года наблюдения гликированный гемоглобин снизился и сохранялся в пределах индивидуального целевого значения (5,9%), эпизоды гипогликемии не выявлены, сниженная масса тела в течение первого года лечения сохранялась и прогрессировала в течение всего периода наблюдения (-21 кг). Несмотря на значительное уменьшение массы тела, лираглутид оказал положительное влияние на костный метаболизм (снижение маркеров резорбции и повышение маркеров формирования) и минеральную плотность кости (по абсолютным значениям и TBS – 1,32).
В статье разбирается клинический случай с пациенткой 55 лет, страдавшей СД 2 типа и остеопенией. Возраст наступления менопаузы – 52 года. При обращении масса тела больной составила 94,5 кг, индекс массы тела – 35,1 кг/м2, окружность талии – 101,2 см. Гликированный гемоглобин был выше индивидуального целевого значения (7,4%), выявлен дефицит витамина D (18,4 нг/мл). Показатели фосфорно-кальциевого обмена, маркеры костного ремоделирования – в пределах референсных значений. По результатам обследования костной ткани установлена остеопения с низким десятилетним риском остеопоротических переломов и частичным нарушением микроархитектоники (TBS – 1,28). Пациентке рекомендован лираглутид для коррекции углеводного обмена и борьбы с ожирением. На фоне терапии оценена динамика показателей углеводного обмена, массы тела, костного метаболизма и костной массы. Проводилась коррекция дефицита витамина D.
За два года наблюдения гликированный гемоглобин снизился и сохранялся в пределах индивидуального целевого значения (5,9%), эпизоды гипогликемии не выявлены, сниженная масса тела в течение первого года лечения сохранялась и прогрессировала в течение всего периода наблюдения (-21 кг). Несмотря на значительное уменьшение массы тела, лираглутид оказал положительное влияние на костный метаболизм (снижение маркеров резорбции и повышение маркеров формирования) и минеральную плотность кости (по абсолютным значениям и TBS – 1,32).
Введение
На сегодняшний день наблюдается активный рост заболеваемости сахарным диабетом (СД), особенно СД 2 типа. Необходимость принятия экстренных мер для борьбы с диабетом привела к дальнейшему изучению его патофизиологических механизмов, разработке национальных стратегий по его профилактике и лечению. В современной литературе активно обсуждается влияние инкретиновой недостаточности и микробиоты кишечника на нарушение углеводного обмена. Значительное снижение инкретинового эффекта и, как следствие, увеличение уровня глюкозы в крови [1] стали толчком для создания новой группы сахароснижающих препаратов – ингибиторов дипептидилпептидазы 4 (иДПП-4) для продления периода полужизни эндогенного глюкагоноподобного пептида 1 (ГПП-1) и агонистов рецепторов ГПП-1 (арГПП-1) для имитации эффектов эндогенного инкретина.
При СД наблюдаются многочисленные метаболические нарушения, которые также приводят к изменению процессов костного ремоделирования и хрупкости кости.
Распространенность остеопороза среди пациентов с СД позволила считать его недооцененным осложнением диабета [2]. Учитывая увеличение количества пациентов с СД, можно прогнозировать повышение встречаемости вторичного остеопороза, который характеризуется не только снижением массы костной ткани, но и нарушением ее микроархитектоники.
Согласно данным исследований, при СД снижение плотности костной ткани на уровне остеопении выявляется в 30–67% случаев, остеопороз – в 7–47% [3–7]. Метаанализ 15 обсервационных исследований (11 когортных и четырех поперечных с включением 263 006 пациентов с СД и 502 115 без СД) показал, что СД 2 типа связан с повышенным риском перелома бедра (относительный риск (ОР) 1,296 при 95%-ном доверительном интервале (ДИ) 1,069–1,571), но не переломов тел позвонков (ОР 1,134 (95% ДИ 0,936–1,374)) [5]. При этом выявлена значительная гетерогенность исследований переломов бедра. Так, у пациентов с СД 2 типа использование количественного показателя трабекулярных костных структур (по TBS) повышало индивидуальную десятилетнюю вероятность переломов по FRAX. Поэтому TBS может быть одним из диагностических критериев для определения вероятности переломов. Российские исследователи обнаружили, что у пациентов с СД 2 типа по сравнению с контролем минеральная плотность костной ткани выше в поясничных позвонках (Т-критерий 0,44 (95% ДИ -3,2– -4,9) против 0,33 (95% ДИ -2,9– -3,0); p = 0,052) и бедренной кости (Т-критерий 0,51 (95% ДИ -2,1– -3,0) и -0,03 (95% ДИ -1,4– -1,2); p = 0,025). Десятилетняя вероятность переломов по FRAX и TBS достоверно не различалась в группах СД 2 типа и контроля. Однако при использовании в расчетах TBS она оказалась значимо выше в группе СД 2 типа. Так, средний индивидуальный десятилетний риск переломов составил 8,68 (95% ДИ 0,3–25,0) и 6,68 (95% ДИ 0,4–15,0) при p = 0,04 соответственно [8].
Влияют ли на метаболизм костной ткани инкретины?
О роли инкретинов в метаболизме костной ткани свидетельствует то, что примерно через 20 минут после приема пищи наблюдается снижение маркеров костной резорбции [9]. Показано, что эндогенные инкретины препятствуют развитию остеопороза и остеопении. Костнопротективное действие ГПП-1 связывают с кальцитонин-зависимым механизмом, так как в кости кальцитонин угнетает процессы резорбции [10]. Рецепторы глюкозозависимого инсулинотропного полипептида и ГПП-1 экспрессированы во многих органах и тканях, в том числе на клетках-предшественниках остеобластов. Поскольку существует взаимоисключающая связь между дифференцировкой адипоцитов и остеобластов из их общих клеток-предшественников, в костном мозге ГПП-1 вызывает клеточную пролиферацию и усиливает дифференцировку клеток по пути остеобластов, предотвращая дифференцировку в адипоциты [11].
Немаловажный вклад в костный метаболизм при СД вносят сахароснижающие препараты. Поэтому при выборе лекарственного средства необходимо учитывать не только его эффективность в снижении гликемии, но и профиль безопасности, дополнительные ожидаемые преимущества и другие практические аспекты [12]. Как известно, лираглутид, назначаемый для терапии СД 2 типа, также применяется при ожирении. Результаты зарубежных исследований, оценивавших влияние снижения массы тела на маркеры костного метаболизма, неоднозначны. Считается, что потеря массы тела в течение короткого периода времени может привести к потере костной массы и увеличению риска перелома костей. E.W. Iepsen и соавт. установили, что у 37 женщин в возрасте от 18 до 65 лет с индексом массы тела (ИМТ) 30–40 кг/м2 при соблюдении диеты (810 ккал/сут) в течение восьми недель снижение массы тела в среднем на 12,1 кг не привело к достоверным изменениям минеральной плотности кости [13]. Далее женщины были рандомизированы в группу лираглутида в дозе 1,2 мг/сут и группу диетотерапии (контроль). Через год в обеих группах масса тела в среднем снизилась на 12% от исходной. В группе лираглутида, у пациентов которой общая потеря массы тела была в четыре раза больше (р = 0,01), снижения минеральной плотности костной ткани по сравнению с группой контроля не обнаружено (р < 0,0001). У пациентов группы лираглутида в отличие от контрольной группы значимо увеличился уровень маркера формирования костной ткани N-терминального пропептида проколлагена 1 (P1NP) на 16 и 2% соответственно; р < 0,05. Маркер костной резорбции С-терминальный телопептид коллагена 1 (CTX-1) в данных группах существенно не изменился.
В экспериментальной работе у крыс со стрептозотоцин-индуцированным СД, крыс после овариэктомии и крыс со стрептозотоцин-индуцированным СД и после овариэктомии лираглутид значительно повышал уровень остеокальцина в сыворотке во всех трех моделях остеопороза, при этом минимально влиял на количество остеобластов. Лираглутид значительно снижал сывороточный уровень CTX-1 и количество остеокластов у крыс после овариэктомии и крыс со стрептозотоцин-индуцированным СД и после овариэктомии. На фоне терапии лираглутидом значительно уменьшилось соотношение RANKL/OPG во всех трех моделях остеопороза по сравнению с контролем, что указывает на лираглутид-ассоциированное ингибирование остеокластогенеза [14].
На основании предварительных результатов, демонстрирующих протективное влияние лираглутида на костную ткань, можно предположить его роль в поддержании здоровья костей у постменопаузальных женщин с СД 2 типа.
Клинический случай
Описание
Пациентка В. 1961 года рождения (55 лет) обратилась за консультацией по поводу избыточной массы тела, сухости во рту, общей слабости, повышения артериального давления максимум до 145/75 мм рт. ст.
Из анамнеза известно, что у пациентки с 36 лет избыточная масса тела (ИМТ – 27,8 кг/м2). При профилактическом обследовании в 53 года выявлена гипергликемия (глюкоза плазмы натощак – 7,2 ммоль/л). За консультацией к эндокринологу по месту жительства обратилась только через год. При дообследовании выявлен СД 2 типа, рекомендована диетотерапия и препарат из группы сульфонилмочевины. На фоне терапии отметила частые эпизоды гипогликемии в течение дня, в связи с чем препарат самостоятельно отменила через пару месяцев от начала приема. Гликемию контролировала редко, в основном натощак. За медицинской помощью не обращалась. Самостоятельно стала принимать метформин в дозе 2000 мг/сут. Однако терапия была прервана из-за выраженных диспепсических проявлений, таких как метеоризм и диарея. Больше никаких сахароснижающих препаратов не принимала.
Возраст наступления менопаузы – 52 года. Длительность постменопаузы – три года. Переломы костей отрицает. Наследственность по остеопорозу не отягощена.
Данные объективного обследования: рост – 164 см, масса тела – 94,5 кг, ИМТ – 35,1 кг/м2, окружность талии – 101,2 см. Кожные покровы и видимые слизистые оболочки бледные, периферических отеков нет. Дыхание везикулярное, хрипов нет. Тоны сердца ритмичные, гемодинамика стабильная. Живот без особенностей. Симптом Пастернацкого отрицательный с двух сторон. Незначительно усилен грудной кифоз в нижнегрудном отделе позвоночника. При пальпации область позвоночника без особенностей. Щитовидная железа мягко-эластичная, подвижная, безболезненная. Клинический эутиреоз. Артериальное давление – 145/85 мм рт. ст.
По данным лабораторно-инструментального обследования: глюкоза – 6,9 ммоль/л, гликированный гемоглобин – 7,4%, общий холестерин – 5,48 ммоль/л, липопротеины низкой плотности (ЛПНП) – 3,47 ммоль/л, липопротеины высокой плотности (ЛПВП) – 0,99 ммоль/л, триглицериды – 1,9 ммоль/л, креатинин – 67 мкмоль/л, мочевина – 4,3 ммоль/л, калий – 4,9 ммоль/л, кальций общий – 2,21 ммоль/л, фосфор – 1,0 ммоль/л, альбумин – 41,2 г/л, щелочная фосфатаза – 102 МЕ/л, кальцитонин < 2 нг/мл, 25(ОН)D – 18,4 нг/мл, тиреотропный гормон – 2,1 мкМЕ/мл, паратиреоидный гормон – 54 пг/мл, остеокальцин – 18,12 нг/мл, P1NP – 40 нг/мл, СТХ-1 – 0,59 нг/мл.
Дезоксипиридинолин/креатинин в моче – 6,6 нмоль/ммоль. Альбумин/креатинин в утренней порции мочи – 12,0 мг/г.
Показатели общеклинического анализа крови и мочи были в пределах референсных значений.
Поскольку пациентка проходит обследование и наблюдается по программе научно-исследовательской работы, оценены дополнительные параметры, не входящие в стандартное обследование пациентов с СД 2 типа, а именно сывороточные маркеры хронического системного воспаления: интерлейкин 6 – 8,15 пг/мл (< 7,0), С-реактивный белок – 6,2 мг/л (0–5).
Гликемия по данным самоконтроля: прандиальная – 6,3–7,2 ммоль/л, постпрандиальная – 8,1–11,3 ммоль/л.
При офтальмологическом осмотре выявлена диабетическая непролиферативная ретинопатия обоих глаз.
При проведении ультразвуковой допплерографии брахиоцефальных артерий – начальные проявления атеросклеротического поражения сонных артерий в виде утолщения комплекса «интима – медиа» без гемодинамически выраженного стеноза.
Минеральную плотность кости в поясничных позвонках (L1–L4), шейке (neck) и проксимальном отделе бедренной кости в целом (total hip) измеряли с помощью двухэнергетической рентгеновской абсорбциометрии на аппарате GE LUNAR Prodigy. Выявлено ее снижение. Т-критерий в L1–L4 до -2,3 стандартного отклонения (СО), в total hip – до -2,1 СО, в neck – до -2,3 СО. TBS – 1,28. Абсолютное значение минеральной плотности кости в шейке бедра составило 0,934 г/см2.
Десятилетний абсолютный риск переломов был рассчитан по FRAX. Риск основных остеопоротических переломов составил 4,6%, риск перелома проксимального отдела бедра – 0,4%. При использовании FRAX с поправкой на TBS риск основных остеопоротических переломов составил 5,1%, риск перелома проксимального отдела бедра – 0,4%.
На основании результатов проведенного обследования рекомендованы расширенный режим физических нагрузок, диетотерапия (исключение легкоусвояемых углеводов, ограничение потребления животного жира и поваренной соли, соблюдение адекватного водного режима) и медикаментозная терапия. Последняя была направлена на коррекцию:
- веса и углеводного обмена: предпочтение отдано препарату из группы арГПП-1 лираглутиду, учитывая непереносимость метформина, наличие ожирения и костнопротективную способность препарата. Согласно инструкции, начальная доза лираглутида составила 0,6 мг для адаптации к лечению и снижения транзиторного побочного эффекта (тошноты) с титрацией дозы до лечебной – 1,8 мг/сут;
- артериальной гипертензии (периндоприл 4 мг/сут);
- дислипидемии (аторвастатин 10 мг);
- дефицита витамина D (колекальциферол 50 000 МЕ/нед).
В течение первого месяца наблюдения показатели гликемии и артериального давления контролировали по дневнику самоконтроля. Через три месяца на фоне проводимой терапии по данным лабораторного исследования отмечено улучшение углеводного и липидного обмена, увеличение концентрации 25(ОН)D. За три месяца терапии пациентка снизила массу тела на 6,8 кг, была отмечена тенденция к гипотонии, в связи с чем отменен прием периндоприла.
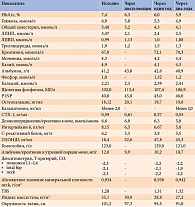
В дальнейшем на фоне терапии положительная динамика прогрессировала (таблица). В течение шести месяцев лечения нормализовались показатели гликемии (без эпизодов гипогликемии) и липидного профиля. Показатели фосфорно-кальциевого обмена оставались в пределах нормы. Отмечено также выраженное снижение маркеров воспаления (С-реактивного белка, интерлейкина 6). Масса тела уменьшилась еще на 4,1 кг. Окружность талии – на 3,9 см. Значения артериального давления оставались в норме без антигипертензивной терапии. В связи с компенсацией субоптимальных уровней 25(ОН)D недельная доза колекальциферола уменьшена до поддерживающей, отменен аторвастатин (учитывая желание пациентки). На фоне терапии повысились маркеры костного ремоделирования (как формирования, так и резорбции). Несмотря на это, рекомендовано продолжить терапию.
Динамика лабораторно-инструментальных показателей через один и два года представлена в таблице.
Согласно полученным результатам, у пациентки в постменопаузе терапия лираглутидом способствовала не только нормализации углеводного обмена (гликированный гемоглобин в пределах индивидуальных целевых значений без эпизодов гипогликемии при самоконтроле), эффективному снижению массы тела (на 21 кг за два года) и уменьшению окружности талии (на 10,2 см за два года), но и стабилизации достигнутых показателей в течение длительного периода времени, что отвечает современным требованиям к лечению СД 2 типа и ожирения. За период наблюдения сохранялись целевые значения артериального давления и липидного профиля без дополнительной соответствующей терапии.
При повторной консультации офтальмолога через год диабетическая непролиферативная ретинопатия обоих глаз без отрицательной динамики.
При повторном проведении ультразвуковой допплерографии брахиоцефальных артерий через год обнаружено уменьшение толщины комплекса «интима – медиа».
Несмотря на повышение маркеров костного ремоделирования через шесть месяцев терапии, потеря массы тела не стала независимым фактором риска развития остеопороза и ухудшения костного метаболизма.
За два года наблюдения улучшилось костное ремоделирование, о чем свидетельствовали снижение уровня маркеров резорбции и повышение маркеров формирования костной ткани, а также увеличение минеральной плотности кости по абсолютным значениям и индексу структурности (см. таблицу). Из всех показателей, характеризующих костный обмен, через два года лечения лираглутидом выраженное снижение отмечено для маркера костной резорбции «дезоксипиридинолин/креатинин» и повышение для маркера формирования костной ткани P1NP. Показатели фосфорно-кальциевого обмена оставались в референсном диапазоне. На фоне терапии также обнаружено значимое снижение маркеров хронического системного воспаления, что в свою очередь может оказывать существенное влияние на ремоделирование костной ткани.
Обсуждение результатов
Возрастная инволюция репродуктивной системы и происходящая гормональная перестройка приводят к выраженным изменениям композиционного состава тела, что еще больше усугубляет метаболические расстройства у пациентов с СД 2 типа.
Нарушение плотности и микроархитектоники костной ткани (в том числе при нормальной и повышенной минеральной плотности кости) являются недооцененными или незамеченными осложнениями СД 2 типа, требующими ранней диагностики и коррекции, особенно в постменопаузальном периоде. При ожирении минеральная плотность костной ткани может оставаться в пределах относительной нормы в результате артефактов при увеличении толщины живота [15]. Учитывая эти особенности и патофизиологические различия, TBS является альтернативным показателем качества костной ткани. Установлено, что TBS ниже у пациентов с СД 2 типа по сравнению с лицами без данного заболевания, не зависит от минеральной плотности кости и является прогностическим критерием переломов при вторичном остеопорозе [16–19]. При оценке индивидуальной десятилетней вероятности переломов по FRAX у пациентов с диабетом результат может быть занижен [18], в связи с чем требуется поправка с учетом TBS. При риске/наличии вторичного остеопороза сочетание ТBS с оценкой минеральной плотности кости увеличивает прогностическую ценность методов и является наиболее чувствительным методом у пациентов с СД 2 типа, нуждающихся в лечении остеопороза.
В продемонстрированном случае у пациентки с СД 2 типа диагностирована остеопения с низким десятилетним риском остеопоротических переломов и частичным нарушением микроархитектоники костной ткани (TBS – 1,28). Поэтому антиостеопоротические препараты не были назначены.
При выборе сахароснижающей терапии у пациентов с СД 2 типа и избыточной массой тела необходимо отдавать предпочтение эффективным препаратам с низким риском гипогликемии, способным контролировать массу тела и характеризующимся минимальными побочными реакциями. Инкретины превосходят традиционные пероральные гипогликемические препараты по эффективности и переносимости. Не следует игнорировать ятрогенный фактор, влияющий на костный метаболизм. В официальном заявлении экспертов Американской диабетической ассоциации отмечено, что лечение каждого пациента индивидуально. Необходимо оценить анамнез переломов и факторы риска развития остеопороза, при необходимости провести оценку минеральной плотности кости, избегать назначения препаратов, отрицательно влияющих на костную ткань [12]. Последние данные свидетельствуют о нейтральном и положительном влиянии инкретинов (иДПП-4 и арГПП-1) на метаболизм костной ткани. Однако для большей доказательности воздействия препаратов на костную ткань и риск переломов требуется проведение долгосрочных исследований. В отличие от инкретинов ингибиторы натрий-глюкозного котранспортера 2, тиазолидиндионы и препараты из группы сульфонилмочевины продемонстрировали отрицательное влияние на показатели костного обмена. Так, ингибитор натрий-глюкозного котранспортера 2 канаглифлозин увеличивал частоту переломов верхних конечностей [20]. Тиазолидиндионы ингибировали дифференцировку остеобластов и усиливали дифференцировку адипоцитов и остеокластов [20, 21]. Производные сульфонилмочевины ассоциировались с более высокой частотой переломов [22]. В отношении метформина получены противоречивые результаты. По одним данным, у получавших его существенно снижался риск переломов (ОР 0,7 (95% ДИ 0,6–0,96)) [23]. По другим – метформин не оказывал остеогенного и антиостеогенного воздействия [24].
Для реализации комплексного подхода: коррекции гипергликемии без риска гипогликемии, массы тела и костного метаболизма – в качестве сахароснижающей терапии пациентке был назначен арГПП-1 лираглутид. На фоне его применения нормализовались углеводный и липидный обмен, артериальное давление, снизилась масса тела (-21 кг) и уменьшилась окружность талии (-10,2 см).
В исследованиях по выявлению факторов риска развития остеопороза показано, что потеря массы тела может рассматриваться как независимый фактор риска развития остеопороза, особенно у женщин в постменопаузальном периоде. Для оценки возможного отрицательного влияния прогрессивного снижения массы тела на костное ремоделирование и минеральную плотность кости в представленном случае контролировалась динамика показателей костного метаболизма и костной массы. Через шесть месяцев терапии и снижения массы тела на 4,1 кг отмечено повышение маркеров как резорбции, так и формирования костной ткани без сохранения данной тенденции в течение всего периода наблюдения, несмотря на дальнейшее снижение массы тела – на 21 кг за два года. Потеря массы тела не стала независимым фактором риска развития остеопороза и ухудшения костного метаболизма. За период наблюдения выявлено улучшение костного ремоделирования (снижение уровня маркеров резорбции и повышение маркеров формирования). Наиболее выраженно изменились маркер костной резорбции «дезоксипиридинолин/креатинин в моче» (снижение на 12%), формирования костной ткани P1NP (повышение на 15%). Отмечено незначительное, но улучшение минеральной плотности кости по абсолютным значениям и индексу структурности. Полученные результаты согласуются с данными Г.А. Мельниченко и соавт., продемонстрировавших, что длительное лечение ожирения у женщин в постменопаузе орлистатом не оказывало отрицательного влияния на минеральную плотность кости и уровень маркеров костного метаболизма [25]. Аналогичные данные получены E.W. Iepsen и соавт. [13]: потеря массы тела на 12% от исходной на фоне терапии лираглутидом не приводила к снижению минеральной плотности костной ткани. В группе лираглутида также зафиксировано увеличение P1NP на 16% (р < 0,05). В группе диетотерапии данный показатель увеличился только на 2%.
В нашем случае положительную динамику костного метаболизма можно также объяснить нормализацией углеводного и липидного обмена. Однако в экспериментальных работах показано, что улучшение контроля глюкозы не всегда приводит к лучшим результатам в отношении скелета. Выше было сказано [14], что протекция костной ткани лираглутидом у недиабетических грызунов происходила не из-за его антидиабетических свойств. В первом рандомизированном исследовании ACCORD по оценке влияния интенсивной терапии гликемии на переломы и падения установлено, что интенсивный контроль гликемии оказывает нейтральное влияние на минеральную плотность кости, риск переломов позвонков и падения [26]. Необходимо отметить, что длительность наблюдения в исследовании ACCORD составила 3,8 года.
Не только активное воспаление, но и хроническое системное воспаление оказывает существенное влияние на ремоделирование костной ткани. Воспаление модулирует костную резорбцию главным образом за счет способности провоспалительных цитокинов вызывать дисбаланс в системе «RANKL/OPG», стимулируя остеокластогенез [27]. Лираглутид значительно уменьшает соотношение «RANKL/OPG» при разных экспериментальных моделях остеопороза, что указывает на лираглутид-ассоциированное ингибирование остеокластогенеза [14].
В представленном случае терапия лираглутидом способствовала значимому снижению маркеров хронического системного воспаления – интерлейкина 6 на 28,8%, С-реактивного белка на 43,5%. Это в свою очередь оказало положительное влияние на ремоделирование костной ткани.
За период наблюдения у пациентки был компенсирован дефицит витамина D. Его значения поддерживались в пределах целевого диапазона, что вносило дополнительный вклад в улучшение костного метаболизма и состояния организма в целом.
Заключение
Нарушение плотности и микроархитектоники костной ткани является недооцененным осложнением СД 2 типа, требующим ранней диагностики и вмешательства. При выборе оптимальной сахароснижающей терапии необходимо учитывать эффективность препаратов, дополнительные их преимущества и отдавать предпочтение не повышающим риск переломов. Описанный клинический случай свидетельствует, что терапия арГПП-1 лираглутидом не только способствует снижению гликемии, массы тела у женщины в постменопаузальном периоде, но и позволяет стабилизировать положительные результаты в течение длительного периода времени, что отвечает современным требованиям к лечению СД 2 типа и ожирения. Кроме того, препарат оказывает положительное влияние на костный метаболизм и минеральную плотность кости. Однако для понимания механизмов такого воздействия на костную ткань и риск переломов требуется проведение долгосрочных исследований.
Автор декларирует отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
L.V. Egshatyan, PhD
A.S. Loginov Moscow Clinical Scientific and Practical Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
National Medical Research Center for Endocrinology
Contact person: Lilit V. Egshatyan, lilit.egshatyan@yandex.ru
Diabetes mellitus has been associated with increased fracture risk. Shared mechanisms for increased fracture risk include accumulation of advanced glycation end-products, chronic hyperglycemia, poor blood glucose control, insulin deficiency, high propensity for falls, incretin effects decrease etc. Some medications used to treat diabetes mellitus can modulate fracture risk. Liraglutide is a glucagon-like peptide-1 receptor agonists (analogue) and has been approved for the treatment of type 2 diabetes and obesity. It appears that treatment with liraglutide makes it possible to lose weight and maintain the beneficial effect on the bones.
In this article, we present a case of type 2 diabetes and osteopenia in a 55-year-old caucasian postmenopausal (since 52-year-old) female. In baseline, the body weight was 94.5 kg, body mass index 35.1 kg/m2, waist circumference 101.2 cm. Laboratory investigations showed vitamin D deficiency 18.4 ng/ml, high HbA1c level 7.4%. Indicators of calcium-phosphorus and bone metabolism markers were within the reference range. DEXA revealed osteopenia with a low 10-years risks of osteoporotic fractures by FRAX and partial destruction of bone microarchitecture (trabecular bone score, TBS = 1.28). To investigate the effect of the liraglutide on bone turnover and bone mass in this patient. For the treatment of vitamin D deficiency was recommended cholecalciferol. During the follow-up period (2 years) glycated hemoglobin remained within the individual target value (5.9%), without hypoglycemic episodes. Body weight (-21 kg) and waist circumference (-10.2 cm) were significantly reduced over the study period. Despite the age-related involution of the reproductive system and a significant reduction in the body weight, treatment with liraglutide had a positive effect on the bone metabolism and bone mineral density (TBS = 1.32).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.