Критерии оценки современных методов диагностики меланоцитарных новообразований кожи с использованием индекса обоснованных биопсий
- Аннотация
- Статья
- Ссылки
- English
В связи с возможной гипердиагностикой и резко возросшим количеством выполняемых биопсий зарубежные исследователи широко используют индекс обоснованных биопсий – Number Needed to Biopsy, NNB. Использование данного показателя позволяет судить о компетенции конкретного врача и специализированного учреждения в целом.
Материал и методы. Проведено ретроспективное исследование электронной первичной документации 249 пациентов с направлением на биопсию по поводу диагноза «невус Кларка», или «диспластический невус», код по Международной классификации болезней 10-го пересмотра Z-03.1 и D22. Индекс обоснованных биопсий рассчитывался делением общего количества удаленных новообразований кожи на количество патоморфологически подтвержденной меланомы кожи.
Результаты. Диагноз меланомы установлен 62 пациентам. Медиана толщины опухоли по Бреслоу в 2018 г. составила 0,8 [0,5; 1,5] мм, в 2019-м – 0,4 [0,28; 0,69] мм, p (U-критерий Манна – Уитни) – 0,00046. Индекс обоснованных биопсий, необходимый для постановки диагноза меланомы, составил 4,0.
Заключение. Индекс обоснованных биопсий рекомендуется использовать при фиксированных критериях включения в отчетность пациентов в рамках одного учреждения для динамического сравнения эффективности его работы.
В связи с возможной гипердиагностикой и резко возросшим количеством выполняемых биопсий зарубежные исследователи широко используют индекс обоснованных биопсий – Number Needed to Biopsy, NNB. Использование данного показателя позволяет судить о компетенции конкретного врача и специализированного учреждения в целом.
Материал и методы. Проведено ретроспективное исследование электронной первичной документации 249 пациентов с направлением на биопсию по поводу диагноза «невус Кларка», или «диспластический невус», код по Международной классификации болезней 10-го пересмотра Z-03.1 и D22. Индекс обоснованных биопсий рассчитывался делением общего количества удаленных новообразований кожи на количество патоморфологически подтвержденной меланомы кожи.
Результаты. Диагноз меланомы установлен 62 пациентам. Медиана толщины опухоли по Бреслоу в 2018 г. составила 0,8 [0,5; 1,5] мм, в 2019-м – 0,4 [0,28; 0,69] мм, p (U-критерий Манна – Уитни) – 0,00046. Индекс обоснованных биопсий, необходимый для постановки диагноза меланомы, составил 4,0.
Заключение. Индекс обоснованных биопсий рекомендуется использовать при фиксированных критериях включения в отчетность пациентов в рамках одного учреждения для динамического сравнения эффективности его работы.
Введение
Меланома относится к одной из агрессивных опухолей кожи. Последнее десятилетие заболеваемость меланомой увеличилась во всем мире [1, 2]. При стабильных показателях смертности, связанной с меланомой, ежегодный рост заболеваемости может быть обусловлен как расширением диагностических возможностей с привлечением дерматологов, владеющих дерматоскопией, так и гипердиагностикой [3]. Из-за резко возросшего количества выполняемых биопсий в настоящее время, наряду со статистическими показателями, зарубежные исследователи широко используют индекс обоснованных биопсий – Number Needed to Excise (NNE), или Number Needed to Treat (NNT). Данный индекс представляет собой отношение количества новообразований кожи, подвергнутых различным видам биопсии, к количеству подтвержденных впоследствии злокачественных новообразований [4]. Этот показатель может рассчитываться как для всех злокачественных новообразований кожи в целом, так и для определенных нозологий отдельно, например только для меланомы [5].
Индекс обоснованных биопсий широко варьируется в зависимости от опыта и специальности врача, клинических условий его работы, степени онкологической настороженности, навыков владения дерматоскопией, а также диагностируемых нозологических единиц [6–12]. Помимо этого показатель ассоциируется с анамнестическими данными пациента, его тревожностью и локализацией новообразования [11].
Цифровая интерпретация способности специалиста диагностировать меланому крайне важна. Частые необоснованные биопсии увеличивают количество ложноположительных результатов, которые могут приводить пациентов к эмоциональному и психологическому стрессу. Количественное выражение этого показателя наряду с медицинскими и этическими параметрами может давать объективную оценку экономической составляющей проводимых биопсий в клинических условиях.
M. Matsumoto и соавт. (2018 г.), исследовав показатели NNS (number needed to screen) и NNB (number needed to biopsy), сделали вывод, что для экономической выгоды и диагностической эффективности скрининг должен быть ориентирован на целевую группу пациентов. При подозрении на злокачественное новообразование кожи врач первичного звена направляет пациента к дерматологу [13].
Внедрение в клиническую практику службы телемедицинского консультирования и теледерматоскопии, в частности, способствует уменьшению количества необоснованных биопсий при подозрении на меланому. Использование теледерматологии позволило экспертам из специализированного референсного центра в Новой Зеландии каждому четвертому пациенту установить диагноз меланомы с преобладанием ранних форм.
M. Sundarland и соавт. (2020 г.) оценили данные электронных направлений за 2016 г., которые включали информацию об анамнестических данных, описание клинической картины, фотографии подозрительного новообразования, результаты биопсии. 72% пациентов были немедленно или после предварительного проведения теледерматоскопии направлены на срочную диагностическую биопсию. У 24,8% из них морфологически подтвердился диагноз меланомы и меланомы in situ в соотношении 1:1,18 при индексе NNE 2,6 [14].
В Российской Федерации данные о вычислении индекса обоснованных биопсий до настоящего момента в анализируемой литературе не были представлены.
Целью исследования стало определение результатов работы специализированного центра с использованием индекса обоснованных биопсий меланоцитарных новообразований кожи.
Материал и методы
Ретроспективное когортное исследование электронной первичной документации проводилось на базе Научно-практического центра диагностики и лечения опухолей кожи (НПЦ) Университетской клиники ФГБОУ ВО «Приволжский исследовательский медицинский университет» Минздрава России.
Период исследования – с января 2018 г. по декабрь 2019 г.
Материалом для анализа послужили электронные медицинские карты пациентов с новообразованиями кожи в медицинской информационной системе «Медиалог 7» (Пост Модерн Текнолоджи). Были сформированы электронные отчетные таблицы, включавшие следующие параметры запроса: ID пациента, пол, возраст, вид биопсии, клинический направляющий диагноз на патоморфологическое исследование и его код по Международной классификации болезней 10-го пересмотра (МКБ-10), дату и гистологическое заключение с кодом МКБ-10. Патоморфологические заключения были составлены согласно стандартам оформления протоколов Американской ассоциации патологов и клиническим рекомендациям Российской Федерации [1–4, 15–18].
К полученным данным были разработаны критерии включения и исключения. Критериями включения стали:
- возраст старше 18 лет;
- наличие меланоцитарного новообразования кожи;
- направляющий диагноз на биопсию «невус Кларка», или «диспластический невус», код по МКБ-10 Z-03.1 и D22;
- инцизионная или эксцизионная биопсия, выполненная в амбулаторных условиях;
- пациенты, направленные в НПЦ от дерматолога или самостоятельно обратившиеся для динамического осмотра.
Критерии исключения:
- возраст пациентов младше 18 лет;
- пациенты с диагнозом «меланома» и кодом по МКБ-10 С43;
- пациенты с немеланоцитарными новообразованиями кожи;
- пациенты, которым невусы были удалены по эстетическим показаниям.
Индекс обоснованных биопсий (ИОБ) рассчитывался делением общего количества удаленных новообразований кожи (УНК) на количество патоморфологически подтвержденной меланомы кожи (ПатМел): ИОБ = УНК/ПатМел.
Статистический анализ
Использовалось медианное значение среди всех значений толщины опухоли по Бреслоу, рассчитанных для каждой группы пациентов за 2018 и 2019 гг. Результаты выражены как Me [Q1; Q3], где Me – медиана толщины опухоли в мм и [Q1; Q3] – значения 25-го и 75-го процентилей соответственно.
Чтобы различать группы пациентов по толщине опухоли, мы использовали U-критерий Манна – Уитни с условием, что между сравниваемыми группами различий нет.
Результаты
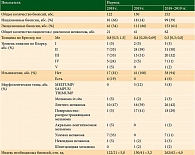
Согласно критериям включения, были проанализированы данные о 249 пациентах. Выполнены 252 биопсии, из них 99 инцизионных, 153 эксцизионные.
Количество проведенных биопсий за исследуемый период различалось незначительно: 122 – в 2018 г., 130 – в 2019 г. Эксцизионных биопсий в 2019 г. проведено больше, чем в 2018 г., – 112 и 41 соответственно. Структура исследуемого архива представлена в таблице.
Меланома диагностирована у 62 пациентов: 34% случаев в 2018 г., 66% – в 2019-м. Медиана толщины опухоли по Бреслоу в 2018 г. составила 0,8 [0,5; 1,5] мм, в 2019-м – 0,4 [0,28; 0,69] мм, p (U-критерий Манна – Уитни) 0,00046 (таблица).
59% меланом, зарегистрированных в 2019 г., соответствовали второму уровню инвазии по Кларку, ни одна из меланом не сопровождалась изъязвлением. Среди морфологических типов большинство патоморфологических диагнозов составили лентиго-меланомы (в 2018 г. – 10 (47%), в 2019-м – 16 (39%)) и поверхностно-распространяющиеся меланомы (в 2018 г. – 1 (5%), в 2019-м – 17 (41%)). В 2019 г. в отличие от 2018 г. в патоморфологических заключениях имели место диагностические категории MELTUMP (5 (12%)) и отсутствовали узловые меланомы (таблица).
Специалисты центра во всех направлениях на биопсию указывали диагноз «диспластический невус».
Индекс обоснованных биопсий, необходимый для постановки диагноза меланомы, за наблюдаемый период составил 4,0 (таблица).
Обсуждение
С расширением круга специалистов, консультирующих пациентов с новообразованиями кожи, и внедрением новых методов диагностики возникает вопрос о возможной гипердиагностике меланомы и, как следствие, увеличении хирургической активности.
M.A. Weinstock и соавт. (2017 г.) провели поперечное исследование для оценки взаимосвязи между количеством биопсий кожи и частотой возникновения инвазивных форм меланомы и меланомы in situ по базе данных SEER-Medicare за 2002–2009 гг. За восьмилетний период частота биопсий кожи увеличилась примерно на 50% (6% в год). За тот же период общий уровень заболеваемости меланомой возрос примерно на 4%. В среднем на каждую тысячу выполненных биопсий кожи диагностировались 5,2 случая меланомы in situ и 8,1 случая инвазивной меланомы. Таким образом, было продемонстрировано, что высокая хирургическая активность не всегда оправданна [3]. Оценить возможности гипердиагностики и качество оказания специализированной помощи можно, используя индекс обоснованных биопсий.
A. Privalle и соавт. (2020 г.) провели анализ консультативных и патоморфологических записей и сравнили показатель NNB среди врачей различных специальностей и с разным опытом диагностики новообразований кожи. Согласно полученным результатам, опытные дерматологи реже прибегают к биопсии для установления диагноза немеланомного рака кожи (NNB 2,0). NNB для меланомы составил 14,33 [4].
A.J. Petty и соавт. в метаанализе за 2020 г. показали, что у специалистов по новообразованиям кожи показатели NNB в 1,77 раза лучше, чем у дерматологов (95%-ный доверительный интервал 1,01–3,09; p = 0,045) [6].
Уровень подготовки врачей лишь один из факторов, определяющих показатели NNB в клинических условиях.
K.C. Nelson и соавт. (2019 г.) при проведении систематического обзора и метаанализа указали на необходимость стандартизации отчетности NNB и выделения минимального количества значимых критериев для объективного сравнения NNB в разных публикациях. Среди обязательных критериев были названы специальность и опыт клиницистов, использование дерматоскопии, критерии включения, методы извлечения и проверки данных, отчетность по количеству доброкачественных и злокачественных новообразований кожи [5]. Дополнительные факторы – регулярные образовательные программы скрининга меланомы среди врачей, поскольку даже эксперты по новообразованиям кожи не достигают идеальной точности в диагностике меланомы [5, 19].
Образовательная деятельность НПЦ среди дерматологов, информирование населения, ориентирование пациентов на обращение к врачу-дерматологу по поводу новообразований кожи способствовали увеличению количества пациентов (целевая группа), обращающихся в узкоспециализированный центр. Комплексное использование современных неинвазивных методов диагностики, таких как дерматоскопия, мультифотонная томография, оптическая когерентная томография и оптическая ангиография, имеет высокий диагностический потенциал в дифференциальной диагностике сомнительных меланоцитарных новообразований кожи [20–23].
Уменьшение индекса обоснованных биопсий за период исследования сопровождалось появлением прогностически благоприятных патоморфологических характеристик меланомы, таких как превалирование тонких поверхностно-распространяющихся меланом или лентиго-меланом с толщиной опухоли менее 1,0 мм, первым-вторым уровнем инвазии по Кларку, отсутствием изъязвления, появлением новых диагностических категорий опухолей с неясным злокачественным потенциалом, таких как MELTUMP/SAMPUS/THIMUMP [24].
Полученные результаты отражают положительную динамику квалифицированной помощи пациентам с меланоцитарной патологией кожи за исследованный период.
Заключение
Индекс обоснованных биопсий рекомендуется использовать при фиксированных критериях включения в отчетность пациентов в рамках одного учреждения для динамического сравнения эффективности его работы. Этот показатель позволяет провести объективную оценку эффективности клинической работы как специализированного центра в целом, так и каждого специалиста отдельно.
O.Ye. Garanina, PhD, I.A. Klemenova, PhD, I.L. Shlivko, PhD, I.S. Makarychev, Yu.A. Yevseyeva
Privolzhsky Research Medical University
Contact person: Oksana Ye. Garanina, oksanachekalkina@yandex.ru
Introduction. Melanoma incidence, one of the aggressive skin tumors, has increased in recent decades all over the world. Due to possible overdiagnosis and the sharply increased number of biopsies, the term Number Needed to Biopsy, NNB, is widely used by foreign researchers. This index can help to determine the competence of a specialist and medical institution.
Material and methods. A retrospective study of electronic primary documentation of 249 patients with a directing diagnosis for a biopsy of Clark’s nevus, or dysplastic nevus, with ICD-10 code Z-03.1 and D22 was carried out for the period 2018-19. The number needed to biopsy was calculated as the number of biopsied lesions divided by histologically-proven melanoma.
Results. 62 patients were diagnosed with melanoma. The median of the tumor Breslow thickness was 0.8 [0.5; 1.5] mm – in 2018 and 0.4 [0.28; 0.69] mm – in 2019, p (Mann-Whitney U-test) = 0.00046. The number needed to biopsy for 2018-19 was 4.0.
Conclusion. The number needed to biopsy is recommended for dynamic comparison of the effectiveness of clinic work, but if fixed calculation criteria will be used.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.