Лазерная допплеровская флоуметрия и флуоресцентная спектроскопия как методы оценки доклинических проявлений синдрома диабетической стопы
- Аннотация
- Статья
- Ссылки
- English
Одна из самых важных задач современной медицины – предотвратить развитие этих осложнений, в том числе благодаря своевременной диагностике.
В статье рассматриваются возможности лазерной допплеровской флоуметрии и флуоресцентной спектроскопии в выявлении доклинических проявлений синдрома диабетической стопы.
Одна из самых важных задач современной медицины – предотвратить развитие этих осложнений, в том числе благодаря своевременной диагностике.
В статье рассматриваются возможности лазерной допплеровской флоуметрии и флуоресцентной спектроскопии в выявлении доклинических проявлений синдрома диабетической стопы.





Количество больных сахарным диабетом (СД) за последние десять лет увеличилось более чем в два раза. Столь стремительный рост заболеваемости стал причиной принятия Организацией Объединенных Наций в 2006 г. резолюции о сахарном диабете, а в 2011 г.– политической декларации, призывающей создавать многопрофильные стратегии для профилактики развития неинфекционных заболеваний и борьбы с ними, в частности в отношении СД как одной из ведущих причин инвалидизации и смерти [1].
В Российской Федерации, как и во всех странах мира, отмечается значительное повышение распространенности СД. По данным федерального регистра, в 2016 г. на диспансерном учете состояло 4,35 млн больных СД (3,0% населения). При этом насчитывалось 4 млн (92%) пациентов с СД 2 типа, 255 тыс. (6%) – с СД 1 типа и 75 тыс. (2%) пациентов с другими типами СД [1].
Сахарный диабет представляет собой хроническое, постоянно прогрессирующее заболевание, приводящее к развитию ряда осложнений, прежде всего микро- и макрососудистых.
Наиболее распространенным микрососудистым осложнением признана диабетическая ретинопатия. Она встречается практически у всех пациентов с СД длительностью более 20 лет [2, 3]. Еще одно опасное микрососудистое осложнение – диабетическая нефропатия. В 40–50% случаев ею обусловлено развитие терминальной стадии почечной недостаточности. На фоне терминальной стадии почечной недостаточности у трети пациентов развиваются серьезные осложнения, требующие в ряде случаев проведения гемодиализа [4]. Однако наиболее грозным микрососудистым осложнением является синдром диабетической стопы (СДС). Так, СДС ассоциируется с развитием язвенно-некротических процессов и гангрены стопы. До 75% выполняемых ампутаций нижних конечностей в мире связано с СДС [5, 6].
СДС ухудшает качество жизни больных [7], а также увеличивает риск инвалидизации и смерти [8–10]. Все это обусловливает повышение медицинских расходов [11].
Синдром диабетической стопы диагностируется у 15–25% больных СД. Его развитие обусловлено патологическими изменениями периферической нервной системы, артериального и микроциркуляторного русла, костно-суставного аппарата стопы.
К группе риска развития СДС относятся пациенты с дистальной полинейропатией, заболеваниями периферических артерий любого генеза, деформацией стоп, слепые и слабовидящие, пациенты с диабетической нефропатией и хронической болезнью почек третьей стадии и выше, пожилые лица, а также лица, злоупотребляющие алкоголем и табачной продукцией.
По данным Международной диабетической федерации, проблема ранней диагностики и мониторинга эффективности лечения при СД является одной из самых приоритетных.
В этой связи представляется неоспоримым потенциал комбинированной, одновременной оценки доставки крови в систему микроциркуляции методом лазерной допплеровской флоуметрии (ЛДФ) и окислительного метаболизма по биомаркерам – коферментам ткани способом лазерной флуоресцентной спектроскопии (ЛФС). Сочетание указанных методов диагностики позволяет оценить риск развития синдрома диабетической стопы [12].
Система микроциркуляции – одна из важных систем, по состоянию которой можно выявлять болезни на ранних стадиях. Необходимо отметить, что нарушения микроциркуляции могут быть не только вторичными, но и первичными, то есть обусловливать развитие ряда заболеваний и определять их исход. С теми или иными нарушениями отдельных звеньев микроциркуляции связано развитие атеросклероза, артериальной гипертензии, эндотоксемии и сепсиса, диабетической нефропатии, венозной недостаточности, диабетической ангиопатии нижних конечностей.
Мониторирование микроциркуляторной функции в клинике ограничено как из-за небольшого числа безопасных методов исследования, так и из-за сложности интерпретации данных [13]. В отличие от других методов исследования ЛДФ является безопасным методом оценки микроциркуляторной функции нижних конечностей, поскольку параметры кровотока определяются неинвазивно. С помощью ЛДФ можно исследовать такие звенья гемомикроциркуляторного русла, как артериолы, терминальные артериолы, капилляры, посткапиллярные венулы, венулы и артериоло-венулярные анастомозы [14–16].
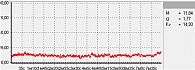
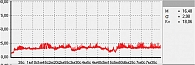
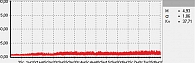
Для оценки состояния микроциркуляции крови применяются следующие характеристики перфузии ткани кровью [17]:
- М – средняя величина потока крови, в относительных перфузионных единицах, характеризует среднюю перфузию;
- σ – среднее колебание перфузии крови в результате изменения сосудистого тонуса в микроциркуляторном русле, в перфузионных единицах;
- Кv – коэффициент вариации, характеризует зависимость изменения сосудистого тонуса от среднего значения кровотока.
Последний показатель рассчитывается по следующей формуле: Кv = σ : М × 100%.
В данной работе исследования проводились на подошвенной поверхности большого пальца ноги. Показатели микроциркуляции признаются нормальными, если М находится в пределах референсных значений – от пяти до 15 перфузионных единиц. При компенсаторном повышении микроциркуляции вследствие снижения энергетического метаболизма М превышает 15 перфузионных единиц, при снижении микроциркуляции из-за невозможности микроциркуляторного русла компенсировать нарушения энергетического метаболизма М не превышает пяти перфузионных единиц (рис. 1–3).
Митохондриальный стресс (нарушение окислительного метаболизма) – основной медиатор нейродегенерации при СД. Высокий уровень глюкозы в тканях обусловливает накопление в митохондриях восстановленного никотинамидадениндинуклеотида (НАДН). Увеличение доступности электронов (-e) и/или насыщенности митохондрий электронами может вызвать парциальное восстановление кислорода до супероксиданион-радикала в начальной части электронной транспортной цепи. Последующий подъем активных форм кислорода вызывает дегенеративные изменения тканей. Возрастание [Ca2+]m в клетках также может увеличить продукцию НАДН энзимами цикла Кребса – пируватдегидрогеназой, изоцитратдегидрогеназой, альфа-кетоглютаратдегидрогеназой. Дисбаланс редокс-системы (нарушение соотношения НАДН и никотинамидадениндинуклеотида (НАД)), окислительный стресс (образование свободных радикалов) и митохондриальный стресс также участвуют в повреждении тканей при СД.
Вазодилатация и усиление кровотока – характерные ранние сосудистые реакции на острую гипергликемию и тканевую гипоксию [18, 19].
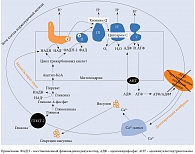
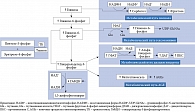
Механизм увеличения продукции НАДН представлен на рис. 4 [20]. В бета-клетках поджелудочной железы глюкоза является не только энергетическим субстратом, но и стимулятором секреции инсулина [21–24]. Глюкоза транспортируется в бета-клетки глюкозным транспортером (ГЛЮТ) 2-го типа. Внутри клетки глюкоза фосфорилируется глюкокиназой с образованием глюкозо-6-фосфата [25, 26], который посредством гликолитического пути превращается в две молекулы пирувата. В дальнейшем пируват переносится в митохондрии и превращается в ацетилкофермент А (ацетил-КоА) пируватдегидрогеназным комплексом. Далее ацетил-КоА поступает в цикл трикарбоновых кислот, а полученные из него электроны передаются НАД и флавинадениндинуклеотиду (ФАД). В результате образуются внутримитохондриальный НАДН и окисленный ФАДН-2. Электроны, хранящиеся в этих двух молекулах, передаются коферменту Q через комплексы I и II. Возможный перенос электронов в молекулу O2 приводит к образованию во внутренних мембранах митохондрий протонного градиента, что приводит к синтезу аденозинтрифосфатсинтазы (АТФ) через комплекс V. Когда уровень глюкозы в крови повышается, количество НАДН и АТФ увеличивается, АТФ-чувствительные K-каналы закрываются. Это приводит к деполяризации клеточных мембран, и, следовательно, открытию Ca2+-каналов [24].
Именно приток Ca2+ запускает начальную фазу секреции инсулина из предварительно обработанных гранул инсулина.
При СД вследствие уменьшения количества бета-клеток достаточной утилизации НАДН и ФАД не происходит. Это приводит к нарушению гликолитического пути метаболизма глюкозы. Причина – ингибирование глицерол-3-фосфат-дегидрогеназы вследствие снижения количества НАД+. Поэтому запускаются другие пути метаболизма глюкозы, в том числе полиоловый. При полиоловом пути обмена генерируется НАДН из НАД+. В результате увеличивается соотношение НАДН/НАД+, продукция активных форм кислорода, развивается хроническая псевдогипоксия. Последняя может вызвать хроническое воспаление, способствующее дальнейшему прогрессированию дисфункции бета-клеток и повышению глюкозы крови [20].
Полиол-сорбитоловый путь обмена активируется гипергликемией. Длительная гипергликемия токсична для макро- и микрососудистой системы, данный феномен известен как глюкозотоксичность. Считается, что равномерный поток НАДН через комплекс I при СД может способствовать усугублению глюкозотоксичности [27].
Гипергликемия оказывает повреждающее действие на сосудистые стенки разными способами. Глюкоза попадает в эндотелиальные клетки с помощью ГЛЮТ-1 по инсулиннезависимому пути по градиенту концентрации. Повышенная ее концентрация может стимулировать образование оксида азота, что сопровождается синтезом высокоактивных пероксинитритов. Пероксинитриты способствуют активации перекисного окисления липидов и образованию нитротирозина. Нитротирозин нарушает функцию эндотелия и вместе с тем играет ключевую роль в окислительном стрессе. Подавление антиоксидантной защиты и усиленное образование продуктов окисления вызывают окислительный стресс.
К другим факторам, способствующим развитию окислительного стресса, относится активное образование метилглиоксаля и других веществ, синтезируемых в альтернативных путях метаболизма (рис. 5) [28].
Динамику коферментов энергетического метаболизма – ФАД и НАДН и нарушение окислительного метаболизма можно исследовать с помощью лазерной флуоресцентной спектроскопии (ЛФС) [29].
В работах по оценке окислительного метаболизма методом флуоресцентной спектроскопии применяются разные соотношения между амплитудами флуоресценции НАДН и ФАД. Метаболические процессы клеточных структур ткани энергозависимы. В данной методике регистрируются изменения амплитуд флуоресценции Δ ФАД и Δ НАДН при температурной пробе: тесты с нагревом (повышение активности) и охлаждением (снижение активности) метаболизма. Тесты проводятся для оценки адаптационных возможностей ткани и устранения возможных оптических помех от сопутствующих флуорофоров ткани при возбуждении флуоресценции коферментов [30].
Оценка НАДН и ФАД с помощью ЛФС представлена на рис. 6 и 7.
Нами проведено пилотное исследование, целью которого стала оценка критериев риска доклинических проявлений СДС по состоянию микроциркуляторного русла и тканевого метаболизма у больных СД.
Материал и методы
В исследование было включено 50 пациентов с разной длительностью СД.
Критерии включения в исследование:
- СД 1 и 2 типов;
- уровень гликированного гемоглобина – от 6,0 до 11,0%.
- Критерии исключения:
- нарушение магистрального кровотока сосудов нижних конечностей;
- тяжелые соматические заболевания;
- стенозирующий атеросклероз нижних конечностей;
- беременность.
Пациенты основной группы были разделены на три подгруппы в зависимости от типа и тяжести нарушений микроциркуляторной и тканевой систем.
Группу контроля составили 20 лиц без нарушений углеводного обмена, магистрального кровотока сосудов нижних конечностей, тяжелых соматических заболеваний. Данная группа была разделена на три подгруппы в зависимости от возраста.
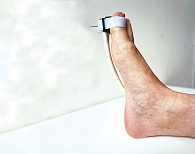
Нарушение микроциркуляторного русла определяли с помощью ЛДФ, тканевого метаболизма – ЛФС. Исследование микроциркуляторного русла и окислительного метаболизма проводили на лазерном диагностическом аппарате «ЛАЗМА СТ» (рег. уд. № РЗН 2017/5844 от 8 июня 2017 г.) (рис. 8).
Согласно протоколу исследования регистрация параметров осуществлялась в три этапа в течение одной диагностической процедуры на подошвенной части большого пальца стопы (рис. 9). Первый этап – состояние покоя – восемь минут (достижение стабилизации исходного состояния), второй – при охлаждении до 10 °С – одна минута (до холодовой вазодилатации), третий – при нагревании до 35 °С – четыре минуты (время регистрации параметров сосудистого тонуса).
Результаты
Микроциркуляция крови (МК), резерв метаболизма (резерв), индекс утилизации (ИУ) в подгруппах контрольной группы представлены в табл. 1.
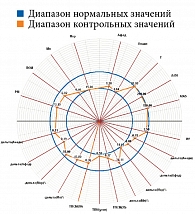
Результаты диагностической процедуры у пациентки контрольной группы представлены на рис. 10. Микроциркуляция активная, окислительный метаболизм в норме. МК – 15,0 перфузионной единицы, температура – 30 °С, резерв – 73%, ИУ – 2,5 относительной единицы.
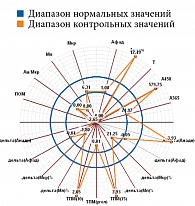
Микроциркуляция крови, резерв, ИУ в подгруппах основной группы представлены в табл. 2, результаты диагностической процедуры у пациента из подгруппы с риском развития СДС – на рис. 11. Микроциркуляция неактивная, выраженное снижение окислительного метаболизма. МК – 6,31 перфузионной единицы, температура – 26 °С, резерв – 12%, ИУ – 0,44 относительной единицы.
Заключение
Лазерная допплеровская флоуметрия и лазерная флуоресцентная спектроскопия позволяют оценить динамику коферментов энергетического метаболизма и микроциркуляции, а также резервных показателей энергетического метаболизма при проведении функциональных проб: холодовой и тепловой.
Полученные результаты свидетельствуют о высокой диагностической значимости комплексного применения ЛДФ и ЛФС в отношении выявления риска развития СДС. Сочетание этих методов диагностики позволит персонифицировать антидиабетическую терапию СД.
M.V. Shinkin, L.A. Zvenigorodskaya, A.M. Mkrtumyan
A.S. Loginov Moscow Clinic Scientific Center
A.I. Evdokimov Moscow State University of Medicine and Dentistry
Contact person: Mikhail Viktorovich Shinkin, jendis@yandex.ru
Diabetes mellitus is a chronic disease that is associated with various complications, and first of all with vascular ones. The most usual microvascular complications include retinopathy, nephropathy, diabetic foot syndrome. The mechanisms of diabetic angiopathy development are complex and varied. In particular, diabetic foot syndrome develops due to changes in the peripheral nervous system, arterial and microcirculatory bed.
One of the most important tasks of modern medicine is to prevent the development of these complications, including through timely diagnosis.
The article considers the possibilities of laser Doppler flowmetry and fluorescence spectroscopy in the detection of preclinical manifestations of diabetic foot syndrome.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


