Лекарственная терапия метастатической меланомы кожи: что сделано и что предстоит сделать
- Аннотация
- Статья
- Ссылки
- English
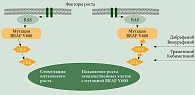





Введение
Новая страница в терапии метастатической меланомы (ММ) была открыта в 2011 г., когда в США были зарегистрированы два первых препарата ипилимумаб и вемурафениб, представляющих два новых направления в терапии ММ. Такими направлениями стали блокирование митоген-активированного протеинкиназного сигнального пути в клетках меланомы, имеющих мутацию в гене BRAF (ингибиторы BRAF и МЕК), и блокирование контрольных точек иммунного ответа на этапе активации наивных Т-лимфоцитов в лимфоузле и в эффекторной фазе взаимодействия активированных лимфоцитов с опухолью и ее микроокружением (ингибиторы рецепторов CTLA4 и PD-1) (рис. 1 и 2). В течение последующих четырех лет в клиническую практику были внедрены еще пять представителей этих направлений, а также три вида комбинированной терапии. Все эти препараты зарегистрированы в Российской Федерации и широко используются в реальной практике (табл. 1). Важным событием стала регистрация в нашей стране в апреле 2020 г. первого отечественного иммуноонкологического препарата (ИОП) пролголимаба – оригинального ингибитора PD-1 [1].
Результаты клинических исследований новых видов лечения сегодня подтверждены опытом их использования в программах широкого доступа и общей практике. Следует отметить, что новые препараты не только продемонстрировали более высокую эффективность по сравнению с химиотерапией, но и привели к существенному увеличению популяции долго живущих пациентов с диссеминированной меланомой кожи (МК). Согласно графикам выживаемости, представленным в работе S. Ugurel и соавт., более трех лет от момента начала системного лечения переживают 30–50% больных, получающих таргетные и иммуноонкологические препараты, и не более 15–20% пациентов, получавших химиотерапию (рис. 3) [2]. Несмотря на такое существенное повышение эффективности, лечение пациентов с ММ остается трудной задачей.
По мере накопления опыта использования новых препаратов становится очевидным, что ряд практических вопросов пока не имеет окончательного решения. Речь, в частности, идет об оптимальной последовательности назначения таргетных и иммуноонкологических препаратов пациентам с BRAF-позитивной меланомой, длительности терапии при достижении объективного ответа (ОО), повторном назначении препаратов, резистентность к которым возникла после первоначального ответа.
В статье представлены обновленные данные эффективности ингибиторов BRAF/MEK и CTLA4/PD-1 в основных регистрационных исследованиях этих препаратов при ММ с медианой наблюдения 3–5 лет, а также освещены практические вопросы, связанные с использованием новых лекарственных направлений (табл. 2).
Обновленные результаты регистрационных исследований первой линии терапии ММ
Комбинация дабрафениба и траметиниба
В 2019 г. были представлены данные пятилетнего наблюдения за пациентами с метастатической МК BRAF V600+, которые получали комбинированную таргетную терапию (ТТ) дабрафенибом и траметинибом в рамках двух клинических исследований III фазы – COMBI-v и COMBI-d. В анализ было включено 563 пациента (COMBI-d – 211 больных, COMBI-v – 352 пациента) [3].
Выживаемость без прогрессирования (ВБП) составила 21% (95% доверительный интервал (ДИ) 17–24) через четыре года и 19% (95% ДИ 15–22) через пять лет. Принимая во внимание данные цифры и кривую выживаемости, можно говорить о некотором плато ВБП спустя четыре и пять лет.
Объединенный анализ данных демонстрирует зависимость наилучшего ответа на терапию и показателей выживаемости (ВБП и общей выживаемости (ОВ)). Так, чем лучше ответ на терапию, тем лучше ВБП. Для пациентов с полным ответом (ПО) пятилетняя ВБП достигла 49%, продемонстрировав то же плато на четвертом (51%) и пятом году (49%). При этом медиана продолжительности ответа составила 36,7 месяца (95% ДИ 24,1 месяца – НД). Среди пациентов с частичным ответом (ЧО) пятилетняя ВБП составила 16%, также продемонстрировав плато на четвертом (17%) и пятом году (16%).
ОВ среди всех пациентов, вошедших в объединенный анализ, составила 37% (95% ДИ 33–42) через четыре года и 34% (95% ДИ 30–38) через пять лет. При этом у пациентов, которые достигли ПО, пятилетняя ОВ составила 71%.
Кто же эти пациенты, достигшие ПО (n = 109)? Чтобы понять различия между подгруппами пациентов, которые достигли ПО на терапию и которые не достигли его, был проведен дополнительный анализ [4]. Большинство пациентов с ПО – пациенты с ECOG 0, нормальным уровнем лактатдегидрогеназы (ЛДГ) исходно, метастатическим поражением менее трех органов. Терапия дабрафенибом и/или траметинибом была прекращена у 46 (42%) пациентов из 109 с продолжающимся ПО. Самая частая причина прекращения терапии была связана с развитием побочных эффектов (35% – для дабрафениба, 39% – для траметиниба). Прогрессирование заболевания выявлено у 50% пациентов с ПО. Наиболее частыми локализациями метастазов стали центральная нервная система (54%), легкие (17%), лимфоузлы (17%), кожа/подкожная клетчатка (13%). При сравнении подгрупп пациентов, у которых выявлено прогрессирование заболевания после ПО, и тех, у кого прогрессирование не зафиксировано, существенных отличий не установлено. Таким образом, нельзя сделать однозначный вывод, у каких пациентов при достижении ПО впоследствии будет наблюдаться прогрессирование заболевания.
Как показал объединенный анализ, пациенты, получающие комбинированную ТТ дабрафенибом и траметинибом и достигшие ПО, имеют улучшение выживаемости по сравнению с общей популяцией пациентов с медианой продолжительности ответа 36,7 месяца и 50% (n = 55) пациентов, у которых ПО сохраняется при проведении последней оценки. У большинства пациентов с ПО отмечались «благоприятные» характеристики: ECOG 0, нормальный уровень ЛДГ, менее трех органов с метастазами. Выбор исходных факторов имеет значение при назначении терапии пациентам с МК BRAF V600 +, которые получат наибольшую пользу от комбинированной ТТ. Но для истинного подтверждения пользы необходимы дополнительные исследования.
Комбинация вемурафениба и кобиметиниба
Длительное наблюдение за пациентами в исследовании Ib фазы BRIM7 показало, что у BRAF-положительных пациентов с ММ, ранее не получавших монотерапию BRAF-ингибиторами, при старте терапии с комбинации «вемурафениб + кобиметиниб» показатель ОВ стабилизировался на уровне 39,2% на четвертом и пятом году наблюдения [5]
В регистрационном исследовании III фазы coBRIM медиана ОВ в группе комбинированной терапии составила 22,5 месяца (20,3–28,8) и пятилетняя ОВ – 30,8% среди всех пациентов (n = 247), включенных в исследование [6]. Показатели ОВ были выше в подгруппе с нормальным уровнем ЛДГ (n = 131): медиана ОВ составила 38,5 месяца по сравнению с 14,8 месяца в подгруппе с повышенным уровнем ЛДГ (n = 112). Пятилетняя ОВ составила 43 vs 16% соответственно. Важно, что 46% пациентов, включенных в исследование coBRIM, имели исходно повышение уровня ЛДГ. При этом показатель пятилетней ВБП составил 14% у всех пациентов, включенных в исследование. Показатели ВБП были выше в подгруппе пациентов с нормальным уровнем ЛДГ (n = 131): медиана ВБП составила 15,0 месяца по сравнению с 8,6 месяца в подгруппе с повышенным уровнем ЛДГ (n = 112). Пятилетняя ВБП составила 18 vs 7% соответственно. Частота ОО (ЧОО) у всех участников исследования достигла 70%, включая 21% ПО. Контроль болезни отмечался в 88% случаев.
Пембролизумаб
В 2019 г. были опубликованы обновленные результаты исследования KEYNOTE-006, в котором сравнивали эффективность двух режимов пембролизумаба (10 мг/кг каждые две или три недели) с эффективностью ипилимумаба у 834 пациентов, ранее получивших не более одной линии терапии [7]. В этом исследовании в группы пембролизумаба и ипилимумаба было включено 556 и 278 больных соответственно. При медиане наблюдения 57,7 месяца медиана ОВ в объединенной группе пембролизумаба составила 32,7 месяца, в два раза превысив этот показатель в группе ипилимумаба (15,9 месяца). Пять лет пережили в группе пембролизумаба и ипилимумаба 38,7 и 31% больных соответственно. Медиана ВБП в группе пембролизумаба и ипилимумаба оказалась равной 8,4 и 3,4 месяца соответственно. На фоне терапии пембролизумабом 42% пациентов достигли ОО, включая 17% ПО, медиана длительности ответа у них превысила 50 месяцев (53,5 месяца). В группе ипилимумаба ЧОО составила 14%, в том числе 3% ПО, а медиана длительности ответа не была достигнута.
Обратите внимание, что в данном исследовании допускалось проведение не более одной линии предшествующей лекарственной терапии по поводу ММ. Пембролизумаб и ипилимумаб в первой линии получили 368 (66%) и 181 (65%) пациент соответственно. В подгрупповом анализе показано, что и пембролизумаб, и ипилимумаб имели более высокие показатели эффективности в первой линии лечения. Так, в группе больных, получавших пембролизумаб в первой линии, ЧОО достигла 46%, медиана ОВ и медиана ВБП – 38,7 и 11,6 месяца соответственно. Пять лет пережили 43,2% пациентов.
Ниволумаб в монорежиме и комбинации с ипилимумабом
Эффективность первой линии ниволумаба в монорежиме изучали в двух крупных рандомизированных исследованиях. В исследовании CheckMate 066 участвовали пациенты без BRAF-мутации. Ниволумаб получили 210 больных ММ. В качестве препарата сравнения для этой популяции больных был выбран дакарбазин (n = 208). Обновленные результаты были опубликованы в 2019 г., когда стали доступны показатели трехлетней выживаемости [8]. Ниволумаб продемонстрировал убедительное преимущество перед дакарбазином по основным критериям эффективности. Так, в группе пациентов, получавших ниволумаб, ЧОО, медианы ВБП и ОВ составили 42,9%, 5,1 и 37,5 месяца. Аналогичные показатели в группе дакарбазина оказались значительно ниже: 14,4%, 2,2 и 11,2 месяца соответственно. Трехлетние показатели ОВ у пациентов, получавших ниволумаб и дакарбазин, достигли 51,2 и 21,6% соответственно. Обращает на себя внимание тот факт, что в группе ниволумаба почти у половины ответивших на лечение был зарегистрирован ПО. Его частота составила 19%. Частичный ответ (ЧО) наблюдался у 23,8% пациентов. Медиана длительности ОО в группе ниволумаба не была достигнута, поскольку у 66,7% больных он сохранялся при медиане наблюдения более трех лет (38,4 месяца). При использовании дакарбазина ОО зафиксирован у 14,4% пациентов с медианой длительности шесть месяцев, причем только 1,4% пациентов достигли ПО.
В 2019 г. были также представлены обновленные результаты исследования CheckMate 067, основная цель которого состояла в сравнении эффективности комбинации ниволумаба и ипилимумаба и монорежима ниволумаба с ипилимумабом у пациентов с ММ, ранее не получавших лечения [9]. В исследование было включено 1296 пациентов, из них рандомизированы в лечебные группы в соотношении 1:1:1 945 больных. Медиана наблюдения за пациентами составила пять лет. Показатели эффективности трех лечебных режимов представлены в табл. 3. Как и ранее опубликованные данные, обновленные результаты подтвердили преимущество ниволумаб-содержащих режимов перед монотерапией ипилимумабом [10]. Впервые показано, что в группе комбинированной иммунотерапии более половины пациентов с ММ (52%) пережили пятилетний рубеж. Такого высокого показателя ОВ не удавалось добиться ни в одном другом исследовании. Медиана ОВ в этой группе превысила 60 месяцев и не была достигнута. В группе ниволумаба пятилетняя ОВ составила 44%, а медиана ОВ – 36,9 месяца. В группе комбинированной иммунотерапии ОО зарегистрирован у 58% пациентов, тогда как в группе ниволумаба и ипилимумаба у 45 и 19% пациентов соответственно. Ниволумаб-содержащие режимы позволили каждому пятому больному достичь ПО. В то же время в группе ипилимумаба ПО был зарегистрирован только у 6% пациентов. Медиана длительности ПО не достигнута ни в одной из лечебных групп. Следует отметить, что у пациентов, получавших ниволумаб как в комбинации, так и в монорежиме, на длительность ПО не влияли факторы прогноза, такие как подстадия М, уровень экспрессии PD-L1 и уровень ЛДГ.
Преимущество комбинированного режима подтверждает то обстоятельство, что через пять лет от момента начала лечения 82% пациентов так и не начали вторую линию терапии, поскольку 8% пациентов продолжали получать ниволумаб в монорежиме, а 74% пациентов после завершения лечения в рамках протокола не нуждались в продолжении терапии. Медиана времени без лечения в этой группе была самой длительной – 18,1 месяца. Таким образом, несмотря на то что исследование не обладало достаточной мощностью для сравнения комбинированного режима иммунотерапии и монорежима ниволумаба, комбинация ипилимумаба и ниволумаба продемонстрировала преимущество в отношении всех показателей эффективности, а также во всех прогностических подгруппах.
Пролголимаб
Пролголимаб (ингибитор PD-1) – первое оригинальное отечественное моноклональное антитело изотипа IgG1 с модифицированным Fc-фрагментом. От других препаратов этого класса пролголимаб отличают наличие в Fc-фрагменте мутации LALA, которая минимизирует эффекторные свойства антитела и предохраняет PD-1-экспрессирующие лимфоциты от разрушения другими иммунокомпетентными клетками, а также полная блокада эпитопа связывания рецептора PD-1 с лигандом PD-L1 [11].
В исследовании II фазы MIRACULUM приняли участие 126 пациентов с ММ, получившие не более одной линии терапии [12]. Основной задачей исследования была оценка ЧОО по критериям irRECIST, дополнительно изучались ВБП, ОВ, частота контроля над заболеванием и другие показатели. Терапия пролголимабом проводилась в двух дозовых режимах: 1 мг/кг внутривенно каждые две недели и 3 мг/кг внутривенно каждые три недели. Во всей популяции ЧОО и контроля над заболеванием достигли 33 и 55% пациентов соответственно, медианы ВБП и ОВ составили 4,07 и 16,8 месяца. Один год без прогрессирования заболевания пережили 35,3% больных, одногодичная ОВ достигла 62%. Значительно более высокие результаты препарат продемонстрировал у пациентов, ранее не получавших лечения, при режиме дозирования 1 мг/кг один раз в две недели. В этой группе ЧОО достигла 48%, в том числе 11% ПО, а контроль над заболеванием зарегистрирован у 65% больных. Медиана ВБП составила 8,6 месяца, а медиана ОВ не была достигнута. Одногодичные показатели ВБП и ОВ были значительно выше, чем в общей популяции, – 44,6 и 71,8% соответственно. Обращает на себя внимание благоприятный профиль нежелательных реакций (НР) пролголимаба: частота НР 3–4-й степени составила 7,9%. Только 3,2% больных прекратили лечение из-за НР. В целом препарат продемонстрировал эффективность, сопоставимую с таковой других анти-PD-1-моноклональных антител. Исследования с его участием активно продолжаются как при меланоме, так и при других злокачественных опухолях.
Оптимальная последовательность назначения таргетных и иммуноонкологических препаратов у пациентов с BRAF-позитивной меланомой
Как следует из представленных выше обновленных результатов исследований, ТТ и ИОП являются эффективными лекарственными опциями для пациентов с ММ. С какой из них целесообразно начинать лечение при впервые выявленных отдаленных метастазах меланомы, BRAF-мутации в опухоли? Какая последовательность (ТТ – прогрессирование – ИОП или ИОП – прогрессирование – ТТ) дает больший прирост ОВ? Эти вопросы не утрачивают актуальности и сегодня, хотя активно обсуждаются на протяжении последних нескольких лет – с тех пор, как препараты вошли в практику лечения пациентов с ММ.
С позиций доказательной медицины ответы на эти вопросы должны дать проспективные рандомизированные исследования. В настоящее время проводится несколько исследований, в которых сравнивается эффективность двух противоположных подходов. Однако результаты пока не опубликованы.
Ретроспективные исследования, посвященные данной теме, демонстрируют противоречивые результаты. Так, при анализе исходов лечения 440 пациентов с ММ, проведенном J.J. Luke и соавт., показано, что назначение в первой линии ТТ сопровождается более высокими результатами, чем назначение ИОП [13]. У 283 больных, получавших ТТ, ЧОО и продолжительность лечения достигли 60,1% и 11,4 месяца, в то время как у 157 пациентов, получивших в первой линии комбинированную анти-PD-1/CTLA4-иммунотерапию или ингибиторы PD-1 в монорежиме, эти показатели составили 45,9% и 7,2 месяца соответственно. Авторы отметили, что преимущество ТТ достигнуто несмотря на то, что в этой группе было больше больных с факторами неблагоприятного прогноза (повышенным уровнем ЛДГ и метастатическим поражением печени). Существенной разницы в показателях ОВ не зарегистрировано.
В другом ретроспективном исследовании J.C. Moser и соавт. сделали противоположный вывод [14]. Они провели сравнительный анализ эффективности комбинированной ТТ (n = 297), ингибиторов PD-1 в монорежиме (n = 162) и комбинированной иммунотерапии (n = 108) в первой линии лечения. При медиане наблюдения 22,4 месяца медиана ОВ в группе комбинированной иммунотерапии не достигнута, в группе ингибиторов PD-1 она составила 39,5 месяца, а в группе ТТ не превысила 13,2 месяца. Авторы пришли к заключению, что назначение в первой линии лечения ИОП в монорежиме или комбинации сопровождается более длительной ОВ по сравнению с ТТ. Возможно, в этом анализе сыграл роль тот факт, что в рутинной клинической практике обычно предпочтение отдается ТТ при наличии неблагоприятных факторов. В то же время иммунотерапию (особенно монотерапию анти-PD-1) назначают пациентам с «более благоприятными факторами». Однако недостаток данных о факторах прогноза у пациентов, включенных в анализ, не позволяет сделать однозначный вывод.
В ретроспективном исследовании D.B. Jonson и соавт. не только оценили ОВ 114 больных с ММ, получивших ТТ и ИОП в обратной последовательности, но и сравнили их эффективность в первой и второй линиях [15]. Среди 58 пациентов, которые начали лечение с ТТ, 47% получали монотерапию, 53% – комбинированную ТТ. Среди 56 больных, которым в первой линии назначали ИОП, только 18% получили комбинацию ИОП, остальные 82% – монотерапию PD-1/PD-L1-ингибиторами. Статистически значимых различий ни в ОВ, ни в ВБП в двух группах не зафиксировано, однако показано, что эффективность как ТТ, так и ИОП в первой линии выше, чем в последующих. Пациенты, получавшие ТТ после прогрессирования заболевания на терапии ИОП, имели более низкие показатели эффективности, чем те, кто получал ТТ в первой линии (медиана ВБП 5,0 vs 7,4 месяца, медиана ОВ 10,6 vs 40,3 месяца). Аналогично терапия ИОП у пациентов с прогрессированием на ТТ была менее эффективна, чем в первой линии (ЧОО 25 vs 41%, медиана ВБП 2,8 vs 10,6 месяца, медиана ОВ 27,6 vs 8,2 месяца). Полученные данные опровергают сделанный ранее вывод, что предшествующая терапия ИОП существенно не влияет на эффективность ТТ [16, 17]. Тем не менее негативное влияние терапии BRAF-ингибиторами на эффективность ингибитора PD-1 пембролизумаба подтверждено результатами исследования KEYNOTE-006. Так, пембролизумаб в первой линии у пациентов с BRAF-мутацией обеспечивает медиану ВБП 7,0 месяца и ЧОО у 40,7% больных. При использовании препарата во второй линии после прогрессирования на BRAF-ингибиторах эти показатели составляют 2,8 месяца и 21,8% соответственно [18]. Медиана ОВ у пациентов с BRAF-мутацией, получавших пембролизумаб в первой линии терапии, не была достигнута при пятилетнем сроке наблюдения, а пять лет пережили 50,8% больных. У пациентов, ранее получавших BRAF-ингибиторы, медиана ОВ составила 20,4 месяца, пять лет от момента начала лечения пережили только 30,5% пациентов [7].
В 2017 г. были опубликованы результаты метаанализа 16 исследований, включавших 6489 пациентов с ММ, с использованием Байесовской модели случайных эффектов [19]. В ходе анализа проведено сравнение эффективности различных схем лекарственного лечения, включая химиотерапию, монорежимы BRAF-ингибиторов, комбинированную ТТ, монорежимы ИОП и комбинированную терапию ниволумабом и ипилимумабом. Показано, что комбинация BRAF- и MEK-ингибиторов обеспечивает наиболее высокие ЧОО и ВБП по сравнению с другими видами терапии. Однако при анализе показателей ОВ оказалось, что максимальным преимуществом характеризуется комбинированная ТТ и монотерапия ингибиторами PD-1. Влияние комбинированной иммунотерапии на ОВ в этом исследовании не оценивали, поскольку результаты влияния комбинации ипилимумаба и ниволумаба на ОВ на момент анализа данных не были опубликованы.
Таким образом, доступные на сегодняшний день данные исследований показывают, что эффективность ТТ и ИОП снижается при использовании во второй и последующих линиях лечения. Скорее всего это связано с общими механизмами резистентности. В то же время результаты эффективности ТТ и ИОП противоречивы и не позволяют определить оптимальную последовательность лечения у BRAF-положительных пациентов. Это можно объяснить ретроспективным характером исследований, который не позволяет сформировать прогностически равноценные выборки пациентов для сравнения разных последовательностей лечения.
Попытка исправить ситуацию и сравнить эффективность комбинаций таргетных и иммуноонкологических препаратов в первой линии в идентичных группах была предпринята M.B. Atkins и соавт. Они провели скорректированное непрямое сравнение выживаемости и ЧОО между группами комбинации ипилимумаба и ниволумаба (исследования CheckMate 067/69) и комбинации двух пар BRAF/MEK-ингибиторов – дабрафениб/траметиниб (исследования COMBI-d, COMBI-v) и вемурафениб/кобиметиниб (исследование coBRIM) [20]. Использованный авторами метод моментов логистической регрессии позволил сформировать группы пациентов, максимально сбалансированные по основным характеристикам (полу, возрасту, этническому происхождению, территории проживания) и факторам прогноза (подстадии М, уровню ЛДГ, статусу по ECOG, метастазам в головном мозге и др.). Результаты исследования подтвердили преимущество комбинированной иммунотерапии в первой линии у BRAF-позитивных пациентов в отношении влияния на ОВ. Обращает на себя внимание тот факт, что наиболее отчетливо кривые ОВ начинают расходиться через 12 месяцев от момента начала лечения, что подтверждает долгосрочный противоопухолевый эффект иммунотерапии. Показатели ВБП и ЧОО существенно не отличались, частота НР 3–4-й степени составила 54% в группе комбинированной иммунотерапии, 31,6% – в группе комбинации «дабрафениб + траметиниб» и 59,5% – в группе комбинации «вемурафениб + кобиметиниб».
Вывод, что современные ИОП приводят к более длительному контролю над заболеванием по сравнению с таргетными препаратами, подтверждают показатели пятилетней ОВ, полученные в регистрационных исследованиях (табл. 2). Использование ингибиторов PD-1 в монорежиме или комбинации с ингибитором CTLA4 в первой линии терапии у пациентов с BRAF-мутацией позволяет пережить пять лет 50–60% пациентов. Этот показатель для пациентов, начинающих лечение с комбинированной ТТ, составляет 30–34%. Основной причиной таких различий является длительность ответа на ТТ и терапию ИОП. Как уже отмечалось, по данным исследований COMBI-v и COMBI-d, медиана длительности ПО, который на фоне комбинированной ТТ наблюдается у каждого пятого больного, составляет 36 месяцев, пять лет без прогрессирования заболевания переживают 49% пациентов c ПО, а пятилетняя ОВ в этой группе достигает 71% [4]. Аналогичные показатели были существенно ниже в группе пациентов с ЧО на ТТ: медиана длительности ответа – 14 месяцев, пятилетняя ВБП и ОВ – 16 и 32% соответственно.
Для ОО, достигнутых на ИОП, характерна значительно бóльшая длительность. По данным исследования CheckMate 067, через пять лет с момента начала лечения медиана длительности ПО не была достигнута ни в группе комбинированной иммунотерапии, ни в группах ниволумаба и ипилимумаба в монорежиме, так как более чем у 80% пациентов ответ сохранялся [9]. Медиана длительности ЧО в комбинированной группе и группе ниволумаба составила 20 и 25 месяцев соответственно, ответ сохранялся почти у половины больных. Такие результаты были достигнуты несмотря на то, что к моменту последнего анализа продолжали лечение в рамках протокола только 8% пациентов в комбинированной группе и 18% – в группе ниволумаба.
Согласно данным подгруппового анализа выживаемости, в исследовании CheckMate 067 пациенты, достигшие ОО, имели значительно более высокие показатели ВБП и ОВ без существенных различий между группой комбинированной иммунотерапии и группой ниволумаба, чем общая популяция (табл. 4) [21]. Как видно из представленных данных, 80% пациентов с ПО и 40–45% пациентов с ЧО сохраняли его через пять лет от момента начала терапии, пятилетняя ОВ достигла рекордных 90% в группе с ПО и 63–65% в группе с ЧО.
Таким образом, очевидно, что в целом у 30–60% пациентов с BRAF-мутацией как ингибиторы BRAF/MEK, так и ингибиторы PD-1 в монорежиме или комбинации с ингибитором CTLA4 способны обеспечить долгосрочную выживаемость. Тем не менее доступные на сегодняшний день биомаркеры не позволяют проводить индивидуальное прогнозирование эффективности разных видов терапии и длительности ответа на нее в каждом конкретном случае. Известные маркеры неблагоприятного прогноза для ММ (повышенный уровень ЛДГ, низкий статус ECOG, метастазы отдельных локализаций, вовлечение трех и более органов и др.) в равной мере негативно влияют на эффективность как ТТ, так и ИОП.
Чем же руководствоваться практическому онкологу при выборе первой линии терапии для конкретного пациента с BRAF-позитивной ММ? Надо учитывать несколько важных моментов.
Прежде всего следует принимать во внимание особенности реализации противоопухолевого эффекта, характерные для ТТ и ИОП. Как известно, BRAF/МЕК-ингибиторы отличаются быстрым наступлением ответа и высокой частотой достижения объективных эффектов. Однако существует проблема рефрактерности, которая развивается в среднем через 12–14 месяцев у большинства больных. При использовании ингибиторов PD-1/CTLA4 ответ на лечение формируется постепенно. Это связано с отсутствием у препаратов прямого противоопухолевого действия. Не случайно первое контрольное обследование пациентам обычно проводят на 10–12-й неделе. ОО, полученные при использовании ИОП, как правило, значительно более длительные, но 40–50% больных ММ не отвечают на это лечение и у части пациентов прогрессирование развивается после первоначального ответа.
Необходимо также определить первичную цель лечения. Понятно, что основная задача лечения пациента с онкологическим заболеванием состоит в увеличении общей продолжительности жизни. Однако в ряде случаев нужно в первую очередь добиться быстрого уменьшения симптомов заболевания, вызванных метастатическим поражением. В такой ситуации целесообразно назначение в первой линии комбинированной ТТ. При небольшой опухолевой массе и отсутствии симптомов следует подумать о назначении ИОП, учитывая, что этот вид лечения потенциально характеризуется наибольшим влиянием на ОВ.
У каждого больного следует исключить наличие противопоказаний, характерных для таргетной и иммуноонкологической терапии. По мере накопления опыта использования этих видов лечения перечень таких противопоказаний сужается. Вместе с тем при тяжелых аутоиммунных заболеваниях ИОП не рекомендуются, поскольку дальнейшая активация иммунной системы может создать потенциальную угрозу жизни больного. При назначении ТТ необходимо уточнить, не страдает ли пациент заболеваниями, сопровождающимися нарушением функции левого желудочка, окклюзией вен сетчатки и др.
При выборе первой линии терапии важно оценить возможность организации динамического наблюдения за пациентом, что особенно актуально для проведения терапии ИОП.
Наконец, следует ориентироваться на национальные и международные рекомендации [22–24], согласно которым решение о выборе препаратов для первой линии терапии пациенту с BRAF-мутацией должно приниматься индивидуально с учетом целей лечения и его предполагаемой переносимости. Во всех рекомендациях комбинированная ТТ рассматривается в качестве приоритетного лечения для пациентов с большим объемом поражения, наличием симптомных метастазов и необходимостью быстрого ответа. В рекомендациях Европейского общества медицинских онкологов (ESMO) также указано, что иммунотерапию в первой линии целесообразно назначать пациентам с «медленным» типом прогрессирования и локализацией метастазов, не создающей непосредственной угрозы жизни.
Оптимальная длительность лечения
Появление в последние годы арсенала высокоэффективных таргетных и иммунологических препаратов для системной терапии ММ вызывает у клиницистов закономерный вопрос: как долго продолжать лечение при отсутствии прогрессирования или полном ответе?
Оптимальная продолжительность иммунотерапии ингибиторами PD-1
Благодаря накопленному опыту использования ингибиторов контрольных точек при метастатической МК стало понятно, что применение препаратов этих групп до прогрессирования заболевания невозможно и неосуществимо. Это связано с тем, что наблюдающиеся ответы на фоне иммунотерапии, если они происходят, как правило, носят стойкий и длительный характер. Причин, по которым терапия ингибиторами контрольных точек должна быть прекращена, несколько. Во-первых, бесконечное лечение наносит значительный экономический урон системе здравоохранения, существенно увеличивает трудозатраты, а в случае самостоятельной закупки ложится тяжелым экономическим бременем на семью пациента. Во-вторых, визиты в клинику каждые две – четыре недели на протяжении долгих лет становятся социальным, психологическим и экономическим бременем как для пациента и его близких, так и для всей системы здравоохранения, независимо от форм собственности. В-третьих, длительное проведение иммунотерапии ингибиторами контрольных точек повышает риск отсроченной токсичности.
Чтобы ответить на вопрос, как долго продолжать иммунотерапию в отсутствие прогрессирования заболевания или в случае непереносимой токсичности, можно обратиться к результатам нескольких клинических исследований и попытаться соотнести эти данные с реальной клинической практикой.
Наиболее убедительные данные можно получить, опираясь на результаты исследования KEYNOTE-006, в котором пациенты были разделены на три группы [7]. В исследовании сравнивали два режима дозирования пембролизумаба против ипилимумаба у пациентов, не получавших ранее иммунотерапию.
Продолжительность терапии составила два года. 103 (19%) пациента из двух групп, получавших пембролизумаб, полностью завершили двухлетний период лечения. У 21 (20%) больного зафиксирован ПО на лечение, у 69 (67%) – ЧО на лечение, у 13 (13%) – стабилизация заболевания. После завершения лечения ответ сохранялся у 16 (76%) больных из 21 пациента с ПО, у 53 (77%) из 69 пациентов с ЧО и у семи (54%) из 13 пациентов со стабилизацией заболевания. Интересно, что у восьми (8%) пациентов, у которых на фоне терапии пембролизумабом был достигнут ЧО, после отмены пембролизумаба в период наблюдения в дальнейшем был достигнут ПО. Медиана наблюдения за пациентами после прекращения двухлетней терапии пембролизумабом составила 34,2 месяца. Двухгодичная ВБП у всех 103 пациентов, завершивших двухлетнюю терапию пембролизумабом, составила 78,4% (95% ДИ 68,3–85, 6). Двухгодичная ОВ составила 95,9% (89,4–98,4), трехлетняя – 93,8% (86,7–97,2). Двухгодичная ВБП у пациентов с ПО составила 85,4% (95% ДИ 61,3–95,1), у пациентов с ЧО – 82,3% (70,3–89,8), у пациентов со стабилизацией заболевания – 39,9% (8,1–71,4).
В исследовании KEYNOTE-006 23 пациента с ПО терапию пембролизумабом завершили ранее двух лет. Согласно условию протокола, пациенты с ПО должны были получать терапию пембролизумабом не менее шести месяцев. При этом после первого контрольного обследования, зафиксировавшего ПО, пациентам дополнительно проводили два курса терапии пембролизумабом. У 23 пациентов двухгодичная ВБП составила 86,4% (95% ДИ 63,4–95,4), что было сопоставимо с двухгодичной ВБП у пациентов, завершивших двухлетнюю терапию пембролизумабом, – 85,4% (95% ДИ 61,3–95,1). Среди 103 пациентов, полностью завершивших двухлетнюю терапию пембролизумабом, к моменту анализа данных 76 (74%) пациентов не имели признаков прогрессирования заболевания, 27 (26%) имели, причем медиана времени до прогрессирования после прекращения терапии пембролизумабом составила 33,3 месяца.
Таким образом, исследование KEYNOTE-006 может служить косвенным доказательством, что даже пациентов со стабилизацией заболевания не следует лечить бесконечно долго, двух лет может быть вполне достаточно, не говоря уже о пациентах с полным или частичным ответом.
Похожие результаты получены и в исследовании KEYNOTE-001. Его дизайн предусматривал длительную терапию пембролизумабом – до прогрессирования или непереносимой токсичности. То есть лимит в два года отсутствовал. ПО зарегистрирован у 105 (17%) пациентов из 655 включенных в исследование. Из 105 пациентов с ПО 67 больных досрочно прекратили терапию пембролизумабом после достижения ПО, главным образом по собственному желанию. При анализе данных у этих 67 пациентов двухгодичная ВБП от момента прекращения терапии пембролизумабом составила 89,9%. При этом не было разницы в двухгодичной безрецидивной выживаемости у пациентов с ПО от момента прекращения терапии пембролизумабом между группой из этих 67 пациентов, досрочно прекративших терапию пембролизумабом, и пациентов, длительно получавших терапию пембролизумабом после достижения ПО. Двухгодичная безрецидивная выживаемость с момента достижения ПО составила 90% для всех, независимо от того, прекратили они лечение или нет. Это свидетельствует о стойком и длительном полном противоопухолевом ответе [25].
В другом исследовании CheckMate 067 сравнивали комбинацию «ипилимумаб + ниволумаб» и отдельно ниволумаб или ипилимумаб в первой линии терапии ММ. У 90% пациентов, достигших ПО в течение двух лет лечения, сохранялась ремиссия заболевания. При этом среди пациентов, ответивших на лечение, но досрочно прекративших терапию из-за токсичности, ответ на лечение сохранялся у 69% пациентов из комбинированной когорты, у 70% пациентов из когорты ниволумаба и у 71% пациентов из когорты ипиплимумаба [26]. Среднее время, в течение которого больные получали комбинированную терапию по схеме «ипилимумаб + ниволумаб», составило всего 2,5 месяца, но даже среди этих пациентов две трети из тех, кто ответил на терапию, оставались в ремиссии.
Интересные данные опубликованы Y.J.L. Jansen и соавт. [27]. Это ретроспективное исследование показало, что продолжительность терапии ингибиторами контрольных точек в реальной практике короче, чем в клинических испытаниях. 185 пациентов с ММ получали иммунотерапию анти-PD-1-моноклональными антителами (МАТ) пембролизумабом (n = 167) или ниволумабом (n = 18) в условиях реальной клинической практики. Все пациенты по согласованию с лечащим врачом прекратили лечение по причинам, не связанным с прогрессированием заболевания или побочными эффектами терапии. Основной причиной прекращения терапии было достижение ПО. Медиана продолжительности лечения анти-PD-1-МАТ составила всего 12 месяцев (диапазон – 0,7–43). Наилучший ОО на терапию к моменту прекращения лечения был ПО у 117 (63%) пациентов, ЧО у 44 (24%) пациентов и стабилизация заболевания у 16 (9%) пациентов. Восемь (4%) пациентов имели неизмеряемую опухоль. Медиана наблюдения за пациентами после прекращения лечения составила 18 месяцев (диапазон – 0,7–48,0), в течение которых 78% пациентов оставались без признаков прогрессирования заболевания. Прогрессирование заболевания отмечалось только у 40 (22%) больных. При этом среднее время до прогрессирования составило 12 месяцев (диапазон – 2–23). Прогрессирование заболевания у пациентов с ПО наблюдалось реже, чем у пациентов с ЧО и стабилизацией заболевания (14, 32 и 50% соответственно). Интересно, что у шести из 19 (32%) пациентов, которым была повторно назначена терапия анти-PD-1 после прогрессирования заболевания, получили новый противоопухолевый ответ.
Данная работа интересна прежде всего тем, что продолжительность терапии анти-PD-1-МАТ до остановки лечения, не связанной с побочными эффектами или прогрессированием, была значительно короче, чем в описанных ранее клинических исследованиях. У пациентов с зафиксированным ПО, получавших терапию свыше шести месяцев, риск рецидива после ее отмены был существенно ниже. При этом среди пациентов с ПО риск прогрессирования был значительно выше у тех, кто иммунотерапию получал менее шести месяцев, по сравнению с пациентами, находившимися на лечении свыше шести месяцев. Исходя из этих данных, можно с осторожностью предположить, что минимальный срок иммунотерапии ингибиторами контрольных точек до достижения ПО должен составлять не менее шести месяцев при условии, что такое лечение безопасно для пациента. У пациентов с ЧО и стабилизацией заболевания риск прогрессирования после прекращения терапии был выше. Оптимальная продолжительность лечения у таких пациентов требует дальнейшего изучения. Повторное лечение анти-PD-1 после ранее выявленного прогрессирования может привести к возобновлению противоопухолевого ответа у ряда пациентов.
Медиана наблюдения за пациентами после прекращения иммунотерапии составила 18 месяцев. За это время у 40 (22%) пациентов выявлено прогрессирование заболевания. Полученные результаты сопоставимы с данными исследования KEYNOTE-006 (у 18% больных зафиксировано прогрессирование заболевания при медиане наблюдения 20 месяцев) [28]. Если продолжать сравнивать данные с результатами KEYNOTE-006, то в работе Y.J.L. Jansen и соавт. было больше пациентов (185 против 103), при этом количество пациентов с ПО также было выше (63 vs 27%). Вместе с тем количество пациентов, получавших анти-PD-1 в качестве первой линии терапии, было меньше (43 vs 66%). Примечательно, что 50% ранее принимали ипилимумаб, а 15% – ТТ, однако это не влияло на риск прогрессирования заболевания.
В ретроспективном исследовании Y.J.L. Jansen и соавт. пациенты с ЧО, которые прекратили терапию анти-PD-1 в отсутствие побочных эффектов, обусловленных терапией или прогрессированием заболевания, имели более высокий риск развития последующего прогрессирования по сравнению с пациентами – участниками проспективного исследования KEYNOTE-006 (32 vs 14%).
Чтобы оценить оптимальную продолжительность терапии ингибиторами контрольных точек, в настоящее время начато три клинических исследования: STOP-GAP (NCT02821013), SAFE-STOP (NTR7502) и DANTE (EDURACT2017-002435-42).
В канадском исследовании STOP-GAP (NCT02821013) оценивают эффективность прерывистого (интермиттирующего) и непрерывного режимов терапии. Основная цель исследования – оценка ОВ [29]. В исследовании принимают участие 614 пациентов, которые после 16 недель терапии анти-PD-1-МАТ будут рандомизированы на две группы. Пациенты первой группы будут получать терапию в течение стандартных двух лет, пациенты второй – до достижения максимального противоопухолевого ответа. После достижения максимального противоопухолевого ответа терапия во второй группе будет приостановлена. Терапия анти-PD-1-МАТ возобновится только в случае прогрессирования заболевания. Максимальный противоопухолевый ответ определяется по результатам по крайней мере двух инструментальных обследований с использованием методов лучевой диагностики, выполненных с трехмесячным интервалом. Помимо оценки оптимальной продолжительности терапии в исследовании STOP-GAP в большей степени будет оценена роль возобновления терапии.
В исследовании DANTE (ISRCTN15837212), инициированном Национальным институтом медицинских исследований Великобритании (NIHR), пациенты, получающие анти-PD-1-МАТ и не имеющие признаков прогрессирования заболевания, спустя 12 месяцев терапии будут рандомизированы на две группы. В первой группе терапия анти-PD-1-МАТ будет остановлена (возобновление возможно только в случае прогрессирования), во второй группе продолжена по стандартной схеме [29]. Основной целью данного исследования станет оценка ВБП. Запланирована рандомизация 1208 пациентов пoсле 12-месячной терапии. В данной работе дополнительно изучат биомаркеры – предикторы ответа на терапию и предикторы токсичности терапии, среди которых генетические сигнатуры, циркулирующая опухолевая ДНК, микробиота кишечника и результаты 18F-FDG ПЭТ-КТ.
Одним из методов инструментальной диагностики, позволяющих принять решение о прекращении иммунотерапии ингибиторами контрольных точек у пациентов, достигших максимальной пользы от этого лечения, может быть ПЭТ-КТ. Подтверждение тому – результаты опубликованных исследований.
Так, исследователи из Института меланомы в Австралии оценили, могут ли результаты ПЭТ с [18F] 2-фтор-2-дезокси-D-глюкозой предоставить более точную прогностическую информацию по сравнению со стандартными критериями ответа по КТ [30]. Авторы провели ретроспективный анализ пациентов с метастатической меланомой, получавших иммунотерапию анти-PD-1-МАТ с исходной и годичной оценкой противоопухолевого ответа по результатам FDG-ПЭТ и обычной КТ. Одногодичный ответ был определен с использованием RECIST-критериев для КТ и EORTC-критериев для ПЭТ. У пациентов оценивали частоту ПО, ЧО, стабилизаций и прогрессирования заболевания по результатам КТ. Кроме того, исследователи оценивали частоту полных метаболических ответов (ПМО), частичных метаболических ответов (ЧМО), метаболических стабилизаций заболевания (МСЗ) или метаболического прогрессирования заболевания (МПЗ) по результатам ПЭТ. В исследовании приняли участие 104 пациента. Медиана наблюдения составила 30,1 месяца. 98% пациентов к моменту анализа данных были живы. Большинство больных (67%) получали иммунотерапию анти-PD-1-МАТ в монорежиме, часть пациентов (31%) – комбинацию ниволумаба и ипилимумаба. Спустя год терапии по результатам КТ у 28% пациентов зафиксирован ПО, у 66% – ЧО, у 6% – стабилизация заболевания. При этом по результатам ПЭТ уже 75% имели ПМО, 16% – ЧМО и 9% – МСЗ/МПЗ. ПМО по результатам ПЭТ зафиксирован у 68% пациентов с ЧО по результатам КТ. ВБП у пациентов с ПО, ЧО и стабилизацией заболевания была одинаковой. При этом у пациентов с ПМО ВБП была достоверно выше (медиана не достигнута), чем у пациентов, не достигнувших ПМО (медиана ВБП 12,8 месяца), отношение рисков (ОР) 0,06 (95% ДИ 0,02–0,23) (p < 0,01). Анализ ВБП у пациентов с ЧО по результатам КТ показал, что те пациенты, у которых ЧО по КТ сопровождался ПМО по ПЭТ, имели лучшие результаты ВБП (медиана не достигнута), чем пациенты с ЧО по КТ, но без ПМО по ПЭТ (медиана ВБП 12,8 месяца), ОР 0,07 (95% ДИ 0,02–0,27) (p < 0,01). Двухгодичная ВБП у пациентов с ПМО ставила 96% против 49% у пациентов без ПМО (ОР 0,06; 95% ДИ 0,02–0,23). Среди 78 пациентов с ПМО по ПЭТ 78% пациентов завершили терапию, у 96% из них ответ сохранялся.
Данная работа еще раз доказывает, что, хотя ПО по КТ на иммунотерапии фиксируют лишь у небольшой части пациентов, у большинства пациентов с ЧО по КТ при ПЭТ выявляют длительные полные метаболические ответы, которые сохраняются и после прекращения иммунотерапии.
Руководствуясь данным наблюдением, ряд авторов рекомендуют продолжать лечение до достижения ПО и прекращать терапию после второго подтверждающего ПО инструментального исследования [31]. Подобный подход нашел отражение и в российских клинических рекомендациях по меланоме кожи и слизистых оболочек [22].
Если на фоне терапии достигнут ЧО и впоследствии заболевание стабилизируется, результаты ПЭТ-КТ могут быть использованы для принятия решения о прекращении лечения менее чем через два года терапии.
Помимо результатов ПЭТ, которые можно рассматривать как предикторы ПО и прекращения иммунотерапии, исследователи активно обсуждают и другие факторы. К ним можно отнести динамику изменения опухолевого ответа с помощью измерения циркулирующей опухолевой ДНК, а также исходные и молекулярно-генетические характеристики опухоли (например, сигнатуры экспрессии генов или мутационная нагрузка) [32, 33]. Эти показатели считаются достойными кандидатами в предикторы определения оптимизированных индивидуальных графиков лечения у пациентов, получающих терапию анти-PD-1, особенно у пациентов без ПО.
Оптимальная продолжительность терапии BRAF/MEK-ингибиторами
Итак, при системной иммунотерапии оптимальная продолжительность лечения не превышает двух лет, поскольку вызываемый этими препаратами противоопухолевый ответ, как правило, носит стойкий характер. Что касается таргетной терапии, до сих пор неизвестно, безопасно ли прекращение лечения после достижения ПО, ведь эффект может в значительной степени зависеть от постоянного ингибирования киназы. В большинстве клинических исследований ингибиторов BRAF ± MEK терапию продолжают без остановки (или до прогрессирования либо непереносимой токсичности). На текущий момент немногочисленные публикации с результатами прекращения системной таргетной терапии BRAF/MEK-ингибиторами метастатической МК после достижения ОО свидетельствуют скорее о негативных результатах подобного подхода. Поэтому вопрос, продолжать ли таргетную терапию BRAF-ингибиторами до прогрессирования или она может быть остановлена в более ранний срок без потери клинической пользы, остается открытым. Вопрос о конечности ТТ имеет и большое клиническое значение, поскольку сопутствующая терапии токсичность даже невысокой степени способна существенно влиять на качество жизни пациента и потенциальный риск возникновения вторичных злокачественных опухолей вследствие парадоксальной активации пути MAP-киназы с ингибиторами BRAF. Кроме того, неопределенные сроки лечения имеют экономические последствия для системы здравоохранения в целом.
Всего в нескольких ретроспективных исследованиях сообщалось о результатах лечения пациентов с ММ после запланированного прекращения ТТ.
По данным C. Desvignes и соавт., у всех 11 пациентов с ПО на фоне монотерапии BRAFi после ее отмены отмечалось прогрессирование заболевания [34]. В исследовании принимали участие 11 пациентов, у пяти из них на фоне монотерапии BRAFi зафиксирован ПО, у шести пациентов с ЧО на фоне BRAFi впоследствии было выполнено хирургическое удаление оставшейся опухоли (R0 резекция). Медиана времени до достижения наилучшего ответа (ПО или ЧО) на фоне BRAFi у всех 11 пациентов составила 105 (29–341) дней, медиана наблюдения за пациентами от начала терапии BRAFi – 769 (435–1765) дней. Медиана времени до прогрессирования после отмены BRAFi у всех 11 пациентов составила 82 (27–322) дня. Интересно, что медиана времени до прогрессирования у пяти больных с ПО, достигнутом только на фоне терапии BRAFi, достигла 136,5 (34–322) дня. У шести пациентов с ЧО и последующим радикальным хирургическим удалением метастазов медиана времени до прогрессирования составила всего 82 (27–144) дня.
M.S. Carlino и соавт. описали 12 пациентов, у которых монотерапия BRAFi (n = 5) или комбинацией BRAFi/MEKi дабрафениба и траметиниба (n = 7) была прекращена после достижения ПО, у шести пациентов после отмены ТТ наблюдалось прогрессирование заболевания [35]. У всех пациентов после достижения ПО таргетная терапия была прекращена по причинам, не связанным с прогрессированием болезни. Основной причиной прекращения ТТ стала токсичность лечения, в одном случае – RAS-ассоциированный рак поджелудочной железы, возможно вызванный индуцированной ингибитором BRAF парадоксальной активацией MAPK-пути. В исследовании оценивали ВБП, характер прогрессирования и ответ на последующую терапию. Среднее время от начала лечения до ПО составило 6,5 месяца (диапазон – 1,6–18,6). Средняя продолжительность лечения при ПО достигла восьми месяцев. Медиана наблюдения после прекращения лечения составила 16 месяцев (диапазон – 2,9–59,5). С момента начала лечения медиана ВБП составляла 49,2 месяца, а 24-месячная ВБП – 64,8%. Медиана времени до прогрессирования после отмены терапии исчислялась 6,6 месяца. У всех пациентов с рецидивом заболевания после отмены ТТ рецидив возник в органе, где уже имелись метастазы. Помимо этого у трех пациентов появились метастазы в новых органах. Авторы не смогли выявить прогностические факторы рецидива заболевания, поскольку клинические характеристики пациентов с рецидивом после отмены ТТ были такими же, как у пациентов без рецидива. Все больные с рецидивом имели нормальный уровень ЛДГ в начале исследования. Кроме того, не установлено никакой разницы во времени до достижения ПО, продолжительности лечения или связанных с лечением токсических эффектах, которые привели к прекращению ТТ. Среднее время от прекращения лечения до рецидива заболевания составило 6,6 месяца (от 1,6 до 21 месяца). Из шести пациентов с рецидивом заболевания после отмены ТТ трое впоследствии получили повторную терапию комбинацией дабрафениба и траметиниба, у двух из них на фоне возобновления ТТ был достигнут ЧО.
Авторы публикации указывают на отсутствие корреляции между продолжительностью ТТ и временем сохранения ответа после того, как лечение прекращено. Например, один пациент, который прекратил лечение через пять месяцев, не имел признаков прогрессирования 59 месяцев. У другого пациента, получавшего монотерапию дабрафенибом в течение 60 месяцев, напротив, рецидив случился через 9,7 месяца после прекращения лечения. В статье описан клинический случай еще одного пациента, получавшего монотерапию вемурафенибом в течение 5,7 месяца. ЧО у него был зафиксирован через 2,6 месяца после отмены таргетной химиотерапии, ПО сохраняется свыше 44 месяцев.
В другой работе C. Vanhaecke и соавт. представили результаты ретроспективного двухцентрового исследования, в котором у 16 пациентов с метастатической МК и ПО на лечение была прекращена таргетная химиотерапия BRAF-ингибиторами [36]. У двух пациентов имела место IIIC стадия, у 14 пациентов – IV стадия (у десяти – M1a, у двух – M1b, у двух – M1c, без метастазирования в мозг). У всех пациентов уровень ЛДГ не превышал верхней границы нормы. У 11 из 16 пациентов (69%) терапия BRAFi проводилась в первой линии. 14 (87%) пациентов получали вемурафениб, один пациент – дабрафениб и один – энкорафениб. Средняя продолжительность лечения BRAFi составила 21 месяц (в среднем 19, диапазон – 2–36). 12 (75%) пациентам на фоне терапии потребовалось снижение дозы из-за побочных эффектов. Среднее время между началом терапии BRAFi и ПО составило шесть месяцев (в среднем 7,9, диапазон – 2–23). У десяти пациентов терапия BRAFi была прекращена из-за НР. У шести пациентов терапию прервали по желанию самого пациента. Среднее время между подтверждением ПО и прекращением лечения составило шесть месяцев (в среднем 7,8, диапазон – 0–32). Медиана наблюдения после прекращения терапии BRAFi составила 12 месяцев (в среднем 13,6, диапазон – 3–28). Во время наблюдения один пациент выбыл из исследования, данные по нему недоступны.
У восьми (53%) пациентов после отмены терапии BARFi произошел рецидив, у трех из которых (37%) были выявлены метастазы в головном мозге. Только у одного (13%) больного метастазирование произошло в новый орган, у остальных рецидив опухоли отмечался в ранее пораженных органах. В группе пациентов с рецидивом опухоли среднее время между ПО и прекращением лечения составило 3,5 месяца (в среднем 4,6, диапазон – 0–14). Среднее время между прекращением лечения и рецидивом составило 2,5 месяца (в среднем 3,75, диапазон – 1–9). Шести пациентам после рецидива впоследствии была назначена комбинированная терапия BRAF + MEK-ингибиторами дабрафенибом и траметинибом, а один пациент повторно получил монотерапию вемурафенибом. Еще один пациент сначала получал пембролизумаб в течение года, а затем комбинацию «дабрафениб + траметиниб». Повторное назначение BRAF/MEK-ингибиторов привело к двум ПО, трем ЧО и одной стабилизации заболевания. У двух пациентов ответ не был оценен к моменту анализа данных.
У семи (47%) пациентов без рецидива заболевания после отмены BRAFi медиана наблюдения составила 12 месяцев (в среднем 13,7, диапазон – 6–25). Один пациент умер от старости (смерть, не связанная с меланомой).
Между пациентами с рецидивом и без рецидива заболевания после отмены BRAFi не было различий по возрасту постановки диагноза меланомы, временем между диагностикой первичной опухоли и метастазами, количеству линий терапии, предшествовавшей назначению BRAFi, или продолжительности терапии BRAFi как до достижения ПО, так и после него.
Авторы отмечают, что средняя продолжительность терапии BRAFi до достижения ПО, как правило, была больше у пациентов с рецидивом болезни, – 8 vs 2,5 месяца у пациентов без рецидива. При этом средняя продолжительность лечения после достижения ПО до отмены BRAFi была короче у пациентов с рецидивом – 3,5 против 13 месяцев у пациентов без рецидива.
Одна из гипотез причин рецидива заболевания после достижения ПО и прекращения ТТ состоит в том, что остающиеся под цитостатическим контролем микрометастазы после прекращения терапии начинают вновь расти. Это может быть обусловлено, например, отсутствием в опухоли пептида PTEN. В этом случае BRAF-ингибиторы не способны индуцировать апоптоз, но оказывают цитостатическое действие на опухоль [37]. Не исключено, что именно гетерогенность опухоли по пептиду PTEN объясняет, почему рецидив меланомы после отмены ТТ возникает не у всех пациентов.
Прекращение терапии BRAFi/MEKi после достижения полного или частичного ответа на лечение и тем более стабилизации не может быть рекомендовано рутинно всем пациентам, получающим эту терапию, поскольку клиническое течение меланомы в такой ситуации непредсказуемо. Однако у части пациентов НР, возникающие в результате лечения BRAFi/MEKi, могут привести к прекращению терапии. Решение о прекращении терапии BRAFi/MEKi должно приниматься индивидуально в каждом конкретном случае.
С учетом вышеизложенного прекращение таргетной терапии BRAFi/MEKi после достижения полного ответа при условии, что пациент хорошо переносит это лечение, не может быть рекомендовано. Однако, отменяя терапию BRAFi/MEKi на фоне достижения объективного ответа, следует помнить о высокой вероятности повторного ответа на терапию в случае ее возобновления.
Заключение
Внедрение в рутинную практику ингибиторов блокаторов иммунного ответа и ингибиторов BRAF/MEK кардинальным образом изменило алгоритмы лечения метастатической меланомы. Иммунотерапия и таргетная терапия стали новым стандартом лечения, что привело к значительному увеличению общей продолжительности жизни пациентов и преодолению в 30–60% случаев пятилетнего рубежа после развития метастатической формы заболевания. Важным событием стала регистрация в апреле 2020 г. первого отечественного ингибитора PD-1 пролголимаба. Между тем ответов на ряд важных с практической точки зрения вопросов пока нет. Возможно, результаты продолжающихся в настоящее время исследований уже в ближайшем будущем позволят индивидуализировать программу лечения для каждого пациента с метастатической меланомой с целью достижения его максимальной эффективности.
G.Yu. Kharkevich, PhD, I.A. Utyashev, PhD, K.V. Orlova, PhD, L.V. Demidov, PhD, Prof.
N.N. Blokhin National Medical Research Center of Oncology
Contact person: Galina Yu. Kharkevich, gkharkevich@mail.ru
The last ten years of metastatic melanoma of the skin treatment have been marked by the appearance of drugs of two directions. We are talking about targeted therapy – BRAF and MEK inhibitors and immuno-oncological therapy – anti-PD-1- and anti-CTLA4-inhibitors. The effectiveness of these drugs in patients with metastatic melanoma of the skin allowed it to move from the category of a chemoresistant tumor to the tumor sensitive to drug therapy, and, as a result, significantly increase the overall survival of patients. Recently, the median overall survival was 6–9 months, with only a few patients surviving a year. Currently, more than 50% of patients have a chance to overcome the five-year threshold. The article presents updated data on the effectiveness of targeted and immuno-oncological drugs in metastatic melanoma. Discussed topical issues related to the duration of therapy when the response is achieved, the optimal sequence and choice of first-line therapy in a patient with the mutation in the BRAF gene, and the ability to return to the therapy that was effective earlier. These problems arise in the process of the accumulation of the experience of modern drugs use in the routine clinical practice.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.