Ликсисенатид – прандиальный агонист рецептора глюкагоноподобного пептида-1
- Аннотация
- Статья
- Ссылки
- English



В России, как и в других странах, отмечаются высокие темпы роста заболеваемости сахарным диабетом (СД). По данным государственного регистра больных СД, на январь 2015 г. зарегистрировано уже 4,1 млн человек. При этом с СД типа 1 – 340 тыс., СД типа 2 – 3,7 млн. Однако результаты контрольно-эпидемиологических исследований, проведенных Эндокринологическим научным центром с 2002 по 2010 г., показали, что численность больных СД в России в три-четыре раза выше официально зарегистрированной – 9–10 млн, что составляет около 7% населения [1].
Согласно статистике около 20% взрослого населения Земли имеют нарушение углеводного обмена той или иной степени.
Не вызывает сомнений, что даже нарушение толерантности к глюкозе, так же как и СД, может способствовать развитию осложнений, в первую очередь сосудистых. Высокая частота сердечно-сосудистых осложнений, приводящих к фатальным исходам более чем у 70% больных, дала основание Американской кардиологической ассоциации отнести диабет к сердечно-сосудистым заболеваниям [2].
Данные A. King и соавт. подтверждают, что сердечно-сосудистые заболевания по-прежнему остаются самой частой причиной смерти пациентов с нарушениями углеводного обмена во всем мире [3].
В основе развития осложнений СД лежит хроническая гипергликемия. Многочисленные исследования подтверждают, что она активирует ряд биохимических процессов, в ходе которых образуются конечные необратимые продукты гликозилирования, протеинкиназа С и высокореактивные соединения кислорода, играющие значительную роль в этиологии сосудистых осложнений [4]. Установлено, что в результате хронической гипергликемии происходит интенсивное образование свободных радикалов, которые могут связываться с молекулами липидов и приводить к раннему развитию атеросклероза. А связывание молекулы оксида азота, мощного вазодилататора, секретируемого эндотелием, ингибирует его действие, что еще больше усугубляет эндотелиальную дисфункцию и ускоряет развитие макроангиопатии.
Таким образом, эффективный и безопасный контроль гликемии способен отсрочить или даже предупредить осложнения СД.
В последние годы особый интерес вызывают группы антидиабетических препаратов, способных регулировать гликемию путем влияния на секрецию инсулина и глюкагона в зависимости от ее уровня. Их создание стало результатом крупных научных открытий 80-х гг. ХХ в., в частности желудочно-кишечных инкретинов – инсулинотропных гормонов. Основные инкретиновые гормоны, глюкозозависимый инсулинотропный полипептид (ГИП) и глюкагоноподобный пептид 1 (ГПП-1), высвобождаются после попадания в пищеварительный тракт питательных веществ преимущественно из L- и K-клеток, расположенных главным образом в проксимальной и дистальной части тонкой кишки соответственно [5]. Оба инкретина способствуют секреции инсулина, однако ГПП-1 в этом отношении более эффективный. Кроме того, ГПП-1 ингибирует высвобождение глюкагона, замедляет опорожнение желудка и усиливает чувство насыщения, что приводит к снижению массы тела [6].
Осознание того, что сам по себе эффект инкретина при СД типа 2 недостаточен, привело к разработке препаратов на основе его действия. Для восстановления и поддержания эффекта ГПП-1 использованы две стратегии [6]:
1) пероральный прием ингибиторов дипептидилпептидазы 4 (ДПП-4), вызывающей быстрое расщепление ГПП-1 в условиях in vivo;
2) парентеральное введение миметиков ГПП-1, устойчивых к ДПП-4, – агонистов рецепторов ГПП-1 (АР ГПП-1).
Метаболические эффекты АР ГПП-1, дополненные потенциальными эффектами (кардиопротективным и сосудорасширяющим), особенно актуальны для больных СД типа 2.
Поскольку действие АР ГПП-1 проявляется только в условиях гипергликемии, к минимуму сводится риск развития гипогликемии (в отсутствие сопутствующей терапии препаратами, способствующими секреции инсулина, или дополнительного введения инсулина).
Нативный ГПП-1 в нормальных физиологических условиях вырабатывается в ответ на прием пищи и стимулирует секрецию инсулина, регулируя постпрандиальные колебания глюкозы. Следовательно, инкретиновая система предотвращает чрезмерную постпрандиальную гликемию и ее потенциально неблагоприятное воздействие на эндотелий сосудов, приводящее к развитию сердечно-сосудистых заболеваний.
Постпрандиальная гликемия и сахароснижающие препараты
Традиционные пероральные сахароснижающие препараты (ПССП), такие как препараты сульфонилмочевины, не оказывают непосредственного воздействия на постпрандиальную гликемию. Только ингибиторы альфа-глюкозидазы и короткодействующие глиниды способны ограничивать ее колебания.
Одним из барьеров для достижения целевых показателей гликозилированного гемоглобина (HbA1c) у пациентов, получающих в том числе базальный инсулин, являются высокие показатели постпрандиальной гликемии. В подобных случаях возникает необходимость многократных инъекций инсулина короткого действия перед основными приемами пищи или применения АР ГПП-1.
В настоящее время для лечения СД типа 2 применяются четыре АР ГПП-1 [7]:
-
эксенатид;
-
эксенатид медленного высвобождения;
-
лираглутид;
-
ликсисенатид.
Однако в настоящее время разработаны и другие АР ГПП-1, например албиглутид и семаглутид [8].
Следует отметить, что перечисленные АР ГПП-1 имеют разный фармакологический профиль (табл. 1). Среди них выделяют классические прандиальные и непрандиальные. Прандиальные АР ГПП-1 короткого действия подавляют секрецию глюкагона и снижают перистальтику и опорожнение желудка, приводя к замедлению всасывания глюкозы в тонкой кишке и опосредованно к умеренному снижению постпрандиальной секреции инсулина. Непрандиальные АР ГПП-1 длительного действия непосредственно влияют на поджелудочную железу, стимулируя секрецию инсулина и подавляя секрецию глюкагона. При этом непрандиальные АР ГПП-1 способствуют умеренному снижению постпрандиальной гликемии и значительному гликемии натощак за счет подавления секреции глюкагона и снижения аппетита.
АР ГПП-1, влияющими преимущественно на постпрандиальную гликемию, являются эксенатид и ликсисенатид. Структуры предназначенных для ежедневного применения эксенатида и ликсисенатида аналогичны. Эксенатид является синтетической формой эксендина 4, пептида из 39 аминокислотных остатков, выделенных из секрета слюнных желез аризонского ядозуба, который сохраняет частичную гомологию последовательности с ГПП-1 и является мощным АР ГПП-1 [6]. Ликсисенатид представляет собой аналог эксендина 4 из 44 аминокислотных остатков с более длинной С-концевой последовательностью [9]. Период полувыведения эксенатида составляет около двух часов, поэтому требуется введение дозы два раза в день. Период полувыведения ликсисенатида – 2,8 часа [7]. Оба агониста являются короткодействующими: время до достижения пиковой концентрации – около двух часов [10].
Сродство к рецепторам ГПП-1 ликсисенатида примерно в четыре раза выше по сравнению с человеческим ГПП-1, в то время как сродство эксенатида аналогично нативному ГПП-1 [11].
К непрандиальным АР ГПП-1 относятся эксенатид медленного высвобождения, лираглутид, албиглутид и семаглутид. Благодаря различным механизмам происходит задержка всасывания веществ из подкожной ткани. В результате увеличивается продолжительность действия препаратов.
Исследование ликсисенатида
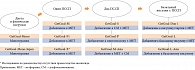
Эффективность и переносимость ликсисенатида оценивались в фазе III программы GetGoal: 11 рандомизированных исследований (рис. 1). В работе участвовали более 5000 пациентов с СД типа 2. Ликсисенатид принимали в дозе 20 мкг прандиально один раз в день.
Первичной конечной точкой исследований был уровень HbA1c, вторичной – значения постпрандиальной гликемии. Изменение последнего показателя через 2 часа после приема пищи относительно исходных значений указывали в виде среднего значения.
При анализе результатов клинических исследований ликсисенатида (Ликсумии) учитывались длительность СД типа 2 и исходный тип базовой терапии. Средняя продолжительность заболевания – от 1,1 до 14,1 года. Тип базового лечения варьировал от отсутствия фармакотерапии до применения двух ПССП ± базальный инсулин (рис. 1).
В семи исследованиях указывались значения постпрандиальной гликемии: GetGoal-Mono [12], GetGoal-M [13], GetGoal-S [14], GetGoal-L [15], GetGoal-L-Asia [16], GetGoal-M-Asia [17] и GetGoal-Duo 1 [18].
Дополнительные цели исследований:
-
доля пациентов с уровнем HbA1с < 7% и ≤ 6,5%;
-
изменение глюкозы плазмы натощак;
-
массы тела;
-
уровня глюкагона, инсулина, проинсулина и С-пептида в течение двух часов после теста с пищевой нагрузкой (избранные исследования);
-
оценка функции бета-клеток с помощью индекса HOMA-бета (избранные исследования);
-
функции бета-клеток через четыре недели после терапии (GetGoal-M);
-
изменение характера ответов в опросниках PAGI-QoL (GetGoal-X);
-
выявление преимуществ однократного применения препарата утром или вечером (GetGoal-M);
-
безопасность.
Ликсисенатид в отсутствие базовой фармакотерапии
Эффективность ликсисенатида в дозе 20 мкг/сут оценивалась в 28-дневном рандомизированном двойном слепом плацебоконтролируемом с параллельными группами исследовании фазы II у пациентов с СД типа 2 (рис. 2), а также в 12-недельном исследовании GetGoal-Mono-Japan [12]. Ликсисенатид после стандартизованного завтрака существенно замедлял скорость опорожнения желудка, с чем в определенной степени связано снижение постпрандиальной гликемии. В исследовании GetGoal-Mono-Japan ликсисенатид способствовал значимому улучшению значений HbA1c, глюкозы плазмы натощак и постпрандиальной гликемии по сравнению с плацебо. Так, через два часа после приема пищи постпрандиальная гликемия снизилась на 5,5 ммоль/л относительно исходного уровня 14,6 ммоль/л при одноэтапном повышении дозы и на 4,5 ммоль/л относительно исходного уровня 14,8 ммоль/л при двухэтапном повышении дозы (p < 0,0001).
Ликсисенатид при субоптимальном контроле гликемии на различных режимах моно- и комбинированной пероральной антидиабетической фармакотерапии
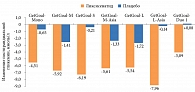
В исследовании GetGoal-Mono ликсисенатид по сравнению с плацебо способствовал значимому снижению постпрандиальной гликемии после завтрака (p < 0,001) и на 75% уменьшал постпрандиальные колебания уровня глюкозы (рис. 3) [19].
Аналогичные результаты получены в отношении ликсисенатида у пациентов, ранее субоптимально контролируемых метформином (GetGoal-M) и препаратами сульфонилмочевины (GetGoal-S).
В 24-недельном исследовании GetGoal-M у пациентов с субоптимальным контролем гликемии на монотерапии метформином ликсисенатид как при утреннем, так и при вечернем применении снижал уровень HbA1с по сравнению с плацебо [13]. В частности, при утреннем приеме ликсисенатида постпрандиальная гликемия снизилась на 5,9 ммоль/л относительно исходного уровня, плацебо – на 1,4 ммоль/л.
В 24-недельном исследовании у пациентов, получавших лечение комбинацией «сульфонилмочевина ± метформин» (GetGoal-S), ликсисенатид значимо уменьшал уровень HbA1с по сравнению с плацебо (p < 0,0001) и выраженно постпрандиальную гликемию – -6,2 против -0,2 ммоль/л соответственно [14].
Ликсисенатид в комбинации с базальным инсулином
Широкое внедрение ранней инсулинотерапии больным СД типа 2 способствовало увеличению числа пациентов, применяющих преимущественно базальный инсулин в комбинации с ПССП.
В трех исследованиях фазы III (n = 1253) изучалось влияние ликсисенатида на значения постпрандиальной гликемии у лиц с субоптимальным контролем гликемии комбинацией базального инсулина с ПССП [15, 16, 18] (табл. 2).
В исследовании GetGoal-L-Asia участвовало 311 пациентов монголоидной расы с недостаточным контролем гликемии на фоне комбинации базального инсулина и сульфонилмочевины [16]. Больные были рандомизированы на две группы. В течение 24 недель первая группа (n = 154) получала ликсисенатид в дозе 20 мкг один раз в день, вторая (n = 157) – плацебо. В группе ликсисенатида постпрандиальная гликемия снизилась до 9,9 ммоль/л (при исходном значении 17,8 ммоль/л), при этом в группе плацебо зарегистрированы незначительные изменения или их отсутствие. Выраженное снижение постпрандиальной гликемии сопровождалось снижением уровня HbA1с на 0,77%. В группе плацебо указанный показатель повысился на 0,11% (p < 0,0001).
В исследовании GetGoal-L под действием ликсисенатида постпрандиальная гликемия снизилась на 5,5 ммоль/л относительно исходного уровня 16,4 ммоль/л, в группе плацебо – лишь на 1,7 ммоль/л относительно исходного уровня 15,9 ммоль/л. В обеих группах наблюдалось уменьшение уровня HbA1с – -0,7% и -0,4% соответственно [15].
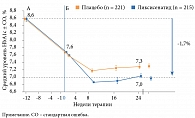
Дизайн исследования GetGoal-Duo 1 отличался от дизайна исследований GetGoal-L и GetGoal-L-Asia [18]. Пациенты с субоптимальным контролем гликемии (исходный уровень HbА1с в среднем составил 8,6%), несмотря на применение различных пероральных препаратов, главным образом метформина, а также препаратов сульфонилмочевины или тиазолидиндионов, в течение 12 недель получали инсулин гларгин, который титровался до целевого показателя гликемии плазмы натощак < 5,6 ммоль/л. Через 12 недель терапии инсулином гларгин и метформином с тиазолидиндионами или без них среднее значение HbА1с снизилось до 7,6%. К получаемой терапии были добавлены ликсисенатид или плацебо. После завершения двойного слепого периода лечения длительностью 24 недели у пациентов, рандомизированных в группу ликсисенатида, уровень HbА1с снизился на 1,7% (рис. 4). В отношении постпрандиальной гликемии в группе ликсисенатида отмечено снижение на 3,1 ммоль/л, в группе плацебо – на 0,1 ммоль/л.
Кроме того, в комбинации с базальным инсулином и метформином или сульфонилмочевиной ликсисенатид в дозе 20 мкг один раз в сутки оказывал благоприятный эффект на массу тела. В исследовании GetGoal-L на фоне его приема отмечено снижение массы тела в среднем на 1,8 кг, что было значимо по сравнению со снижением массы тела на фоне приема плацебо – -0,5 кг (р < 0,0001).
В исследовании GetGoal-L-Asia в результате применения ликсисенатида масса тела в среднем уменьшилась на 0,38 кг, что не было статистически значимым по сравнению с плацебо – +0,06 кг (р < 0,09) [16].
В исследовании GetGoal-Duo 1, наоборот, у пациентов, получавших ликсисенатид, зафиксировано повышение массы тела в среднем на 0,28 кг, что было статистически значимо ниже, чем в группе плацебо (+1,16 кг) (р = 0,0012).
Таким образом, ликсисенатид в комбинации с базальным инсулином клинически значимо и стойко снижает уровень HbA1c, выгодно изменяет массу тела.
Необходимо отметить, что новое положение Американской диабетической ассоциации/Европейской ассоциации по изучению сахарного диабета одобряет добавление АР ГПП-1 к терапии базальным инсулином.
Побочные эффекты ликсисенатида
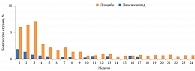
Наиболее частыми побочными явлениями, связанными с приемом ликсисенатида, являются тошнота и рвота, как правило низкой или средней интенсивности. На рисунке 5 представлена частота возникновения тошноты у пациентов, принимавших ликсисенатид, согласно данным европейского отчета по оценке препарата за 2013 г.
Начало и пик этих явлений приходились на первые три недели терапии, далее их интенсивность сокращалась. Практически 80% пациентов, имевших эпизоды тошноты или рвоты, не прерывали терапию.
Частота возникновения клинически выраженной гипогликемии была незначительной. В случае монотерапии клинически выраженная гипогликемия (определена как группа связанных с гипогликемией симптомов, сопровождающихся снижением концентрации глюкозы в крови < 3,3 ммоль/л) зафиксирована у 1,7% участников группы ликсисенатида и у 1,6% участников группы плацебо. При использовании в комбинации с метформином (GetGoal-M) такие случаи отмечались у трех из 161 (1,9%), четырех из 161 (2,5%) участников групп одноэтапной и двухэтапной титрации ликсисенатида и одного из 160 (0,6%) участников группы плацебо.
При добавлении к терапии ликсисенатидом препаратов сульфонилмочевины частота гипогликемии увеличивалась за счет глюкозонезависимой стимуляции секреции инсулина последними. Так, в исследовании GetGoal-S частота эпизодов клинически выраженной гипогликемии в группе ликсисенатида была выше, чем в группе плацебо, – 15,3 против 12,3%.
Приведенные данные подтверждают ограниченный риск развития гипогликемии при приеме ликсисенатида [19].
A.M. Mkrtumyan
Moscow State University of Medicine and Dentistry named after A.I. Evdokimov
Contact person: Ashot Musayelovich Mkrtumyan, vagrashot@mail.ru
According to the most conservative estimate, around 20% of global adult human population suffer from impaired carbohydrate metabolism of various intensity. It was found that even impaired glucose tolerance similar to diabetes mellitus may facilitate to development of complications primarily vascular complications. Due to the fact that efficacious and safe glycemia control may postpone or even prevent complications related to diabetes mellitus, special attention is paid to groups of anti-diabetic drugs able to regulate blood glucose level by acting on secretion of insulin and glucagon depending on glucose level in the blood. Among them, a prandial glucagon-like peptide-1 receptor agonist lixisenatide belongs to this group. Results obtained assessing efficacy and tolerability of lixisenatide administered during various treatment protocols are presented in the paper.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.