Роль витаминно-минеральных комплексов с фолиевой кислотой в профилактике врожденных пороков сердца и дефектов нервной трубки
- Аннотация
- Статья
- Ссылки
- English
Врожденные пороки развития
Врожденные пороки развития (ВПР), или врожденные аномалии, включают все морфологические, функциональные и биохимические/молекулярные нарушения, которые развиваются от момента зачатия до рождения и присутствуют при рождении (независимо от того, были они своевременно обнаружены у конкретного пациента или нет) [1]. Можно выделить следующие разновидности ВПР:
-
генетическая болезнь с ранней манифестацией (например, муковисцидоз);
-
врожденные аномалии или пороки развития определенных систем органов либо всего тела;
-
врожденные опухоли (в частности, тератомы);
-
идиопатическая задержка внутриутробного развития;
-
ВПР вследствие инфекционных заболеваний плода (например, варицеллез плода);
-
иммунологические заболевания (резус-несовместимость матери и плода и др.);
-
умственная отсталость;
-
поведенческие отклонения;
-
функциональные дефекты органов чувств (слепота, глухота и т.д.).
Врожденные пороки сердца (ВПС) и дефекты нервной трубки (ДНТ) являются наиболее распространенными врожденными пороками. В силу их очень раннего возникновения (период пренатального развития) каких-либо очевидных шансов на полное выздоровление пациента нет. Следовательно, эффективная профилактика – единственно возможный подход к решению данной проблемы. Накопленный к настоящему времени клинический опыт указывает на определенный прорыв в профилактике этих ВПР с использованием специальных витаминно-минеральных комплексов (ВМК) с фолиевой кислотой (ФК) в период преконцепции и ранние сроки беременности [1, 2].
Об истории исследований взаимосвязи между ВПР и дефицитом витаминов
Экспериментальные исследования влияния конкретных витаминов на репродуктивную функцию проводились с начала XX века. Например, продемонстрировано влияние витамина А, витаминов группы В, витамина С на фертильность и состояние плаценты [3].
Более конкретные данные о негативном влиянии дефицита витаминов на репродукцию, в частности на формирование пороков развития, были получены к началу 1930-х гг. Так, в 1932 г. F. Hale установил, что диета с дефицитом витамина А у свиноматок в ранние сроки беременности приводила к рождению потомства без глазных яблок, с расщелинами неба, ВПР ушей, неправильным расположением почек и дефектами конечностей [4].
К 1950 г. был накоплен солидный массив экспериментальных и клинических данных, свидетельствовавших об устойчивой взаимосвязи между дефицитом витаминов и ВПР. Диеты, искусственно обедненные по определенным витаминам, стали важным подходом к экспериментальным исследованиям ВПР и ассоциированных с ними гиповитаминозов [5]. M.M. Nelson [6] ввел понятие антиметаболитов (антагонистов витаминов). Это группа химических веществ или лекарственных препаратов, негативно воздействующих на обмен витаминов, в том числе вызывающих гипо- и авитаминоз. Антагонисты витаминов стали активно использоваться для создания моделей по выращиванию потомства на фоне гиповитаминоза, для оценки его влияния на потомство при проведении долгосрочных нутриционных экспериментов in vivo, а также для быстрого тестирования химических свойств веществ на клеточных культурах in vitro.
В ходе указанных исследований были изучены, в частности, антиметаболиты фолатов. Исторический акцент на исследования именно антагонистов фолатов обусловлен несколькими причинами.
Во-первых, достаточно рано в условиях эксперимента было выявлено, что антагонисты фолатов крайне тератогенны и приводят к образованию множественных ВПР, в частности ДНТ и расщелин губы и неба. Позднее тератогенный эффект антифолиевых препаратов (например, аминоптерина, триметоприма) был установлен в клинических исследованиях [7, 8].
Во-вторых, уже в 1964 г. стали появляться исследования, четко указывавшие на более высокий уровень врожденных аномалий (3,0%) у младенцев, рожденных от матерей с дефицитом фолатов во время беременности, по сравнению с контрольной группой (1,6%) [9–10]. Влияние дефицита других витаминов на формирование ВПР было зарегистрировано к середине 1970-х гг. [11].
Дефекты нервной трубки
ДНТ достаточно частая и одна из трагических форм ВПР. Как известно, головной и спинной мозг развиваются из нервной трубки, которая формируется посредством свертывания нервной пластинки на 15-е сутки после зачатия. Срастание нервной пластинки в нервную трубку происходит в черепном и каудальном направлениях и, как правило, завершается на 21–26-е сутки после зачатия в области будущего черепа и на 23–28-е сутки в каудальной части.
Именно эти временные интервалы соответствуют критическим периодам формирования тяжелых ВПР в черепном и каудальном направлениях – анэнцефалии и расщепления позвоночника (spina bifida) [12, 13]. Анэнцефалия представляет собой фактическое отсутствие переднего мозга и свода черепа. Клиническая манифестация расщелины позвоночника – дефект средней линии позвоночника, который обычно затрагивает задние дуги позвонков.
Помимо этих эмбриологических данных необходимо учитывать, что в клинической практике так называемый гестационный возраст рассчитывается от первого дня последнего менструального периода. Поэтому для более реалистичной оценки гестационного возраста к постконцептуальному возрасту необходимо прибавить 14 суток. Таким образом, критический период анэнцефалии приходится на промежуток между 35-м и 40-м днем гестации (21-й postconception день + 14 = 35 и 26-й postconception день + 14 = 40), а для расщелины позвоночника – между 37-м и 42-м гестационным днем [12].
Если анэнцефалия полностью несовместима с жизнью, то при расщелинах позвоночника выживание возможно, хотя и сопровождается тяжелым состоянием новорожденного. Известны четыре проявления расщелины позвоночника:
1) aperta, с открытой (непокрытой) частью спинного мозга;
2) bifida, кистозная форма с грыжевым выпячиванием содержимого спинного мозга, то есть менингоцеле или миеломенингоцеле, покрытая тонкой мембраной;
3) закрытая расщелина позвоночника с менингоцеле или миеломенингоцеле, покрытая нормальной или атрофической кожей;
4) дизрафия, наиболее мягкая форма проявления закрытой расщелины позвоночника, при которой более чем один позвонок страдает от расширения спинного мозга и покрыт кожей с телеангиэктазией, гемангиомой, нарушениями пигментации, гипертрихозом, липомами, ямочками, кожными пазухами или дермоидными кистами.
Очень часто ДНТ коморбидны с вторичными ВПР, такими как гидроцефалия (в 80% случаев с миеломенингоцеле, обычно развивается в течение первых месяцев после родов), косолапость, вывих бедра, недержание мочи и кала (вследствие возникающего нарушения тазовых функций) [13].
При оценке случаев ДНТ необходимо дифференцировать так называемые изолированные и синдромные случаи [13]. Изолированные ДНТ не связаны с другими ВПР, в то время как синдромные ДНТ обязательно включают другие ВПР (например, ДНТ + заячья губа + полидактилия). Синдромные ДНТ могут быть обусловлены хромосомными аберрациями (например, трисомия 13), генетическими дефектами (в частности, синдромом Меккеля – Грубера с аутосомно-рецессивным наследованием) и тератогенами (вальпроевой кислотой и т.д.). Тем не менее синдромные случаи ДНТ представляют собой незначительную часть всех случаев ДНТ (около 10%). Таким образом, изолированные формы – наиболее характерное проявление ДНТ.
Большинство изолированных случаев ДНТ многофакторного происхождения: полигенная предрасположенность сочетается с множеством факторов среды, которые стимулируют или, наоборот, нивелируют эту генетическую предрасположенность. Иными словами, беременная, даже при генетической предрасположенности плода к ДНТ (например, вариант 677Т генетического полиморфизма MTHFR 677C>Т), может родить здорового ребенка при соблюдении адекватной диеты (нормализованной по калорийности, углеводам, белкам, жирам, с достаточным потреблением зеленолистных растений, рыбы и дотациями фолатов и других витаминов).
Существование полигенной предрасположенности подтверждается, в частности, данными семейного анамнеза: при первой степени родства пациентов с ДНТ риск повторного ДНТ в десять раз выше, чем частота первого появления ДНТ в данной популяции.
Одним из важных факторов внешнего воздействия является загрязнение окружающей среды, в том числе экологически неблагоприятные условия труда беременной [14]. Кроме того, имеют значение социально-экономическая зависимость ДНТ (распространенность ДНТ значительно выше среди более бедных слоев населения) и географические различия (в частности, 0,21 случая на 1000 человек в Боготе (столица Колумбии) и 10,5 случая на 1000 человек в Северном Китае). Не менее важным фактором риска являются полигиповитаминозы (сочетанные дефициты многих витаминов) во время зачатия и беременности. Аргументом в пользу значимости этого фактора служит очевидный профилактический эффект от использования ВМК с ФК в период периконцепции [13].
Краткая история первичной профилактики дефекта нервной трубки
В одном из первых клинических исследований, посвященных профилактике ДНТ, изучали эффективность ВМК с ФК 0,36 мг у женщин, у которых хотя бы одна из предыдущих беременностей закончилась рождением ребенка с ДНТ. По сравнению с группой плацебо выявлено 83–91%-ное снижение риска рождения ребенка с ДНТ [15, 16].
Это исследование не являлось рандомизированным, и его результаты не получили широкого признания. Именно поэтому те же исследователи организовали рандомизированное контролируемое исследование (РКИ) [17], в котором были представлены четыре группы: первая – ФК (4 мг), вторая – другие витамины, третья – ФК + другие витамины, четвертая – контроль. Показано, что ФК в фармакологической дозе (4 мг) снижала риск повторения ДНТ на 71% (отношение рисков (ОР) 0,29, 95%-ный доверительный интервал (ДИ) 0,12–0,71).
Применение ВМК с ФК в период периконцепции было включено в протокол Венгерской службы периконцептуальной поддержки (служба начала функционировать в Венгрии в 1984 г. [18]) в формате РКИ под руководством профессора Э. Цейцеля (A. Czeizel) [1]. Половина участниц исследования получала ВМК (препарат Элевит Пронаталь компании «Байер»), в состав которого входило 12 витаминов, в том числе ФК 0,8 мг, В12 4,0 мкг, B6 2,6 мг, B2 1,8 мг, четыре минерала и три микроэлемента, другая половина – плацебо. Добавки принимались по крайней мере в течение одного месяца до зачатия и в течение двух месяцев после него.
В ходе исследования особое внимание уделялось двум вопросам, которые считались крайне актуальными с учетом результатов названных выше исследований по рецидиву ДНТ [11, 15–17].
Во-первых, способен ли прием ВМК с ФК в период периконцепции снизить риск формирования ДНТ, если в анамнезе нет рождения ребенка с ДНТ? Так, у 95% участниц исследования [11, 15–17], вынашивавших плод с ДНТ, в акушерском анамнезе отсутствовало рождение ребенка с ДНТ.
Во-вторых, какая доза ФК наиболее эффективна и безопасна? Фармакологическая доза ФК (4 мг/сут) может иметь определенные отрицательные эффекты (например, стимулировать избыточную пролиферацию тканей, в частности аденоматоз кишечника) [18]. Но эффективны ли более физиологические дозы ФК (1 мг или менее) для профилактики ДНТ и других ВПР?
В ходе исследования была протестирована эффективность ВМК с 0,8 мг ФК. Среди 2391 ребенка, рожденного от участниц, принимавших ВМК, ни у одного не выявлены ДНТ. В то же время шесть случаев ДНТ установлено среди 2471 ребенка, рожденного от участниц из группы плацебо (р = 0,01; ОР 0,07; 95% ДИ 0,01–0,13). Таким образом, венгерское РКИ наглядно проиллюстрировало, что прием ВМК с ФК 0,8 мг способен предотвратить 93% первичных случаев ДНТ [19].
Исходя из очевидных этических соображений, данное РКИ не могло быть продолжено в более широком масштабе. Для получения большего объема клинических данных об эффективности первичной профилактики ДНТ было инициировано контролируемое когортное исследование (ККИ) [20]. Все участницы в когорте получали ВМК с ФК. В контрольную когорту вошли женщины на 14-й неделе беременности, протекавшей без поддержки витаминами, по данным региональных центров по ведению беременных. Защитный эффект от приема ВМК также был подтвержден в 3056 парах «случай – контроль» (ОР 0,11; 95% ДИ 0,01–0,91). Тем не менее частота встречаемости синдромальных ДНТ не ассоциировалась с приемом ВМК с ФК 0,8 мг ни в РКИ, ни в ККИ [21].
В интервенционном исследовании [22] установлена значительно более низкая эффективность применения только ФК без других витаминов в низкой дозе (0,4 мг/сут) с целью профилактики первого появления ДНТ [22]. В районах с высокой распространенностью ДНТ (6,5 случая на 1000 человек) зафиксировано 79%-ное снижение риска ДНТ, в то время как в районах с низкой встречаемостью ДНТ (0,8 случая на 1000 человек) снижение риска ДНТ при использовании ФК 0,4 мг/сут составило всего 41%. Таким образом, по сравнению с результатами исследования [19] (применение ВМК с ФК 0,8 мг/сут, 93%-ное снижение риска) терапия только ФК, к тому же в низких дозах (0,4 мг/сут), гораздо менее эффективна (41%-ное снижение риска).
Данный исторический обзор показывает, что первичная профилактика ДНТ может быть весьма эффективной за счет применения ВМК с ФК в период периконцепции.
Биологическое значение фолатов в профилактике врожденных пороков развития
Фолаты – собирательный термин, который охватывает все замещенные и незамещенные, окисленные и восстановленные, моно- и полиглутаматные формы птероил-L-глутаминовой кислоты (в том числе синтетическую моноглутаматную форму – ФК). Естественная полиглутаматная форма фолатов была выделена и идентифицирована в 1931 г., затем была синтезирована ФК [23].
Рассмотрим биологическую роль и принципы дозирования фолатов, а также взаимосвязь между фолатным дефицитом и гипергомоцистеинемией и формированием ДНТ и других ВПР.
О биологической роли фолатов
Фолаты, играющие важную роль в биосинтезе тимидина и являющиеся ключевым фактором в эпигенетическом метилировании ДНК, регулирующем экспрессию каждого гена в геноме, необходимы для деления и роста клеток. Фолаты нужны и для поддержания реметилирования гомоцистеина в метионин. Очевидно, что названные биологические функции имеют первостепенное значение для нормального развития эмбриона. В связи с этим дефицит фолатов будет стимулировать формирование врожденных пороков, прежде всего ДНТ и ВПС.
Фолаты не могут синтезироваться в организме человека с нуля. Их основными диетарными источниками являются свежие и свежезамороженные зеленолистные овощи, цитрусовые фрукты, печень, хлеб и бобовые. Фолаты поступают в организм частично с пищей, частично за счет использования фолат-содержащих ВМК.
При поступлении в организм и диетарные фолаты, и ФК всасываются в верхней части тонкой кишки. Если ФК всасывается непосредственно, то диетарные фолаты сначала трансформируются в моноглутаматную форму цинк-зависимым ферментом фолат-конъюгазой (гамма-глутамилгидролазой, экспрессия которой максимальна в кишечнике). На следующем этапе всасывания моноглутаматные формы фолатов восстанавливаются в мукозном слое кишечника ферментами дигидроредуктаз (к ним присоединяются атомы водорода) сначала в дигидрофолат, затем в тетрагидрофолат (ТГФ). ТГФ преобразуется в 5,10-метилен-ТГФ и в 5-метил-ТГФ (5-МТГФ), после чего поступает в кровь [24]. Кровь доставляет фолаты ко всем тканям и органам. Потребность мозга, легких, миокарда, скелетных мышц и печени в ТГФ и 5-МТГФ несколько выше, чем других тканей. Часть 5-метил-ТГФ сохраняется в депо в печени, а избыток ФК и различных форм ТГФ экскретируется с мочой.
О дозе фолатов
В ходе перечисленных выше биотрансформаций происходят естественные потери поступающих в организм фолатов. Поэтому при оценке потребности организма в фолатах следует принимать во внимание указанные механизмы преобразований фолатов, которые отражаются на биодоступности. Бидоступность ФК около 60%. Считается, что биодоступность диетарных фолатов не превышает 50%. Важный момент: биодоступность диетарных фолатов существенно зависит от вида пищи и условий ее приготовления – до 80–90% пищевых фолатов утрачиваются при термообработке круп и овощей [24].
J. McPartlin и соавт. [25] предположили, что суточная доза ФК, оптимальная для профилактики ДНТ в период периконцепции, – 0,6–0,7 мг. В то же время, согласно данным L.E. Daly и соавт. [26], низкий риск рождения ребенка с ДНТ ассоциирован с концентрацией фолатов в эритроцитах не менее 906 нмоль/л. Для достижения такого уровня обеспеченности фолатами необходим прием ФК в дозе 0,4 мг в течение 8–12 недель. Использование ФК в дозе 0,8 мг/сут позволяет достичь необходимого уровня концентрации фолатов в эритроцитах уже через 4,2 ± 3,5 недели [27].
Следовательно, рекомендуемое суточное потребление ФК женщинами детородного возраста – 0,7–0,8 мг [28, 29]. Поскольку биодоступность ФК 60%, 0,7–0,8 мг/сут ФК будет соответствовать потреблению эффективной дозы фолатов 0,4–0,5 мг/сут. С учетом не более чем 50%-ной биодоступности диетарных фолатов из 0,2–0,3 мг/сут фолатов, поступающих в организм женщины с пищей, усвоится 0,1–0,15 мг/сут.
Итак, при использовании ВМК с ФК 0,8 мг/сут эффективная доза фолатов, усваиваемых организмом женщины, составит всего 0,60–0,65 мг/сут. Это соответствует установленным в России нормам суточного потребления фолатов беременными [30]. Согласно приведенным выше результатам клинических исследований, данная доза ФК позволяет существенно снижать риск ВПР.
О гипергомоцистеинемии и формировании дефекта нервной трубки
При переработке в организме белков, поступающих из мяса, рыбы или творога, высвобождается аминокислота метионин, которая впоследствии превращается в гомоцистеин. Гомоцистеин является токсичным метаболитом. Гипергомоцистеинемия, возникающая из-за дефицита фолатов, стимулирует процессы системного воспаления и повышенной склонности к тромбообразованию. Гипергомоцистеинемия может не только негативно влиять на развитие эмбриона и здоровье матери, но и приводить к невынашиванию.
С одной стороны, гомоцистеин метаболизируется за счет транс-сульфурации с образованием цистатионина при участии ферментов цистатионин-синтазы (кофактором которой является пиридоксальфосфат, производное витамина В6) и серин-гидроксиметилтрансферазы. С другой стороны, реметилирование гомоцистеина в метионин катализируется метионин-синтазой, кофактором которой является витамин В12, а субстратом – 5-метил-тетрагидрофолат – донатор метильной группы. Дефицит В9, равно как дефицит В12, B6, будет способствовать развитию гипергомоцистеинемии и ВПР [31–35].
Среди генетических причин гипергомоцистеинемии наиболее известен вариант Т полиморфизма гена MTHFR, кодирующего фермент МТГФ-редуктазу [31]. Нуклеотидная замена MTHFR 677C>Т приводит к синтезу термолабильной формы фермента (Ala222Val) со снижением его активности на 40% в случае гетерозиготы (677ТС, встречается у 40–45% представителей европеоидной расы) и на 70% – в случае гомозиготы (677TT, встречается у 10–12% лиц европеоидной расы) [31, 32]. Термолабильный вариант фермента не может эффективно катализировать взаимопревращение 5,10-метилен-ТГФ в 5-МТГФ, который, как уже отмечалось, является донатором метильной группы для метионин-синтазы.
Кофакторами фермента МТГФ-редуктазы являются флавинадениндинуклеотид (производное рибофлавина, витамин В2) и никотинамиддинуклеотид (производное ниацина, витамин РР). Поэтому активность данного фермента также будет снижаться при дефиците витаминов В2 и РР, особенно при наличии у пациента варианта 677Т в гетерозиготной и тем более в гомозиготной форме. Сниженная активность МТГФ-редуктазы будет приводить к более низким уровням 5-МТГФ и повышать уровень гомоцистеина в плазме. На фоне дефицита 5-МТГФ снизится синтез S-аденозилметионина (принципиально необходимого для метилирования ДНК), что наряду с повышенными уровнями гомоцистеина вызовет задержку закрытия нервной трубки и простимулирует развитие ДНТ [13].
Врожденные пороки сердца
Применение высоких доз ФК позволяет предупреждать ВПС (например, дефект межпредсердной перегородки и обструктивные дефекты левого желудочка) в редких случаях (менее 10%) [36, 37]. В целом моноформы ФК, даже в высоких дозах, низкоэффективны для профилактики ВПС [1].
Согласно имеющимся данным, ВМК с ФК более эффективны. На основании результатов венгерского РКИ был сделан интересный вывод: при использовании ВМК с ФК в период периконцепции значительно снижалась частота ВПС (ОР 0,42; 95% ДИ 0,19–0,98) [19, 38]. Аналогичная оценка снижения риска была получена и в когортном исследовании (ОР 0,60; 95% ДИ 0,38–0,96) [20]. В целом результаты обоих исследований позволяют предположить 43%-ное снижение риска ВПС (ОР 0,57; 95% ДИ 0,39–0,85) при использовании ВМК с ФК. Наиболее очевидным было снижение риска дефектов межжелудочковой перегородки и конотрункальных дефектов (так называемый «синий» порок сердца – тетрада Фалло, транспозиция магистральных сосудов, врожденный стеноз трехстворчатого клапана и др.).
Данные другого наблюдательного исследования подтвердили, что использование ВМК с ФК в период периконцепции снижает риск ВПС в среднем на 24% (ОР 0,76; 95% ДИ 0,60–0,97) [39–41]. Наиболее выраженные ассоциации были опять же с дефектами межжелудочковой перегородки и «синих» ВПС. И в венгерском когортном исследовании [20], и в других работах [39–47] частота встречаемости «синих» ВПС у новорожденных снижалась на 50% на фоне применения ВМК с ФК. Снижение всех видов ВПС на фоне приема ВМК с ФК (использовался препарат Элевит Пронаталь) составила 58% [47].
Метаанализы рандомизированных исследований «случай – контроль» (ОР 0,78; 95% ДИ 0,67–0,92) и когортных исследований (ОР 0,61; 95% ДИ 0,40–0,92) подтвердили профилактический эффект использования ВМК с ФК для снижения риска ВПС [46].
В то же время применение в период периконцепции высоких доз ФК (3–6 мг/сут) приводило к снижению риска ВПС всего на 14% (ОР 0,86; 95% ДИ 0,77–0,98) [42]. Аналогичные результаты профилактики ВПС высокими дозами ФК получены в голландском исследовании (ОР 0,82; 95% ДИ 0,68–0,98) [44] и в исследовании, проведенном в Квебеке [45].
Обратите внимание: применение ВМК с ФК существенно снижает тератогенные эффекты фолатных антиметаболитов (антагонистов ФК), которые ингибируют дигидрофолатредуктазу и повышают риск формирования ВПС. Например, в ходе исследования использование на втором-третьем месяце беременности препарата ко-тримоксазол (триметоприм + сульфометоксазол) или сульфаниламидов повышало риск ВПС у потомства [7, 8]. Тем не менее риск ВПС после использования антагонистов ФК без сопутствующего применения ВМК с ФК повышался в 7,7 раза (95% ДИ 2,8–21,7; р < 0,03), а на фоне применения ВМК с ФК – только в 1,5 раза (95% ДИ 0,6–3,8), причем данное повышение не было вполне достоверным (р = 0,065) [7].
Важным нутриционным фактором формирования ВПС является дефицит цинка. Существуют десятки цинк-связывающих белков, регулирующих процессы роста эмбриона (например, Cisteine and glycine-rich protein 2 (CSRP2) – Cys/gly-богатый белок-2, регулирующий развитие эмбриональной сосудистой системы; белок Ub-лигазы MIB1, низкая активность которого ассоциирована с нарушениями строения левого желудочка (OMIM 615092) и остановкой морфогенеза миокарда) [48]. В эксперименте при содержании животных на диете с дефицитом цинка смертность плода была выше на 67%, а частота пороков развития – на 74% (р < 0,001) [49]. Поэтому ВМК, содержащие цинк (помимо ФК и других витаминов), способствуют профилактике не только таких известных цинк-зависимых ВПР, как синдактилия, но и ВПС.
Определенный вклад в патогенез ВПС может вносить и полиморфизм MTHFR 677 C>T, ассоциированный с гипергомоцистеинемией. Метаанализ 29 исследований показал, что наличие варианта MTHFR C677T у матери или плода несколько увеличивает риск ВПС [50]. Важно, что прием ВМК с ФК существенно нивелирует эффекты полиморфизма MTHFR C677T на риск ВПС [51].
Таким образом, имеющиеся данные позволяют утверждать, что применение в период периконцепции препаратов ФК (особенно ВМК с ФК , например, Элевит Пронаталь) поддерживает физиологическое развитие сердца плода во время раннего эмбриогенеза и способствует достаточно эффективной профилактике развития ВПС.
О практическом применении первичной профилактики дефекта нервной трубки и врожденных пороков сердца
Дефицит фолатов и их синергистов (витаминов В6, В12, В2, РР) в период периконцепции является важным фактором риска формирования ДНТ и ВПС. Рассмотрим три основные возможности компенсации дефицита фолатов и их витаминов-синергистов у женщин детородного возраста. Речь идет о диете, богатой витаминами, применении ВМК с ФК и фортификации продуктов питания синтетической ФК.
Потребление диеты, богатой фолатами и другими витаминами
Период подготовки к зачатию – подходящее время, чтобы изменить диетические привычки и улучшить образ жизни будущих родителей, прежде всего будущей матери, сделать все возможное, чтобы ребенок родился здоровым. Крайне важно информировать женщин о необходимости обогащения диеты фолат-содержащими продуктами начиная с периода преконцепции.
В европейских странах суточное потребление фолатов с пищей составляет 0,16–0,25 мг [52]. В России этот показатель еще меньше [53]. Между тем, как уже отмечалось, для эффективной профилактики ВПР уровень потребления фолатов должен составлять не менее 0,7–0,8 мг/сут [25, 26]. При таком положении дел трудно представить четырехкратное повышение потребления фолатов с продуктами питания. Ведь для этого потребуется, например, ежесуточное потребление 500 г сырого шпината, или 900 г отварного шпината, или 900 г сырой брокколи [54] (15 порций брокколи каждый день).
Более того, значительная часть диетарных фолатов утрачивается в процессе приготовления пищи, в частности при термообработке. Повышение потребления фолатов из пищи даже в несколько раз считается достаточно низкоэффективной процедурой с точки зрения повышения содержания фолатов в эритроцитах [55]. И наконец, дефицит фолатов не является единственным витаминным дефицитом, стимулирующим формирование ДНТ и ВПС. Все эти соображения свидетельствуют о необходимости использования специальных ВМК для нутриционной поддержки при беременности.
Применение витаминно-минеральных комплексов с фолиевой кислотой в период периконцепции
Выше были приведены убедительные доказательства того, что для профилактики ВПР всем женщинам детородного возраста следует принимать ВМК с ФК в период периконцепции (за два-три месяца до зачатия и до трех месяцев после него). Такое применение ФК является весьма простым, экономически выгодным и эффективным методом. Тем не менее это часто упускают из виду, в частности из-за недостаточно развитой традиции планирования беременности и применения неадекватных доз фолатов и других витаминов.
Основная проблема заключается в том, что и в промышленно-развитых, и в развивающихся странах не менее 50% беременностей являются незапланированными. Совершенно очевидно, что женщины, не принимающие регулярно ВМК при незапланированной беременности, не могут воспользоваться изложенным методом первичной профилактики ВПР. Напомним, что первая пропущенная менструация соответствует 15-м суткам после зачатия, то есть периоду времени, когда процесс закрытия нервной трубки уже начался.
Можно сформулировать два возможных направления работы общественного здравоохранения в России, которые позволили бы существенно повысить периконцептуальное использование ВМК женщинами детородного возраста:
во-первых, организация широкой просветительской кампании, разъясняющей необходимость применения ВМК с ФК сразу после прекращения приема оральных контрацептивов или использования других методов контрацепции при запланированной беременности [56–59];
во-вторых, формирование службы информационной подготовки и периконцептуальной помощи в рамках первичного медицинского звена [60], аналогичной упоминавшейся ранее Венгерской службе периконцепции [18]. Представленные результаты РКИ и ККИ были получены именно в рамках работы данной службы. При этом следует сделать акцент именно на термине «периконцепция». Дело в том, что обычное дородовое наблюдение начинается на 7–12-й неделе беременности, в то время как наиболее чувствительным, ранимым периодом развития плода считаются 3–8-я недели после зачатия. Без принятия специальных мер в данный период эмбрион оказывается практически незащищенным от воздействия факторов риска ВПР [1].
Периконцептуальная подготовка – наилучший период времени, чтобы полностью отказаться от курения, алкоголя и бесполезных фармацевтических препаратов, используемых, например, для самолечения и представляющих потенциальную опасность для клеток эмбриона, а впоследствии и плода. Очевидно, что этот же период оптимален для начала приема ВМК с ФК [61]. Венгерский опыт показал, что сеть периконцептуальной подготовки в рамках системы здравоохранения весьма экономична и обеспечивает подходящую возможность для нутриционной поддержки при беременности [62].
Не менее важная проблема – доза ФК или других форм фолатов в ВМК. Опираясь на результаты РКИ и ККИ, такая авторитетная организация, как CDC (Centers for Disease Control and Prevention – Центр по контролю и профилактике заболеваний США), еще в 1992 г. сформулировала рекомендацию: «…все женщины детородного возраста, которые способны забеременеть, должны потреблять 0,4 мг ФК/сут с целью снижения риска беременности, отягощенной расщелиной позвоночника или другим ДНТ у плода» [63]. Впоследствии эта рекомендация была скопирована системами здравоохранения многих стран без какого-либо дополнительного анализа данного вопроса [1].
Хотя минимальная доза ФК, приводящая к сколько-нибудь достоверному эффекту, по данным S. Daly и соавт., 0,2 мг/сут [64], те же исследователи установили, что низкий риск рождения ребенка с ДНТ ассоциирован с концентрацией фолатов в эритроцитах свыше 906 нмоль/л [26]. Как говорилось ранее, этот уровень не может быть достигнут даже при использовании ФК 0,4 мг/сут в течение четырех недель. Практически приемлемые концентрации фолатов достигаются только через 8–12 недель использования. Даже при приеме ФК 0,8 мг/сут оптимальные уровни фолатов в эритроцитах достигаются в среднем на четвертой неделе [27, 65, 66].
Говоря о компенсации дефицита фолатов, нельзя не сказать о компенсации дефицита витаминов-синергистов фолатов, при недостаточной обеспеченности которыми биологические эффекты фолатов существенно снижаются. Использование ВМК с ФК 0,8 мг/сут в РКИ [19] и ККИ [20], а также в исследовании R.W. Smithells и соавт. [11, 15] показало высокую эффективность в сокращении числа случаев ДНТ (на 90%) по сравнению с применением высоких доз ФК (4 мг/сут) [17] или более низких (0,4 мг/сут) [22]. Заметим, что «дежурным» аргументом противников повышения эффективности профилактики ДНТ является ссылка на предварительное исследование [17], проведенное на достаточно малой выборке участниц. Кроме того, применение ФК в высоких дозах не сопровождается существенным повышением эффективности в отношении ВПС, в то время как ВМК с ФК 0,8 мг/сут показали достаточно высокую эффективность профилактики ВПС – снижение риска не менее чем на 50% [19–21, 42, 43, 67].
Очевидно, что, хотя фолаты и считаются ключевым фактором в метаболизме гомоцистеина, обеспеченность витаминами В12, В2, РР и В6 не менее важна для эффективной элиминации гомоцистеина. Совокупный эффект от этих четырех витаминов в ВМК с ФК 0,8 мг может объяснить более высокую эффективность профилактики по сравнению с эффектом ФК [66]. Иначе говоря, хотя использование ФК проще и несколько дешевле, применение ВМК с ФК более эффективно для первичной профилактики ДНТ и ВПС.
Фортификация продуктов питания
Обогащение пищевых продуктов ФК может показаться наиболее простым и практичным способом компенсации дефицита фолатов для женщин детородного возраста. Считается, что такой способ компенсации сопоставим с процедурой предотвращения зоба путем добавления йодида калия в поваренную соль. В США и Канаде используется повсеместная принудительная фортификация муки для приготовления пищи (хлеб, выпечка, макароны и т.д.). Следует отметить, что продукты, приготовленные из нефортифицированной муки, дороже фортифицированных и продаются в ограниченном количестве магазинов экологического и натурального питания.
В рамках сценария обязательной фортификации проблема дефицита фолатов решается просто: берется синтетическая ФК и добавляется в наиболее широко употребляемые продукты (хлеб, макароны) – 0,1–0,2 мг ФК на 100 г продукта. С формальной точки зрения, съев два сэндвича и порцию макарон, американская женщина получит физиологически необходимую дозу фолатов (0,3–0,5 мг/сут). Однако фортификационный сценарий полностью пренебрегает тем фактом, что средний американец/американка потребляет около 4000 ккал/сут. Из них 46% приходится именно на углеводы. С учетом этого реальное употребление фолатов при обязательной фортификации может достигать 2–4 мг/сут.
В феврале 1996 г. Министерство здравоохранения и социальных служб США [67] в приказном порядке установило фортификацию продуктов питания из зерновых культур ФК (0,14 мг/100 г муки). В последующие годы отмечалось снижение общей распространенности ДНТ на 26% [68, 69]. В Канаде также была введена обязательная фортификация муки ФК (0,15 мг/100 г белой муки) в сентябре 1998 г., после чего наблюдалось 42%-ное снижение распространенности ДНТ [70] и 6%-ное снижение распространенности ВПС [45]. В настоящее время подобные проекты реализованы в 76 странах [71].
Между тем принудительное фортифицирование не введено в странах Европы, в России, Австралии. Такие европейские страны, как Франция, Финляндия, Великобритания, Швейцария, Германия, более осторожны в этом вопросе, чем США или Канада. Это вполне понятно, ведь позитивные результаты профилактики ДНТ в США (снижение частоты рождения детей с ДНТ от 4–5 случаев на 1000 новорожденных до 1:1000) полностью игнорируют долговременные побочные эффекты таких экспериментов в масштабе населения целой страны. Долговременные последствия обязательной фолиевой фортификации неизвестны и даже не изучались [72–74].
Существенный аргумент длительной задержки введения фортификации – оценка соотношения эффективности и безопасности этого новшества в масштабах страны. Например, проведенное в Великобритании прогнозирование результатов введения обязательной фортификации (на основе данных десятилетнего американского эксперимента) указывает на гигантскую диспропорцию между эффективностью и безопасностью [74]. Действительно, введение обязательной фортификации будет предупреждать от 80 до 160 случаев рождения детей с ДНТ в год. В то же время от 400 000 до 800 000 англичан получат дозу синтетической ФК, превышающую физиологическую норму в два-три раза [74–76].
Кроме того, долговременные исследования показывают, что фортификация может быть крайне неэффективной в отношении основной цели – увеличения уровней фолатов в крови. В крупнейшем клинико-эпидемиологическом исследовании серии NHANES изучали эффективность фортифицированных ФК продуктов питания путем сравнения данных по США в периоды до фортификации (1988–1994) и после нее (1999–2010). Установлено, что в первые годы постфортификационного периода концентрации фолатов показали резкое увеличение, а впоследствии – достоверное снижение (на 17% в сыворотке и на 12% в эритроцитах) [77].
Этот крайне неожиданный феномен (снижение концентраций фолатов в крови при увеличенном потреблении ФК) может возникать вследствие блокирования метаболизма фолатов синтетической ФК – так называемый фолиевый парадокс. Данная проблема подробно проанализирована в ряде работ [78–81].
Передозировка ФК, возникающая в результате употребления фортифицированных продуктов, перегружает и без того замедленные процессы метаболизма фолатов и вызывает физиологический дефицит активных эндогенных фолатов.
Например, дигидрофолат, образующийся из избыточной синтетической ФК, является эффективным ингибитором фермента метилентетрагидрофолатредуктазы – основного фермента фолатного метаболизма. Ингибирование этого фермента приводит к ослаблению интенсивности биотрансформаций в цикле фолатов и, следовательно, к дефициту активных фолатов, которые накапливаются в эритроцитах и необходимы для профилактики ВПР.
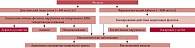
Передозировка ФК (более 1000 мкг/сут), возникающая в результате фортификации продуктов питания, может быть достаточно опасной, стимулировать пролиферативные процессы и способствовать набору избыточной массы тела (см. рисунок) [2].
Фортификация проводится только по фолатам и не включает витамины-синергисты фолатов (В2, РР, В6, В12), цинк и др. Например, витамин В12 является доказанным независимым фактором риска развития ДНТ [82] и предупреждает возникновение пернициозной анемии у беременных [83]. Поэтому фортификация муки ФК не может быть рекомендована вследствие как недостаточной эффективности, так и возможных осложнений, связанных с возрастанием риска онкологических заболеваний на фоне избытка ФК [84].
При подготовке к зачатию пара должна принимать во внимание, что использование мужчинами ФК в высоких дозах значительно увеличивает избыточное метилирование локусов генома спермы, ассоциированное с риском неврологических пороков развития у плода и канцерогенеза у мужчин (CBFA2T3, PTPN6, COL18A1, ALDH2, UBE4B, ERBB2, GABRB3, CNTNAP4), особенно у носителей негативных полиморфизмов MTHFR C677T [85].
Экономические оценки
Стоимость ВМК с ФК значительно ниже, чем пренатальная диагностика ДНТ у плода с последующим плановым прерыванием беременности. Стоимость медицинского лечения живорожденных детей с ДНТ чрезвычайно высока. Например, в странах Евросоюза годовая стоимость лечения детей с расщелиной позвоночника составит не менее 20 000 евро. О семейной трагедии и том, что ребенок будет тяжелым инвалидом, говорить не приходится. В то же время для эффективной периконцептуальной профилактики ДНТ и ВПС может быть достаточно 7–9 упаковок ВМК с ФК, что, например, в тех же странах будет стоить около 80–100 евро. Таким образом, прием ВМК с ФК – не только эффективный способ профилактики ВПР, но и существенно более выгодное вложение средств в здоровье будущего ребенка, чем паллиативные методы, нередко без шансов на полное выздоровление.
Выводы
Интервенционные исследования показали, что прием ВМК с ФК в период периконцепции позволяет предупреждать 93% случаев ДНТ и не менее 50% случаев ВПС. Среди трех возможных способов профилактики ВПС (диета, богатая фолатами и другими витаминами, применение ВМК с ФК (например, Элевит Пронаталь) и фортификация продуктов питания синтетической ФК) именно использование ВМК в период периконцепции в рамках адекватной программы планирования беременности признано наиболее эффективным и безопасным.
O.A. Gromova, V.N. Serov, I.Yu. Torshin, N.V. Kerimkulova, O.A. Limanova
Ivanovo State Medical Academy
Russian Joint Institute for Microelements, UNESCO
Kulakov Research Centre of Obstetrics, Gynaecology and Perinatology
Contact person: Olga Alekseyevna Gromova, unesco.gromova@gmail.com
Vitamin deficiency is associated with a risk of developing congenital malformations, primarily congenital heart diseases (CHD) and neural tube defects (NTD). The results of the large-scale intervention studies demonstrate that folic acid-containing vitamin-mineral complexes (VMC) administered during a preconception period and early pregnancy allows to prevent development of NTD by approx. 90% and significantly reduce rate of CHD (by approx. 50%). Benefits and drawbacks of three routine routes used to administer folic acid/multivitamins are discussed: with meal, as a part of VMC and in so-called fortified flour.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.