Место генно-инженерных биологических и таргетных препаратов в терапии ревматоидного артрита
- Аннотация
- Статья
- Ссылки
- English




Введение
Ревматоидный артрит (РА) характеризуется эрозивным симметричным полиартритом, а также поражением разных органов и систем. Это наиболее часто встречающееся иммуновоспалительное заболевание суставов. Так, распространенность РА среди взрослого населения составляет 0,5–1,0%, соотношение женщин и мужчин – 3–4:1.
Пик заболеваемости приходится на 40–55 лет.
Почти 50% пациентов становятся инвалидами в первые пять лет от начала болезни [1]. Кроме того, у таких больных повышен риск развития сердечно-сосудистых заболеваний, заболеваний органов дыхания, злокачественных новообразований, инфекций, депрессии и/или тревоги [2].
Этиология РА до конца не установлена. Однако известно, что в основе патогенеза лежат дефекты Т- и В-клеточных иммунных реакций, приводящие к гиперпродукции провоспалительных цитокинов (в частности, фактора некроза опухоли (ФНО) альфа, интерлейкинов (ИЛ) 6, 1, 17, 12 и 23) и образованию ревматоидных факторов (РФ), антител к циклическому цитруллинированному пептиду (АЦЦП) и др., индуцирующих воспаление, деструкцию суставов, формирование ревматоидного паннуса и поражение многих висцеральных органов [3–7].
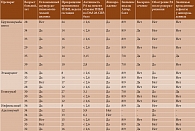
Для верификации диагноза используются классификационные критерии ревматоидного артрита Американской коллегии ревматологов (American College of Rheumatology – ACR) и Европейской антиревматической лиги (Еuropean League Against Rheumatism – EULAR) 2010 г. (табл. 1) [8]. Диагноз считается достоверным при шести баллах и более.
Согласно рекомендациям экспертов EULAR [9–11], пациентам с установленным РА следует незамедлительно назначать базисные противовоспалительные препараты (БПВП). К таковым относятся метотрексат, лефлуномид и др. Метотрексат признан золотым стандартом терапии. В отсутствие противопоказаний он является препаратом первой линии [12, 13].
Однако на фоне применения БПВП более чем у половины пациентов не удается удерживать контроль над заболеванием и развитием жизненно угрожающих осложнений. Это стало основанием для включения в комплексную терапию РА генно-инженерных биологических препаратов (ГИБП), блокирующих активность провоспалительных цитокинов и патологическую активацию Т- и В-лимфоцитов [14].
Необходимо отметить, что ГИБП наряду с БПВП стали основой новой концепции EULAR – «лечение до достижения цели» («treat to target»). Применение данных препаратов позволило достичь не только ремиссии или значимого снижения активности РА, но и длительного безрецидивного течения. Показанием к назначению ГИБП является сохранение средней и высокой активности иммуновоспалительного процесса в течение шести месяцев, несмотря на использование БПВП [10, 11].
В настоящее время в зависимости от механизма действия выделяют несколько групп моноклональных антител (мАТ) [15]:
- ингибиторы ФНО-альфа (инфликсимаб, этанерцепт, адалимумаб, цертолизумаба пэгол, голимумаб);
- ингибиторы рецепторов ИЛ-6 (тоцилизумаб);
- анти-В-клеточные препараты (ритуксимаб);
- блокаторы костимуляции Т-лимфоцитов (абатацепт).
Важно подчеркнуть, что последние годы быстро развивается производство биосимиляров, имеющих структурное сходство с оригинальными ГИБП. Однако, прежде чем данные препараты будут выведены на фармацевтический рынок, их эффективность и безопасность должны быть оценены в многоцентровых контролируемых клинических исследованиях.
Новым препаратом в таргетной терапии РА стал тофацитиниб – блокатор сигнальных путей цитокинов через систему янус-киназ [16].
Ингибиторы фактора некроза опухоли альфа
Как было отмечено ранее, важную роль в патогенезе РА играет ФНО-альфа – плейотропный цитокин, обладающий провоспалительной и иммуномодулирующей активностью [17]. Ингибиторы ФНО-альфа подразделяются на три группы:
- моноклональные АТ (инфликсимаб, адалимумаб, голимумаб);
- пегилированный Fab’-фрагмент мАТ (цертолизумаба пэгол);
- модифицированный ФНО-рецептор (этанерцепт).
Их характеристика представлена в табл. 2 [14].
Среди ГИБП ингибиторы ФНО-альфа являются препаратами первой линии у пациентов с РА. В подавляющем большинстве случаев они назначаются в комбинации с метотрексатом при недостаточной эффективности последнего, реже – в виде монотерапии при наличии противопоказаний к метотрексату [14, 18–20]. В данном случае речь идет о таких препаратах, как адалимумаб, этанерцепт, цертолизумаба пэгол.
Эффективность лечения, как правило, оценивается в течение 12 недель. Эффект терапии доказан результатами многих клинических исследований, в том числе данными собственного регистра больных РА.
Адалимумаб – болезнь-модифицирующий препарат. К его преимуществам следует отнести быстрое развитие (в среднем на четвертый-пятый день) и длительное сохранение (шесть месяцев и более) эффекта у большинства больных, хороший профиль безопасности и удобство введения [21]. Основным показанием к назначению адалимумаба при РА является предшествующая неэффективность или непереносимость БПВП, в частности метотрексата. Установлено, что эффективность адалимумаба значительно выше при небольшой длительности (до трех лет) заболевания и исходно более высоких показателях активности заболевания (Disease Assessment Score 28 – C-reactive protein – DAS 28-CRP). При этом скорость развития и выраженность эффекта не зависят от возраста пациентов, рентгенологической стадии РА и серопозитивности.
Согласно результатам исследования PREMIER, комбинированное применение адалимумаба и метотрексата превосходило монотерапию адалимумабом по ACR, DAS 28.
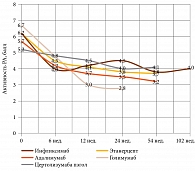
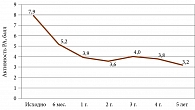
Прямых сравнительных рандомизированных контролируемых клинических исследований эффективности и безопасности ингибиторов ФНО-альфа не проводилось. Данные метаанализов позволяют сделать вывод о сопоставимой их эффективности при добавлении к метотрексату – достижение ответа по ACR 20 и 50 [15]. Этот вывод подтверждается результатами собственных исследований эффективности и безопасности инфликсимаба, адалимумаба, этанерцепта, цертолизумаба пэгола, голимумаба при лечении больных РА в течение 102 недель (рис. 1).
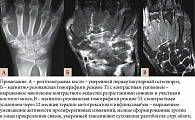
При рентгенологическом кон-троле установлено, что у 42% пациентов, получавших комбинированное лечение метотрексатом и ингибиторами ФНО-альфа, снизился темп эрозивного процесса. В отдельных случаях также отмечалось уменьшение размеров и числа эрозий (рис. 2).
Для ингибиторов ФНО-альфа характерными нежелательными побочными реакциями являются повышение восприимчивости к инфекциям, включая реактивацию туберкулеза, гистоплазмоза и гепатита В, а также развитие демиелинизирующих заболеваний, волчаночноподобного синдрома, злокачественных новообразований, тромбоэмболии и реакций гиперчувствительности [18]. Следует подчеркнуть, что на фоне такой терапии латентный туберкулез нередко протекает атипично (милиарный туберкулез, внелегочные проявления). В связи с этим у пациентов с РА как в начале, так и в ходе терапии ГИБП требуется проведение скрининга – квантиферонового теста, диаскин-теста, теста T-Spot, компьютерной томографии органов грудной клетки. Лечение ингибиторами ФНО-альфа у носителей вируса гепатита С и В должно проводиться с осторожностью и под контролем лабораторных показателей из-за риска обострения заболеваний.
При лечении генно-инженерными биологическими препаратами нередко формируются нейтрализующие антитела, что приводит к снижению эффективности такового. Чаще образуются антитела к ингибиторам ФНО, содержащим как человеческий, так и мышиный белок. Это существенно повышает их иммуногенность. Частота выявления нейтрализующих антител к ингибиторам ФНО колеблется от 7 до 53% в зависимости от принимаемой дозы [22, 23]. Согласно данным нашего регистра, у четырех пациентов, получающих в комбинации с ингибиторами ФНО метотрексат, через шесть месяцев лечения помимо снижения эффективности проводимой терапии выявляются нейтрализующие антитела в титре 125,8 ± 10,7. В то же время анализ литературы свидетельствует, что при лечении РА этанерцептом или адалимумабом нейтрализующие антитела обнаруживают реже – в 5–17% случаев. Установлено, что в случае прерывания лечения ГИБП образование антител может увеличиться в два-три раза [20].
Блокатор костимуляции Т-лимфоцитов
Абатацепт, представляющий собой гибридную белковую молекулу, состоящую из внеклеточного домена СТ4 человека, связанного с модифицированным Fc (СН2- и СН3-областями) фрагментом иммуноглобулина (Ig) G1, обладает меньшей иммуногенностью, чем ингибиторы ФНО-альфа [24]. Препарат подавляет активацию T-лимфоцитов и, следовательно, уменьшает пролиферацию, а также продукцию провоспалительных цитокинов (фактора некроза опухоли альфа, интерлейкина 6 и интерферона гамма). Абатацепт используется для лечения РА как в сочетании с метотрексатом или другими базисными средствами, так и в виде монотерапии. Согласно проведенным международным многоцентровым исследованиям, в частности ATTAIN и ATTEST, по эффективности и безопасности абатацепт сопоставим с ингибиторами ФНО-альфа. При РА его можно использовать как в качестве препарата первой линии, так и в качестве препарата второй линии при неэффективности ингибиторов ФНО-альфа [24]. Кроме того, согласно данным рандомизированных клинических исследований, абатацепт не увеличивает риск туберкулеза и злокачественных новообразований.
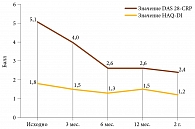
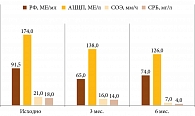
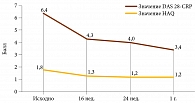
В нашей когорте абатацепт получают 36 больных РА, 30 из которых принимают его в сочетании с метотрексатом, шесть – в виде монотерапии из-за непереносимости БПВП. К 24-й неделе лечения у пациентов достигнута низкая активность заболевания, снизились лабораторные показатели – РФ, АЦЦП, скорость оседания эритроцитов (СОЭ), С-реактивный белок (СРБ). Отмечалось также улучшение качества жизни, согласно значениям опросника оценки здоровья (Health Assessment Questionare Disability Index – HAQ-DI). Положительная динамика сохранялась в течение 12 месяцев наблюдения. В данной группе пациентов серьезных нежелательных явлений не отмечено (рис. 3 и 4).
Ингибиторы рецепторов интерлейкина 6
Достаточно широко в терапии РА используют моноклональные антитела к ИЛ-6, которые обладают целым спектром провоспалительных эффектов. К препаратам этой группы относится тоцилизумаб.
Тоцилизумаб – гуманизированное мАТ (IgG1), действие которого направлено на мембранные и растворимые рецепторы ИЛ-6 [25].
Тоцилизумаб является препаратом выбора у пациентов с выраженным полиартикулярным поражением и значимыми си-стемными проявлениями РА [26, 27]. Однако при назначении такого лечения необходим тщательный мониторинг липидограмм [25].
При РА ингибиторы рецепторов ИЛ-6 применяются внутривенно капельно в дозе 4 или 8 мг/кг в течение как минимум одного часа один раз в четыре недели.
При анализе данных собственного регистра больных РА отмечено, что у получавших тоцилизу-маб в течение 24 недель значимо снизилась активность РА по DAS 28-CRP. Достигнутый на фоне лечения эффект сохранялся на протяжении пяти лет наблюдения (рис. 5).
Анти-В-клеточные препараты
Среди разнообразных нарушений иммунорегуляции, лежащих в основе развития РА, особое место занимает В-клеточное звено иммунитета, участвующее в синтезе широкого спектра органонеспецифических аутоантител. Указанные антитела инициируют иммуновоспалительный процесс в тканях суставов, который и приводит к деструкции суставов [26]. Ритуксимаб относится к препаратам, ингибирующим CD20 В-лимфоциты. Согласно результатам метаанализов, он обладает высокой эффективностью при серопозитивном по РФ и АЦЦП ревматоидном артрите [27], а также при системных проявлениях РА (васкулите, синдроме Шегрена и др.). Получены также данные о том, что достигнутый положительный эффект на фоне продолжающегося лечения РА с применением ритуксимаба сохраняется в течение семи лет (более десяти инфузий) [28].
В нашем регистре больных РА ритуксимаб получают 464. В 21% случаев он назначался в качестве препарата первой линии, в 79% – в качестве препарата следующей линии из-за неэффективности или непереносимости других групп ГИБП. Через 24 недели после первого курса лечения в обеих группах пациентов зафиксировано значимое снижение активности РА и улучшение качества жизни. Тем не менее следует отметить, что клинический эффект на фоне ритуксимаба развивается медленнее, чем на фоне терапии ингибиторами ФНО-альфа и рецепторов ИЛ-6, – через 8–16 недель после внутривенного введения [29]. В 0,6% случаев он продемонстрировал первичную неэффективность, в 2,5% – наблюдалось снижение эффективности лечения после трех-четырех циклов введения. Инфузионные реакции отмечались лишь в 2,7% случаев (рис. 6).
Для профилактики инфузионных реакций перед введением ритуксимаба рекомендуется проводить премедикацию антигистаминными препаратами в сочетании с нестероидными противовоспалительными препаратами (например, парацетамол и дифенгидрамин) или глюкокортикостероидами (250 мг метилпреднизолона внутривенно). Следует отметить, что выбор ритуксимаба сопряжен с низким риском реактивации туберкулеза. Однако частота респираторных инфекций сопоставима с таковой на фоне применения других групп ГИБП. К факторам риска развития инфекционных осложнений при лечении ритуксимабом относятся хронические заболевания легких и снижение уровня IgG в крови.
С осторожностью ритуксимаб следует применять у носителей вируса гепатита В. Наиболее тяжелым, но крайне редким осложнением такой терапии является мультифокальная лейкоэнцефалопатия [28].
Ритуксимаб при РА назначается внутривенно капельно, 1000 мг, в первый и 15-й дни цикла, возможно снижение вводимой дозы до 500 мг, максимальная скорость инфузии – 400 мг/ч.
Блокаторы сигнальных путей клеток-мишеней через систему янус-киназ
Новыми препаратами таргетной терапии РА стали тофацитиниб и барицитиниб, блокирующие сигнальные пути клеток-мишеней через систему янус-киназ [29]. Данные препараты показаны для лечения пациентов с умеренным или тяжелым РА с неадекватным ответом на один или несколько базисных противовоспалительных препаратов, а также при неэффективности ингибиторов ФНО-альфа.
Тофацитиниб назначается в дозе 5 мг два раза в сутки, барицитиниб – в дозе 4 мг один раз в сутки. Они могут быть использованы как в виде монотерапии, так и в виде комбинированной терапии с метотрексатом или другими БПВП.
Высокая эффективность тофацитиниба у разных категорий больных РА была продемонстрирована в рамках контролируемых исследований, в том числе в продленных их фазах [30]. Подтверждением его эффективности при РА являются результаты исследования РЕМАРКА [10]. В таблице 3 представлена динамика показателей активности РА и функционального индекса HAQ на фоне лечения тофацитинибом [30]. Достоверное снижение этих параметров отмечалось уже к 12-й неделе наблюдения. При этом у 49% пациентов удалось достичь низкой активности заболевания. Применение тофацитиниба во второй и третьей линии фармакотерапии в комбинации со стандартными БПВП позволяет достоверно улучшить результаты лечения РА, резистентного к БПВП, а также к различным ГИБП [29].
Нежелательные реакции терапии
Наиболее полные данные о нежелательных явлениях, развивающихся на фоне применения ГИБП, представлены в Консенсусе по биологической терапии EULAR [14]. К самым частым относят инфекции. Это также подтверждают данные наших наблюдений (табл. 4). Сведения о риске развития злокачественных новообразований у больных РА, получавших ГИБП, противоречивы. В то же время большинство авторов отмечают, что в этой популяции риск развития лимфопролиферативных заболеваний достаточно высок [3].
Применение во время беременности
Последнее десятилетие ГИБП используют для лечения больных ревматическими заболеваниями с возрастающей частотой, что повышает важность оценки их безопасности для плода. Несмотря на широту применения, данных о безопасности ГИБП при беременности и лактации недостаточно.
Большинство ГИБП являются моноклональными антителами IgG1, состоят из Fab- и Fc-фрагментов IgG и активно проникают через плаценту посредством Fc-рецепторов трофобласта.
Во всех исследованиях на животных воздействие IgG на плод было оценено как очень низкое в течение органогенеза, то есть на ранних сроках беременности. Плацентарная передача начинается со второго триместра гестации и нарастает до родов, когда материнские и плодные сывороточные уровни препарата становятся эквивалентными или даже повышенными в сыворотке пуповинной крови [31, 32].
С 2011 г. сотрудниками СЗГМУ им. И.И. Мечникова проводится проспективное когортное наблюдение за пациентками с РА, получавшими ГИБП в период гестации (табл. 5). Все перечисленные беременности на фоне генно-инженерной биологической терапии являлись исходами «аварийной контрацепции».
Анализ материнских и младенческих исходов гестации позволяет сделать вывод, что ингибиторы ФНО-альфа являются препаратами низкого риска у беременных. Решение о терапии в период беременности, особенно во второй ее половине, должно основываться на оценке риска для ребенка и ожидаемого конт-роля активности заболевания у матери.
Для того чтобы обеспечить низкий уровень препарата или его отсутствие в пуповинной крови новорожденного, ингибиторы ФНО-альфа должны быть отменены при установлении факта беременности или, если это оправданно течением заболевания у матери, во втором триместре беременности.
Пациентки с активным РА имеют повышенный риск осложненного течения и неблагоприятного исхода беременности, в частности невынашивания, преждевременных родов, низкого веса новорожденного, осложнений в перинатальном или послеродовом периоде.
Беременность у больных РА должна быть планируемой, так как течение основного заболевания, а также исходы беременности в полной мере определяются активностью болезни и проводимой терапией. Вопросы планирования беременности должны обсуждаться с каждой пациенткой фертильного возраста.
Заключение
Применение ГИБП и ингибиторов янус-киназ позволяет существенно повысить эффективность терапии РА. Все ингибиторы ФНО-альфа, а также абатацепт, ритуксимаб, тоцилизумаб и ингибиторы янус-киназ имеют достаточно высокую эффективность при РА, резистентном к метотрексату и другим БПВП (уровень доказательности А).
Перевод больных РА с ингибиторов ФНО-альфа на ритуксимаб, тоцилизумаб или абатацепт в случае непереносимости или наличия побочных эффектов сопровождается повышением эффективности проводимой терапии (уровень доказательности А).
ГИБП в сочетании с метотрексатом более эффективны, чем монотерапия ГИБП (уровень доказательности А).
Рациональное применение ГИБП и таргетных препаратов в комплексном лечении РА позволяет улучшить прогноз и качество жизни пациентов.
Авторы заявляют об отсутствии конфликта интересов и несут полную ответственность за предоставление окончательной версии рукописи в печать. Все авторы принимали участие в разработке концепции статьи и ее написании. Окончательная версия рукописи была одобрена всеми авторами.
V.I. Mazurov, MD, PhD, Prof., I.B. Belyayeva, MD, PhD, Ye.A. Trofimov, PhD, R.R. Samigullina, Ye.S. Melnikov
North-Western State Medical University named after I.I. Mechnikov
Contact person: Vadim I. Mazurov, maz.nwgmu@yandex.ru
This review highlights the main etiological and pathogenetic factors that lead to rheumatoid arthritis.
We discuss the main groups of drugs for the treatment of rheumatoid arthritis, questions of the prescription of basic anti-inflammatory medicines and the usage strategy of genetically engineered biological and targeted therapy in case of insufficient effect from the basic anti-inflammatory medicines. We highlight the strategies of choosing genetically engineered biological and targeted therapy according to the possible complications from this type of treatment.
We conduct a detailed analysis of the main indicators which allow to assess the effectiveness of the therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.