Междисциплинарный подход к клинике внутренних болезней, коморбидность и метаболический синдром. VII Съезд ревматологов России
- Аннотация
- Статья
- Ссылки




Острые и хронические нарушения функции почек как проявление мультиморбидности у пациентов с ревматическими заболеваниями
У пациентов с ревматическими заболеваниями часто имеют место коморбидные патологии, в структуре которых преобладают поражения почек. Нарушение функции почек – один из основных факторов сокращения продолжительности жизни. На это в начале своего выступления обратил внимание заведующий курсом нефрологии и ревматологии кафедры кардиологии и общей терапии Учебно-научного медицинского центра, заведующий отделением нефрологии и ревматологии Центральной клинической больницы с поликлиникой Управления делами Президента РФ, профессор, д.м.н. Андрей Викторович ГОРДЕЕВ. Он отметил, что следует разграничивать мультиморбидность и коморбидность. В отличие от понятия «коморбидность» в основе понятия «мультиморбидность» лежит не заболевание, а конкретный пациент с множеством приобретенных хронических состояний, причем равнозначных. Так, некоторые патологии почек развиваются и в отсутствие ревматических заболеваний. Речь, в частности, идет о диабетической нефропатии, инфекционном пиелонефрите, гипертензивном нефроангиосклерозе, аномалии развития почек. На фоне ревматических заболеваний повышается риск развития коморбидных состояний, таких как мезангиальный, мембранозный гломерулонефрит, АА-амилоидоз, интерстициальный нефрит.
У пациентов с мультиморбидными и коморбидными состояниями иногда возникают токсические нефропатии.
Острые и хронические токсические нефропатии у больных ревматоидным артритом в 19% случаев приводят к развитию хронической болезни почек (ХБП) второй и третьей степени1.
Механизмы поражения почек токсическими веществами могут быть различны. Особое место в развитии острых и хронических токсических нефропатий занимают лекарственные средства.
При острой и хронической боли у пациентов с ревматическими заболеваниями наиболее эффективны нестероидные противовоспалительные препараты (НПВП). Однако они могут вызывать серьезные осложнения, прежде всего со стороны желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы и почек.
В основе фармакологического действия НПВП лежит блокирование активности циклооксигеназы (ЦОГ) – фермента, активно синтезируемого в очагах тканевого повреждения. Известны две изоформы ЦОГ – ЦОГ-1 и ЦОГ-2. Их роль в регуляции синтеза простагландина (Pg) различна. Применение НПВП, ингибирующих ЦОГ-1, способно ухудшать почечный кровоток, что приводит к ишемии и снижению скорости клубочковой фильтрации (СКФ). Лечение ингибиторами ЦОГ-2 ассоциируется с меньшим риском артериальной гипертензии. ЦОГ-2 – протектор солезависимой артериальной гипертензии.
НПВП-индуцированный почечный синдром формально подразделяют на две группы: функциональные Pg-зависимые и Pg-независимые реакции. При Pg-зависимой реакции (ингибирование PgE2 или PgI2) наблюдаются реабсорбция натрия (периферические отеки, повышение уровня артериального давления (АД), сердечная недостаточность), внутрипочечная вазоконстрикция, снижение почечной перфузии или гиперкалиемия, острая почечная недостаточность. Pg-независимая реакция (анатомическая) характеризуется формированием интерстициального нефрита, нефротического синдрома, анальгетической нефропатии, некроза почечных сосочков2.
В отсутствие почечной патологии риск развития НПВП-индуцированных осложнений, таких как повышение уровня АД, гиперкалиемия, задержка жидкости (отеки) и сердечная недостаточность, низкий – 3%.
Длительный (более года) или кратковременный (до 15 дней) прием НПВП в терапевтических дозах с нефрологической точки зрения относительно безопасен. Ингибиторы ЦОГ-2 (селективные НПВП), в частности индометацин и рофекоксиб, не имеют преимуществ перед неселективными НПВП в отношении риска развития почечных осложнений3. Между тем по сравнению с неселективными селективные НПВП обладают большим потенциалом в отношении задержки жидкости, натрия и калия. Клинически значимо это реализуется у пациентов с внутрисосудистой гиповолемией и диетической рестрикцией натрия.
Риск повышения уровня АД на фоне приема коксибов выше, чем при использовании неселективных НПВП. При применении селективных НПВП, в частности целекоксиба, восстановление сниженных СКФ и скорости почечного кровотока происходит достоверно медленнее, чем при использовании неселективных НПВП4.
Международными экспертами разработаны рекомендации по назначению НПВП пациентам с ХБП. При третьей степени (СКФ 30–59 мл/мин/1,73 м2) НПВП, особенно коксибы, не следует назначать в дозах, превышающих рекомендованные. При четвертой (СКФ 15–29 мл/мин/1,73 м2) и пятой (СКФ < 15 мл/мин/1,73 м2 или диализ) степени НПВП противопоказаны. Однако, как показывает клиническая практика, назначение НПВП до и после определения стадии ХБП осуществляется в течение года5.
Необходимо также помнить, что прием НПВП пожилыми пациентами с ХБП ассоциируется с повышением риска развития острой почечной недостаточности на 13–18%, терминальной почечной недостаточности – на 26%6.
Последние десятилетия отмечается неуклонный рост числа пациентов с ХБП, принимающих НПВП одновременно с ингибиторами ангиотензинпревращающего фермента (АПФ), антагонистами рецепторов ангиотензина II (АРА II) и диуретиками. Установлено, что повреждения почек, вызванные оперативными вмешательствами, контрастной нефропатией, острым гломерулонефритом, НПВП-нефропатией, лекарственным взаимодействием (ингибиторы АПФ + АРА II + диуретики + НПВП), обусловливают внутрисосудистую гиперволемию, гиперкалиемию, ацидоз, уремию. Вследствие ренокардиального синдрома третьего типа развивается сердечная, дыхательная и печеночная недостаточность, нередко приводящая к летальному исходу7.
По словам профессора А.В. Гордеева, почечный синергизм лекарственного взаимодействия – это отражение мультиморбидной среды НПВП. Очевидные потенциальные риски НПВП-индуцированной нефропатии – внутрисосудистая гиповолемия и ишемия почки. Фактором риска развития этих состояний на фоне приема НПВП, с одной стороны, является мультиморбидность – наличие у больного цирроза печени, нефротического синдрома, хронической сердечной недостаточности, ХБП, артериальной гипертензии, сахарного диабета, стеноза почечной артерии, с другой – сочетанное использование ингибиторов АПФ, АРА II и петлевых диуретиков.
По мнению экспертов Национального почечного фонда США (National Kidney Foundation – NKF) (2011 г.), разнообразие ингибиторов АПФ/АРА II и петлевых диуретиков сводится к конкретным точкам их приложения и выраженности фармакологического эффекта. Поэтому минимизировать неблагоприятные почечные реакции можно, если выбрать наиболее безопасный НПВП.
На базе отделения нефрологии и ревматологии Центральной клинической больницы с поликлиникой Управления делами Президента РФ проведено исследование эффективности и безопасности НПВП ацеклофенака при сочетанном применении с ингибитором АПФ/АРА II и диуретиками у пациентов пожилого возраста с различной суставной патологией, болевым синдромом и ХБП. Критериями включения в исследование были возраст старше 65 лет, наличие ХБП второй и третьей степени, применение ацеклофенака (Аэртала) 100 мг два раза в день более года, сопутствующий прием ингибитора АПФ или АРА II и петлевого диуретика.
Критериями оценки стали острое повреждение почек за период госпитализации (14–21 день): задержка жидкости, ренокардиальный синдром, расчетная СКФ, гиперкалиемия, а также хроническое (через год) повреждение почек (расчетная СКФ, темп ее снижения, интенсификация антигипертензивной терапии).
Всего в исследование было включено 47 пациентов. 74% из них имели от пяти до девяти сопутствующих заболеваний, в том числе суставов и позвоночника, артериальную гипертензию, ишемическую болезнь сердца, хроническую сердечную недостаточность, сахарный диабет 2 типа, язвенную болезнь.
Для более быстрого купирования болевого синдрома и повышения качества жизни больных к терапии добавили миорелаксант центрального действия толперизона гидрохлорид (Мидокалм®). Результаты исследований, проведенных в течение последних лет, продемонстрировали эффективность и безопасность Мидокалма при острой и хронической боли в спине. Так, комбинированное применение НПВП и Мидокалма способствовало увеличению в 2,5 раза количества больных, у которых боль была купирована или минимально выражена8.
Добавление ацеклофенака к комбинации «ингибитор АПФ/АРА II + диуретик» не сопровождалось клиническими (отеки, ренокардиальный синдром, повышение АД) и лабораторными признаками острого повреждения почек (изменение СКФ) (рисунок).
Кроме того, такая терапия не ассоциировалась с прогрессированием ХБП в течение года наблюдения.
Преимущества препарата Аэртал® обусловлены его фармакологическими свойствами. Согласно результатам сравнительных исследований, ацеклофенак ингибирует оба изофермента ЦОГ с преимущественным угнетением ЦОГ-2. Поэтому по сравнению с другими НПВП он более безопасен в отношении риска развития побочных эффектов9. Терапия ацеклофенаком достоверно реже, чем терапия селективными НПВП (мелоксикамом и рофекоксибом), приводит к задержке жидкости и соответственно не вызывает изменений уровня АД10.
Ацеклофенак характеризуется коротким периодом полувыведения (четыре часа), отсутствием кумуляции после многократного введения и необходимости корректировать дозу у пожилых пациентов и пациентов с ХБП второй и третьей степени. Препарат изолированно и в сочетании с диуретиками не вызывает изменений АД и осмолярности мочи. Положительный профиль безопасности ацеклофенака позволяет назначать его пациентам с мультиморбидной патологией.
Анемия как проявление мультиморбидности у пациентов с ревматическими заболеваниями
Заведующая учебно-методическим отделом с центром информационных технологий Научно-исследовательского института ревматологии им. В.А. Насоновой, д.м.н. Елена Андреевна ГАЛУШКО акцентировала внимание участников симпозиума на проблеме развития анемии у пациентов с мультиморбидностью.
Анемия – состояние, характеризующееся уменьшением количества эритроцитов и/или уровня гемоглобина в единице объема крови. Эксперты Всемирной организации здравоохранения предложили следующие критерии для диагностики анемии: значения гемоглобина у женщин ниже 120 г/л, у мужчин ниже 130 г/л. В зависимости от уровня гемоглобина выделяют три степени анемии: легкую (101–119 г/л), умеренную (81–100 г/л) и тяжелую (80 г/л и менее).
Анемия – одно из наиболее частых гематологических нарушений у пациентов с ревматическими заболеваниями. Частота встречаемости варьируется от 16 до 70%. У больных ревматоидным артритом на первом году заболевания она выявляется в 25% случаев11–13. По данным Института ревматологии, анемия диагностирована у 50% больных ревматоидным артритом, находившихся на стационарном лечении. Тем не менее только у 32% пациентов патология присутствовала в анамнезе14.
Нельзя недооценивать снижение уровня гемоглобина. Показано, что анемия влияет на течение ревматоидного артрита, скорость рентгенологического прогрессирования и служит предиктором неблагоприятного прогноза15.
Данные крупных клинических исследований с участием больных ревматоидным артритом свидетельствуют, что пациенты с анемией, у которых на фоне проведенного лечения зарегистрировано повышение уровня гемоглобина более чем на 1 г/л, имели достоверно лучшие значения индекса оценки состояния здоровья (Health Assessment Questionare – HAQ) по сравнению с пациентами, у которых уровень гемоглобина не изменился16.
Наблюдение за больными после эндопротезирования суставов показало повышение риска развития отсроченных послеоперационных инфекционных осложнений, повторной госпитализации, а также летальности через три месяца и год после операции17.
Анемия также ассоциируется с дополнительными экономическими вложениями. Так, совокупное годовое медицинское обслуживание пациентов с анемией в 1,78 раза превышает таковое пациентов без анемии. Соответственно разница в затратах на годовое амбулаторное обслуживание составляет 7000 долларов18.
В практике ревматологов встречаются анемии различного генеза. Самые частые причины снижения гемоглобина – анемия хронических заболеваний, которую можно считать системным проявлением ревматических заболеваний, и железодефицитная анемия. Редко встречаются В12-дефицитная и фолиеводефицитная анемии. Распространенность таких грозных состояний, как апластический синдром и гемолитическая анемия, – менее 0,5% случаев. Однако 25% пациентов с хроническими заболеваниями диагноз «анемия» поставить не удается, поскольку присутствует комплексная патология19.
Вклад анемии в мультиморбидность без детализации конкретного заболевания был проанализирован на основании данных регистра CORRONA о 10 397 больных ревматоидным артритом. Длительность наблюдения составила шесть лет. Прогностически значимыми для развития анемии у пациентов признаны число воспаленных и припухших суставов, наличие внесуставных проявлений, уровень С-реактивного белка, ревматоидного фактора и креатинина20.
Одним из наиболее распространенных сопутствующих заболеваний у пациентов с ревматическими патологиями также считается ХБП. Профессиональное сообщество нефрологов определяет ХБП по наличию любых (структурных и/или функциональных) маркеров повреждения почек, персистирующих более трех месяцев независимо от нозологического диагноза. СКФ – основной маркер функционального повреждения почек. При этом одно и то же значение сывороточного креатинина отражает разные уровни СКФ в зависимости от пола, возраста и этнической принадлежности пациента.
К факторам риска развития ХБП относят наличие в семейном анамнезе ХБП, мужской пол, пожилой возраст. Развитию ХБП способствуют сахарный диабет, артериальная гипертензия, системные инфекции, аутоиммунные заболевания и др. Анемия признана фактором прогрессирования ХБП у пациентов с ревматическими заболеваниями21.
Частота ХБП при ревматических заболеваниях в два раза выше, чем в популяции. К сожалению, большинство пациентов не знают о наличии у них заболеваний почек.
Кроме того, доказан так называемый ренокардиальный континуум: снижение функции почек ускоряет изменение сердечно-сосудистой системы, и наоборот. В основе этого процесса лежит хроническая гипоксия. К факторам риска ее развития относят состояние кровоснабжения, концентрацию гемоглобина, различие в насыщении кислородом артериальной и венозной крови. Компенсаторными механизмами при этом служат перераспределение кровотока (увеличение сердечного выброса), усиление эритропоэза и изменение рН плазмы. Аномалия одного из трех факторов приводит к компенсаторным изменениям двух других. Подтверждение тому – результаты исследования с участием 59 772 пациентов с сердечно-сосудистой недостаточностью22. Анемия диагностирована в 42% случаев.
В ходе шестилетнего динамического наблюдения установлено, что анемия увеличивает риск инфаркта миокарда и смерти от ишемической болезни сердца в 1,64 раза, инсульта – в 1,81 раза и смерти от любых причин – в 1,88 раза. Анемия сопряжена с усилением сердечного выброса, увеличением частоты сердечных сокращений, что приводит к гипертрофии левого желудочка. Кроме того, гипоксия тканей, которая неизбежно сопровождает анемию, способствует активации митогенных и фиброгенных эффектов, факторов ангиогенеза и апоптоза.
Таким образом, на фоне длительной хронической анемии возникает гипоксия тканей, повышается риск развития ХБП и сердечно-сосудистой недостаточности.
Докладчик отметила влияние патогенетической терапии ревматических заболеваний на развитие анемии. Этиологическим фактором анемии может стать прием НПВП15.
Препараты группы НПВП демонстрируют практически сопоставимую терапевтическую эффективность при использовании в адекватных дозах. Однако НПВП различаются спектром потенциальных нежелательных явлений. Прием НПВП способен вызвать повреждение слизистой оболочки верхних отделов ЖКТ с развитием эрозий, язв и их осложнений, дестабилизацию АД, прогрессирование сердечной недостаточности, повысить риск сердечно-сосудистых событий, а также негативно повлиять на функцию почек и гематологические показатели.
Согласно рекомендациям национальных сообществ нефрологов, пациентам с ХБП третьей степени не следует назначать НПВП, особенно коксибы, в дозах, превышающих рекомендованные23.
Е.А. Галушко отметила, что при выборе НПВП необходимо учитывать не только противовоспалительный и обезболивающий эффекты, но и особенности больного, такие как сниженный уровень гемоглобина, риск развития сердечно-сосудистых заболеваний и ХБП.
Для пациентов с анемией наиболее предпочтительным из класса НПВП является ацеклофенак. Его клиническая эффективность у пациентов с ревматическими болезнями доказана в ряде исследований. Преимущества препарата в отношении переносимости и относительно низкого риска развития серьезных осложнений обусловлены ингибированием как ЦОГ-1, так и ЦОГ-2, с преимущественным угнетением последней изоформы.
Действующее вещество не накапливается, поэтому не требуется коррекции дозы у пожилых пациентов, что особенно важно в ревматологической практике.
Данные сравнительных исследований безопасности продемонстрировали, что ацеклофенак обладает лучшим профилем безопасности и переносимости, чем другие неселективные НПВП, в отношении нежелательных желудочно-кишечных и других реакций.
Результаты анализа безопасности 16 групп НПВП, используемых в реальной клинической практике, подтвердили минимальный риск развития желудочно-кишечных кровотечений и диспепсии на фоне приема ацеклофенака24.
Подводя итог, Е.А. Галушко подчеркнула, что высокая частота возникновения анемии у пациентов с ревматическими заболеваниями обусловливает актуальность разработки способов ее коррекции. Поскольку общеизвестные критерии диагностики анемии основаны на данных, полученных у лиц, не страдавших хроническими заболеваниями, ее подтверждением у больных ХБП второй – четвертой степени должен стать уровень гемоглобина менее 110 г/л. Для лиц пожилого возраста – менее 130 г/л у женщин и 140 г/л у мужчин. При выборе терапии необходимо учитывать, что превышение целевого уровня гемоглобина, так же как и недостаточная коррекция анемии, приводят к неблагоприятным последствиям.
Междисциплинарный подход к оценке статуса и лечению хронической тофусной подагры у пожилых пациентов
Подагра – системное заболевание, обусловленное воспалением в местах отложения кристаллов моноурата натрия у лиц с гиперурикемией, вызванной внешнесредовыми и/или генетическими факторами. Последние десятилетия наблюдается значительное увеличение показателей распространенности и заболеваемости подагрой – с 1997 по 2012 г. на 63,9 и 29,6% соответственно25. По словам д.м.н., профессора кафедры гематологии и гериатрии Первого Московского государственного медицинского университета им. И.М. Сеченова Владимира Викторовича ЦУРКО, основными факторами риска развития заболевания являются избыточная масса тела и ожирение, артериальная гипертензия, употребление высокопуриновых продуктов питания, алкоголя, применение препаратов, вызывающих гиперурикемию (диуретики, аспирин и др.), генетическая предрасположенность.
Патология диагностируется при выявлении кристаллов моноурата натрия в синовиальной жидкости или тофусах. Дебютом подагры считают первый приступ острого подагрического артрита. Ему предшествуют артериальная гипертензия, ишемическая болезнь сердца, хроническая сердечная недостаточность, мочекаменная болезнь, сахарный диабет. Установлено, что мочекаменная болезнь у лиц молодого возраста предопределяет развитие ХБП и подагры. Нарушение функции почек влечет за собой изменение деятельности сердечно-сосудистой системы.
Таким образом, подагра развивается у мультиморбидного пациента. Заболевание существенно влияет на прогрессирование ХБП и сердечно-сосудистых патологий, что в конечном итоге определяет общий прогноз.
Согласно рекомендациям Европейской антиревматической лиги (European League Against Rheumatism – EULAR), каждый пациент с подагрой должен быть проинформирован о ее патофизиологии, сопутствующих заболеваниях, эффективных методах терапии, принципах лечения острого приступа подагрического артрита и лечения, направленного на растворение кристаллов моноурата натрия. Последнее достигается поддержанием уровня мочевой кислоты в сыворотке крови ниже целевого26.
Пациент должен знать о возможном появлении тофусной формы подагры, которая особенно быстро развивается в пожилом возрасте. Тофусы представляют собой депозиты кристаллов моноурата натрия разных размеров. Они образуются практически во всех органах и тканях.
Каждый пациент с подагрой должен:
- отказаться от алкоголя (особенно пива и крепких алкогольных напитков) и подслащенных напитков;
- избегать переедания, избыточного потребления мяса и морепродуктов;
- употреблять нежирные молочные продукты;
- регулярно выполнять физические упражнения.
Пациенту с подагрой следует систематически проходить обследование с целью выявления сопутствующих заболеваний и факторов сердечно-сосудистого риска, включая почечную недостаточность, ишемическую болезнь сердца, сердечную недостаточность, инсульт, атеросклероз периферических артерий, ожирение, гиперлипидемию, сахарный диабет, артериальную гипертензию.
Лечение острого приступа подагрического артрита должно начинаться как можно раньше. При выборе препарата учитываются время от начала приступа, число и тип суставов, вовлеченных в процесс, противопоказания к применению препарата.
При остром приступе подагрического артрита могут быть назначены колхицин (в течение 12 часов от его начала) в ударной дозе 1 мг с последующим приемом через час 0,5 мг в первый день и/или НПВП (при необходимости одновременно с ингибиторами протонной помпы), пероральные глюкокортикостероиды (ГКС) (эквивалентно 30–35 мг/сут преднизолона в течение трех – пяти дней) или для внутрисуставного введения после аспирации синовиальной жидкости. Колхицин и НПВП не следует назначать пациентам с нарушенной функцией почек тяжелой степени. Колхицин также не должен использоваться одновременно с сильными ингибиторами Р-гликопротеина и/или изофермента СУР34А, такими как циклоспорин или кларитромицин.
Докладчик отметил, что при подагре длительные курсы ГКС недопустимы, поскольку существует риск увеличения количества интрадермальных тофусов, развития артериальной гипертензии, гипергликемии, индукции сахарного диабета 2 типа. Короткие курсы эффективны при олигоартрите и полиартрите, однако наличие показаний к ГКС отражает степень тяжести болезни. ГКС отличает быстрое наступление эффекта, аналогичное действию НПВП.
В случае частых острых приступов подагрического артрита и при наличии противопоказаний к применению колхицина, НПВП, ГКС можно использовать блокаторы интерлейкина (ИЛ) 1. Противопоказанием для их назначения является текущая инфекция.
После купирования обострения блокаторами ИЛ-1 уратснижающая терапия должна быть скорректирована для достижения целевой концентрации мочевой кислоты в сыворотке крови.
Уратснижающая терапия показана всем пациентам при повторяющихся приступах (два и более в год), тофусах, уратной артропатии и/или мочекаменной болезни. Ее рекомендуется начинать после постановки диагноза на фоне поддерживающей дозы НПВП у пациентов моложе 40 лет либо с высоким и очень высоким уровнем мочевой кислоты в сыворотке крови – более 8 мг/дл (480 мкмоль/л) и/или с сопутствующими заболеваниями (почечная недостаточность, артериальная гипертензия, ишемическая болезнь сердца, сердечная недостаточность). У больных, получающих уратснижающие препараты, уровень мочевой кислоты в сыворотке крови должен быть менее 6 мг/дл (360 мкмоль/л). Более низкий уровень – менее 5 мг/дл (300 мкмоль/л) необходимо поддерживать у пациентов с тяжелой формой подагры (тофусы, хроническая артропапия, частые приступы), чтобы ускорить растворение кристаллов моноурата натрия вплоть до полного исчезновения и излечения подагры. Поддерживать уровень мочевой кислоты 3 мг/дл в долгосрочной перспективе не рекомендуется.
Важным аспектом терапии считается профилактика острого приступа подагрического артрита. Профилактические мероприятия показаны в течение первых шести месяцев после назначения уратснижающих препаратов. Рекомендуемое лечение – колхицин 0,5–1,0 мг/сут. У пациентов с нарушенной функцией почек дозу необходимо снизить.
При нарушении функции почек или лечении статинами следует принимать во внимание потенциальную нейротоксичность и/или мышечную токсичность колхицина в профилактических дозах. Рекомендуется избегать одновременного использования колхицина с сильными ингибиторами Р-гликопротеина и/или изофермента CYP3A4. При наличии противопоказаний к применению колхицина рассматривается вопрос о назначении НПВП в низких дозах.
У пациентов пожилого возраста нередко развивается тяжелый подагрический артрит, характеризующийся системными проявлениями на фоне мультиморбидности, включая быстрое прогрессирование артериальной гипертензии, раннее формирование тофусов в органах и тканях, быструю деструкцию костей. Как правило, у таких больных диагностируются заболевания почек со значительным снижением функции, хроническая сердечная недостаточность, неконтролируемый сахарный диабет. В ряде случаев у пациентов формируются фенотип раннего сосудистого старения, непереносимость НПВП, колхицина, ГКС, аллопуринола.
На сегодняшний день одним из эффективных и безопасных препаратов из группы НПВП признан ацеклофенак (Аэртал®). Он воздействует на все звенья воспалительного процесса: подавляет активность плазминогена и выход гистамина из базофилов и тучных клеток, блокирует активность фактора некроза опухоли (ФНО) aльфа, ИЛ-6, урокиназы и активирует антивоспалительные медиаторы.
Ацеклофенак снижает деградацию хрящевой ткани, подавляя синтез эластазы и коллагеназы, тормозит образование токсических продуктов распада кислорода за счет уменьшения активности миелопероксидазы, а также эндопероксидов и тромбоксана А2, взаимодействует с глюкокортикоидными рецепторами.
В ряде клинических исследований эффективность Аэртала превосходила таковую других НПВП (диклофенак, напроксен, ибупрофен) при заболеваниях костно-суставной системы. Доказано биологическое действие ацеклофенака на метаболизм гиалинового хряща. Препарат селективно ингибирует ЦОГ-2 в культуре хондроцитов, стимулирует синтез протеогликанов, гликозаминогликанов и гиалуроновой кислоты, подавляет ИЛ-1-стимулированную продукцию металлопротеиназ, индуцирует активность антагониста рецептора ИЛ-1, синтезируемого синовиоцитами и хондроцитами. Продемонстрирована также эффективность ацеклофенака в подавлении экспрессии ИЛ-1-бета, ИЛ-6 и ФНО-альфа хондроцитами и синовиоцитами остеоартрозного хряща и торможении апоптоза хондроцитов27.
Аэртал® характеризуется более высоким профилем переносимости, чем стандартные НПВП (диклофенак, пироксикам, напроксен, индометацин). Это повышает приверженность пациентов лечению28.
Профессор В.В. Цурко представил участникам симпозиума результаты собственного исследования эффективности Аэртала у пациентов с тофусной подагрой. Выбрано 75 больных тофусной подагрой с дебютом заболевания в 57,2 ± 4,7 года. ХБП диагностирована в возрасте 58,7 ± 5,8 года, хроническая сердечная недостаточность – в 62,6 ± 7,0, артериальная гипертензия – в 48,2 ± 9,1 года. Средний уровень мочевой кислоты в сыворотке крови составил 478,2 ± 120,0 мкмоль/л, холестерина – 5,9 ± 1,1 ммоль/л. В ходе работы оценивали динамику клинических параметров.
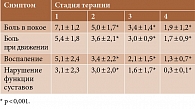
Применение ацеклофенака в течение двух месяцев обусловило значительное снижение клинических симптомов подагры: боли в покое и при движении, воспаления и нарушения функций пораженных суставов. Положительная динамика наметилась уже после первой недели терапии (таблица).
Таким образом, лечение подагры предусматривает комплекс немедикаментозных и медикаментозных методов, направленных на снижение уровня мочевой кислоты в сыворотке крови и профилактику поражения различных органов и систем. Адекватная медикаментозная тактика с учетом сопутствующих заболеваний позволяет сохранить трудоспособность пациентов и улучшить прогноз заболевания.
Заключение
Ревматические заболевания – основная причина нетрудоспособности и снижения качества жизни пациентов. У пациентов с ревматическими заболеваниями отмечается высокая распространенность коморбидных патологий, что повышает требования к эффективности и безопасности проводимой терапии.
В ряде клинических исследований продемонстрирована высокая эффективность ацеклофенака (Аэртала) по сравнению с другими НПВП (диклофенак, напроксен, ибупрофен) при патологиях костно-суставной системы.
Препарат селективно ингибирует ЦОГ-2 в культуре хондроцитов, стимулирует синтез протеогликанов, гликозаминогликанов и гиалуроновой кислоты, подавляет ИЛ-1-стимулированную продукцию металлопротеиназ, индуцирует активность антагониста рецептора ИЛ-1, синтезируемого синовиоцитами и хондроцитами. Ацеклофенак также подавляет экспрессию ИЛ-1-бета, ИЛ-6 и ФНО-альфа хондроцитами и синовиоцитами остеоартрозного хряща и тормозит апоптоз хондроцитов.
Данные сравнительных исследований свидетельствуют, что ацеклофенак (Аэртал®) характеризуется лучшим профилем безопасности и переносимости, чем другие неселективные НПВП, в отношении желудочно-кишечных и других нежелательных реакций.
Кроме того, ацеклофенак обладает коротким периодом полувыведения (четыре часа). Его характеризует отсутствие кумуляции после многократного введения и необходимости корректировать дозу у пожилых лиц и пациентов с ХБП второй и третьей степени.
Препарат изолированно и в сочетании с диуретиками не вызывает изменений АД и осмолярности мочи.
Эффективность и положительный профиль безопасности ацеклофенака позволяют назначать его пациентам с мультиморбидностью.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.