М-холиноблокаторы в лечении гиперактивного мочевого пузыря
- Аннотация
- Статья
- Ссылки
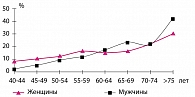




Как правило, распространенность ГАМП недооценивается, так как подавляющее большинство исследований включает пациентов только с одним из симптомов императивного недержания мочи (14, 16). С возрастом значительно увеличивается число больных с различными расстройствами функции нижних мочевых путей, особенно это относится к ГАМП (рисунок 1) (8, 20).
Некоторые современные данные отображают тот факт, что роль М2-рецепторов может быть более резко выраженной с возрастом. Полагают, что указанные рецепторы могут играть важную роль в возрастзависимом повышении ответа a1-адренорецепторов в тканях мочевого пузыря, а облегчение контрактильного ответа, связанного с a1А-адренорецепторами может быть причиной гиперактивности мочевого пузыря у пожилых людей.
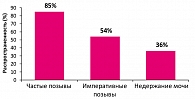
Для клинического проявления гиперактивности детрузора характерны безотлагательные (императивные) позывы на мочеиспускание, поллакиурия, ноктурия и неудержание мочи при позыве (или ургентное недержание мочи) (рисунок 2). Возникая в любой период времени и зачастую в неудобном месте, указанные симптомы приносят значительное беспокойство больным.
Недержание мочи, или даже неудержание мочи, может быть также следствием нестабильности уретры, обусловленной колебаниями максимального уретрального давления более 15 см водн. ст. Неудержание мочи не является обязательным условием для постановки диагноза ГАМП, так как у половины пациентов отмечаются только сенсорные симптомы: частые дневные и ночные мочеиспускания, императивные позывы. Этот вариант симптомокомплекса получил название сухого ГАМП.
Следует иметь в виду, что наличие детрузорной гиперактивности, выявленной при уродинамическом исследовании, не означает, что больной должен страдать недержанием мочи. К примеру, бессимптомная детрузорная гиперактивность регистрируется у 42% здоровых женщин старше 65 лет (20). В случае присоединения императивного недержания мочи принято говорить о влажном, или мокром, ГАМП (14, 20, 22).
С возрастом исследователи отмечают значительное увеличение доли мокрого ГАМП. В возрасте от 65 до 74 лет ургентное недержание мочи отмечают до 20% женщин. По данным шведского исследования, у пожилых людей 75 лет и старше ургентным недержанием мочи страдают 42% женщин и 35% мужчин (Stenzelius K., Mattiasson A., Hallberg I.R., Westergren A.,2004).
С возрастом частота симптомов возрастает до 30% у лиц старше 65 лет и до 40% после 70 лет. В европейских странах почти 22 млн человек страдают этим тяжелым заболеванием, но лишь 27% из них получают лечение, что свидетельствует о недостаточной оценке проблемы как пациентами, так и медицинскими работниками (20).
Распространенность учащенного мочеиспускания и императивных позывов одинакова среди мужчин и женщин, а императивное недержание мочи чаще встречается у женщин старших возрастных групп. Этиология и патогенез императивных расстройств мочеиспускания, обусловленных гиперактивностью мочевого пузыря, до настоящего времени не ясны. Существует несколько теорий развития данного заболевания. Нервная дегенерация является общим признаком развития нестабильного мочевого пузыря. Возможно, детрузорная гиперактивность обусловлена возрастными изменениями не только в мочевых путях, но и в центральной нервной системе (ЦНС). Очевидно, что различные изменения как в периферической нервной системе, так и в ЦНС могут быть причиной гиперактивности детрузора.
Существует мнение, что этиология ГАМП связана с качественными изменениями самой гладкой мускулатуры. В норме в мочевом пузыре гладкомышечные клетки находятся в состоянии спонтанной активности. Во время наполнения, тем не менее, их активность не синхронизирована, потому что каждая из клеток связана лишь с несколькими из своих соседей, и нет особой взаимосвязи между отдельными пучками. Синхронная активация, наблюдаемая во время мочеиспускания, невозможна без густой плотной иннервации, и большое количество гладкомышечных клеток должно быть активировано с помощью нервных импульсов.
Elbadawi A. и соавт. (1997) использовали электронную микроскопию для исследования образцов тканей, полученных в результате биопсии у пожилых пациентов с дисфункцией мочеиспускания, подтвержденной уродинамическим исследованием. Исследователи описали так называемую размыкательную модель, или разобщенный паттерн, выявленный у пациентов с ГАМП. Особенность данной модели состояла в умеренном расширении межклеточных пространств, наличии редких промежуточных связей между клетками, но отличалась избыточным содержанием особых характерных выступающих сочленений и тесным прилеганием клеточных опор. Было высказано предположение, что выступающие сочленения и клеточные границы-опоры осуществляют непосредственное связывание между отдельными гладкомышечными клетками и что они вовлечены в генерацию мышечного сокращения у пациентов с ГАМП. У 5 пациентов, участвующих исходно в этом исследовании со стабильностью детрузора, со временем развилось состояние гиперактивности детрузора. Ультраструктурные исследования новых материалов биопсии показали наличие так называемой размыкательной модели в отличие от предыдущей биопсии, проведенной у тех же пациентов (Elbadawi A., Hailemariam S., Yalla S.V., Resnick N.M., 1997).
У пожилых мужчин развитие симптомов ГАМП часто сопровождается инфравезикальной обструкцией (ИВО) в результате заболеваний простаты. Около 60% мужчин с ИВО отмечают симптомы ГАМП. Точного объяснения взаимосвязи между инфравезикальной обструкцией и ГАМП пока нет. По данным Wein A.J. (2003), ГАМП встречается у 52-80% мужчин с ИВО вследствие гиперплазии простаты, а у 38% мужчин он продолжает иметь место и после хирургического устранения обструкции.
Существующие исследования указывают на ряд неврологических изменений (Steers W.D., De Groat W.C., 1988, Sibley G.N.,1987) и увеличение a-адренергической активности в результате ишемии детрузора (Perlberg S., Caine M., 1982) вследствие его гипертрофии на фоне ИВО. При гипертрофии детрузора, возникшей в результате обструкции, увеличиваются метаболические потребности в сочетании с уменьшением притока крови, что приводит к аноксии и гибели нейронов (Levin R.H. et al., 1999). Более того, имеются данные о том, что плотность холинергических нервных волокон в детрузоре на 60% меньше в группе больных с ДГПЖ и ИВО по сравнению с группой больных того же возраста и отсутствием ИВО. Авторы считают, что значительное снижение плотности нервных волокон в ответ на ИВО вследствие ДГПЖ может привести к нарушению нейромышечного контроля мочевого пузыря.
Большая роль в развитии императивных нарушений мочеиспускания у женщин в климактерии уделяется дефициту эстрогенов и связанным с ним атрофическим изменениям в уротелии, дистрофическим изменениям в мышце мочевого пузыря (2-4). Возможно, это является причиной сенсорных симптомов, сопровождающих сухой ГАМП (поллакиурии, ноктурии, императивного позыва к мочеиспусканию). 70% женщин связывают их появление с наступлением климактерия (16), что рассматривают как один из основных факторов риска развития ГАМП у женщин. По данным Versi E. с соавт. (1995), частота стрессового недержания мочи у женщин снижается с увеличением длительности постменопаузы, и одновременно с увеличением возраста нарастает частота детрузорной гиперактивности. Некоторые исследования показали, что отдельные нейроны в спинном мозге содержат эстрогеновые рецепторы и являются мишенями для эстрогенов. Присутствие эстрогеновых рецепторов в нейронах центральных областей головного мозга повышает возможность того, что эндокринные возрастные изменения могут действовать через супраспинальный контроль мочеиспускания.
Развитие гипоксии детрузора и, как следствие ее, метаболических нарушений в его структуре нарушает его сократительную способность. Это позволяет предположить, что ишемия и гипоксия могут лежать в основе повреждения интрамуральных нейронов и приводить к изменению функции гладкой мускулатуры мочевого пузыря у пациентов с гиперактивностью детрузора. Ишемия приводит к апоптозу гладкомышечных клеток, кроме того, к нарушению нервной проводимости. Нервная ткань более чувствительна к ишемии, чем гладкая мускулатура, и некоторые из этих повреждений практически необратимы. Нервная дегенерация является общим признаком развития нестабильного мочевого пузыря. При гипертрофии детрузора, возникшей в результате обструкции, увеличиваются метаболические потребности в сочетании с уменьшением притока крови, что приводит к аноксии и гибели нейронов (Levin R.H., 1999).
Abrams P. (1985) считает, что гиперактивность детрузора у больных с ДГПЖ является не результатом ИВО, а следствием возрастных изменений в стенке мочевого пузыря. Несмотря на противоречивость данных, следует признать, что как возраст, так и ИВО могут привести к постсинаптической денервации мочевого пузыря. Это обстоятельство еще раз подчеркивает важную роль нервной системы в контроле за накопительной функцией мочевого пузыря.
Роль наследственных факторов изучается, а ряд современных исследований свидетельствует о возможности генетических изменений при наличии ГАМП.
Согласно классической физиологической концепции, функция мочевого пузыря обеспечивается антагонистическим взаимодействием симпатического и парасимпатического отделов нервной системы (14). Симпатический отдел ответственен за расслабление детрузора и сокращение уретрального сфинктера, парасимпатический – за сокращение детрузора и расслабление сфинктера. Активация той или иной системы определяет состояние нижних мочевых путей. Рецепторы в области окончаний симпатических нервов мочевого пузыря и мочеиспускательного канала в зависимости от физиологических эффектов, возникающих при их стимуляции, разделяются на a- и b-адренорецепторы.
Стимуляция a-адренорецепторов приводит к сокращению гладкомышечных волокон указанных отделов мочевых путей и увеличению уретрального сопротивления. Стимуляция b-адренорецепторов вызывает торможение активности детрузора и его физиологическую адаптацию к поступающему объему мочи. Адренергические ингибиторные нейроны в основном отходят от n. hypogastricus, в то время как возбуждающие нервы, как полагают, отходят от тазового нерва и относятся к холинергическому типу. Рецепторы системы парасимпатических (холинергических) нервов равномерно расположены в мышечной стенке мочевого пузыря и почти не встречаются в области его основания и уретры. Стимуляция этих рецепторов вызывает сокращение детрузора.
В настоящее время известно пять молекулярных подтипов мускариновых М-холинорецепторов, и ткани могут содержать разное количество разных подтипов (таблица 1).
Например, гладкая мускулатура мочевого пузыря человека содержит смешанные популяции М2 и М3 подтипов. Особого внимания заслуживают М3-рецепторы, посредством которых осуществляется передача импульса на сокращение детрузора, и М2-рецепторов, воздействие на которые препятствует расслаблению его гладкой мускулатуры. Основное количество мускариновых рецепторов в мочевом пузыре приходится на М2 подтип (80%). Известно, что М2-рецепторы составляют 4/5 всех мускариновых рецепторов мочевого пузыря.
Стимуляция М3-рецепторов ацетилхолином приводит к гидролизу фосфоинозитола и в конечном счете к аккумуляции внутриклеточного кальция и сокращению гладкой мускулатуры. Активация М2-рецепторов ведет к ингибированию аденилатциклазы и возвращает симпатически-ассоциированное расслабление гладкой мускулатуры мочевого пузыря. В конечном результате это обусловливает наиболее эффективное полное опорожнение мочевого пузыря.
Некоторые современные данные отображают тот факт, что роль М2 мускариновых рецепторов может быть более резко выраженной с возрастом. Преобладание активности холинорецепторов парасимпатического отдела вегетативной нервной системы характеризует уменьшение физиологической емкости мочевого пузыря в фазу наполнения, быстрое нарастание при этом детрузорного давления, а также повышение внутрипузырного и детрузорного давлений в фазу опорожнения с увеличением максимальной объемной скорости потока мочи и сокращением времени мочеиспускания.
О превалировании активности b-адренергических элементов симпатического звена ориентируются по увеличению физиологической емкости мочевого пузыря и снижению при этом максимальных значений внутрипузырного и детрузорного давлений. Наличие некоординированных сокращений детрузора расценивается как свидетельство повышенной активности мускарино-чувствительных холинергических нейроструктур, равномерно расположенных во всем теле детрузора. Известно, что функция нижних мочевых путей осуществляется благодаря тесному антагонистическому взаимодействию адрено- и холинорецепторов симпатического и парасимпатического отделов вегетативной нервной системы. Поэтому понятно, что при поражении или функциональной недостаточности хотя бы одного вида рецепторов вся эта система гармоничного равновесия непременно нарушается ввиду превалирования действия противоположной группы рецепторов (11).
Согласно современным представлениям в нижнем мочевом тракте обнаружено много рецепторов для различных трансмиттеров, включающих такие, как оксид азота и субстанция Р. Различные ко-трансмиттеры и нейромодуляторы имеют стимулирующий эффект на гладкую мускулатуру мочевого пузыря, такие как АТФ, субстанция Р, GABA, NPY и различные другие. Возможное наличие различных нейротрансмиттеров и модуляторов в нижнем мочевом тракте много дискутировалось в течение последних двадцати лет.
Связь гиперактивности детрузора с повышением активности парасимпатического отдела вегетативной нервной системы доказана и объясняет лечебный эффект применения блокаторов периферических мускариночувствительных холинорецепторов. На их фоне влияние парасимпатического звена ослабевает, а симпатического возрастает, тем самым снижается внутрипузырное давление, снижаются или подавляются некоординированные сокращения детрузора, увеличивается эффективная емкость мочевого пузыря и улучшается адаптационная функция детрузора (5, 6).
Фармакотерапия – один из самых распространенных методов лечения ГАМП. Согласно рекомендациям это метод выбора. Затем следует поведенческая терапия, физиотерапия и остальные виды лечения. Медикаментозный метод вызывает интерес прежде всего благодаря своей доступности, возможности длительного применения и индивидуального подбора дозы и режима лечения. Патогенетическая фармакотерапия должна быть ориентирована на возможные механизмы развития ГАМП – миогенный и нейрогенный. Фармакологическое лечение гиперактивности мочевого пузыря представляет собой сложную проблему. Вопросом симптоматического лечения этого состояния занимались и отечественные, и зарубежные ученые.
Для лечения ГАМП наиболее часто применяют антихолинергические препараты, впервые предложенные Langworthy O. (1936), нарушающие проведение импульсов в парасимпатических ганглиях или препятствующие взаимодействию парасимпатического медиатора ацетилхолина с М-холинорецепторами (Diokno А. Lapides J., 1972). Большинство из этих препаратов вызывают неизбежные нежелательные явления, что обусловливает необходимость поддержания врачом баланса между преимуществами и недостатками препаратов. Антимускариновое действие обычно вызывает сухость во рту, запоры, трудности аккомодации, сонливость. Препараты нельзя назначать пациентам с нарушенным оттоком мочи из мочевого пузыря (обструктивной уропатией), обструкцией кишечника, язвенным колитом, глаукомой или миастенией. В нормальном мочевом пузыре сцепление между пучками мышечных волокон гарантирует, что возникновение диффузной активности не приведет к повышению давления в мочевом пузыре. В нестабильном (гиперактивном) мочевом пузыре эти связи усилены, что приводит к возникновению волны диффузного возбуждения, императивному позыву и неконтролируемым сокращениям детрузора. Эта гипотеза объясняет эффективность антимускариновых препаратов при ургентном недержании мочи. Если часть ганглиев возбуждается непосредственно сенсорными нервами, то подавление этого эффекта должно привести к устранению как императивных позывов, так и нестабильных сокращений.
Один из самых известных антихолинергических препаратов – атропин, который имеет выраженное системное действие. И хотя некоторые пилотные исследования показали достоверную эффективность и безопасность его внутрипузырного применения при гиперрефлексии, самый распространенный метод введения в настоящее время – это электрофорез. Отсутствие селективности действия препарата, вне всякого сомнения, становится негативным фактором, так как определяет низкую эффективность его терапевтических доз в отношении симптомов гиперактивности. Препарат в настоящий момент представляет больше исторический интерес, и его практически не применяют в лечении гиперактивности детрузора.
Fowler С. (1996) предложил препарат антихолинергического действия – оксибутинин. Ранее оксибутинин, обладающий антимускариновым, антиспазматическим и местным анестезирующим действием, назывался «золотым стандартом» в лечении ГАМП, хотя не все из вышеперечисленных свойств наблюдаются при использовании терапевтических доз. Необходим индивидуальный подбор дозы, и пациентов предупреждают, что это займет определенный период времени, в течение которого необходимо посещать врача. Оптимальной считают дозу, которая дает нужный эффект при минимальных побочных эффектах. Дозы для приема внутрь составляют от 2,5 мг однократно до 5 мг 4 раза в сутки. Стандартная стартовая доза для взрослых составляет 5 мг 2-3 раза в сутки. У пожилых рациональная стартовая доза составляет 2,5 мг 2-3 раза в сутки. Дозу необходимо поддерживать в течение 7 суток до корректировки (либо уменьшения, либо увеличения, в зависимости от выраженности клинического эффекта). С целью уменьшения выраженности побочных эффектов дозу оксибутинина снижают. Malone-Lee J. и соавт. (1992) предложили уменьшить дозу до 5 мг в сутки, Moore K. и соавт. (1990) – до 3 мг, а Bemelmans B.L.H. и соавт. (2002) – до 2,5 мг 3 раза в день.
При невозможности перорального применения оксибутинина Brendler C. и соавт. (1989), Maderbacher H., Jilg G. и соавт. (1985), Weese D.и соавт. (1993) предложили метод введения 5 мг оксибутинина непосредственно в мочевой пузырь, растворенного в 30 мл стерильной воды, 2-3 раза в день. Enzelsberger и соавт. (1995) предложили 20 мг оксибутинина, растворенные в 40 мл воды, вводить в мочевой пузырь в течение 10 дней. При двойном слепом рандоминизированном исследовании не было отмечено побочных реакций, и рекомендовано применение внутрипузырного введения оксибутинина при выраженных побочных эффектах при пероральном введении.
Альтернативный метод применения оксибутинина в ректальных свечах предложили Wiskind A.K. и соавт. (1994). Был отмечен хороший терапевтический эффект, однако такие побочные эффекты, как сухость во рту и торможение перистальтики, сохранялись.
Толтеродин – первый препарат, целенаправленно разработанный для лечения пациентов с гиперактивностью мочевого пузыря, проявляющейся учащенными императивными позывами на мочеиспускание, императивным недержанием мочи. Данный препарат разработан с использованием комплексного подхода к достижению селективности в отношении мочевого пузыря. Толтеродин – конкурентный антагонист М-холинергических рецепторов, являющийся смешанным антагонистом М2- и М3-холинорецепторов, локализующихся в мочевом пузыре и слюнных железах, блокирует кальциевые каналы и, таким образом, обладает двойным действием на мочевой пузырь. Препарат отличается селективностью в отношении мочевого пузыря. Безопасность, эффективность и переносимость толтеродина оценивали в четырех рандоминизированных двойных-слепых, параллельных, мультицентровых, 12-недельных исследованиях у больных с гиперактивностью мочевого пузыря (Appell R.A., и соавт., 2001, Drutz H., Appell R.A., 1997, Nilvebrant L. и соавт., 1997). Исследования показали хорошую переносимость препарата, высокую эффективность и выраженную селективность в отношении холинергических мускариновых рецепторов мочевого пузыря по сравнению с рецепторами слюнных желез в отличие от оксибутинина (таблица 2).
Селективность толтеродина обеспечивает возможность длительного применения препарата. Более того, по результатам исследований частота побочных эффектов при длительном (до 2 лет) применении толтеродина не увеличивается, а наоборот снижается. Так, частота возникновения сухости во рту через год применения препарата составляет 36%, а уже ко второму году приема препарата снижается до 19% (16). Частота мочеиспусканий через 12 месяцев использования снизилась на 22% а частота эпизодов ургентного недержания мочи – на 58%.
В зарубежной литературе есть данные о применении толтеродина у детей по 1 мг 2 раза в сутки, что привело к снижению частоты мочеиспусканий, уменьшению эпизодов недержания мочи, серьезные побочные явления отсутствовали. В исследовании M. Munding, H. Wessells (2001) установлено, что толтеродин уменьшает количество эпизодов ургентного недержания. У 73% принимавших препарат детей наблюдалось улучшение или излечение. По данным P. Abrams и соавт. (2001), толтеродин незначительно снижает максимальную скорость потока мочи, не снижает детрузорное давление при максимальной скорости потока мочи и не вызывает клинически значимого увеличения остаточной мочи у мужчин с ГАМП и ИВО вследствие ДГПЖ. Данный эффект толтеродина несомненно очень важен у столь многочисленной категории урологических больных.
Еще одна форма толтеродина – капсулы пролонгированного действия по 4 мг, используемые 1 раз в сутки (за исключением пациентов с выраженными нарушениями функции печени и почек – в этом случае применяют капсулы по 2 мг в сутки).
Еще один M-холиноблокатор, который используют для лечения ГАМП, – троспия хлорид. Это парасимпатолитик с периферическим, атропиноподобным действием, а также ганглионарным миотропным действием, подобным папаверину. Троспия хлорид является конкурентным антагонистом ацетилхолина на рецепторах постсинаптических мембран, блокирует мускариновое действие ацетилхолина и ингибирует ответ, вызванный постганглионарной парасимпатической активацией блуждающего нерва. Имеет высокое сродство к М1- и М3-холинорецепторам. Троспия хлорид снижает тонус гладкой мускулатуры мочевого пузыря, оказывает расслабляющее действие на гладкую мускулатуру детрузора мочевого пузыря как за счет антихолинергического эффекта, так и вследствие прямого миотропного антиспастического влияния.
Троспия хлорид – четвертичное аммониевое соединение с антимускариновым типом действия. Хотя биодоступность троспия хлорида уступает таковой третичных аминов, это не оказывает влияния на его эффективность, а только определяет необходимость его применения в более высоких дозах. Дозу препарата подбирают индивидуально от 30 до 90 мг в сутки, в зависимости от клинической картины и тяжести заболевания. Концентрация троспия хлорида при однократном приеме составляет от 20 до 60 мг, пропорциональна принятой дозе. Троспия хлорид является более гидрофильным относительно третичных соединений оксибутинина и толтеродина, хуже проникает через гематоэнцефалический барьер и реже вызывает побочные эффекты со стороны ЦНС.
При исследовании 75 женщин с недержанием мочи при ГАМП (Fuertes и соавт., 2000) было продемонстрировано не только эффективное воздействие троспия хлорида (суточная доза 40 мг, продолжительность лечения 8 недель) на клинические проявления гиперактивности детрузора и уродинамические показатели, но и улучшение показателей качества жизни пациенток на 35%. При проведении сравнения эффективности троспия хлорида и толтеродина в двойном плацебо-контролируемом исследовании у пациентов с императивными нарушениями мочеиспускания оба препарата показали снижение частоты мочеиспусканий – на 23% и 28% для толтеродина и троспия хлорида соответственно, увеличение объема мочеиспускания – на 39% и 33% соответственно. Число эпизодов недержания мочи снизилось на 67% и 73% для толтеродина и троспия хлорида соответственно. Выраженность побочных эффектов была одинаковой в обеих подгруппах (12). По данным Д.Ю. Пушкаря и соавт. (2004), на фоне приема троспия хлорида в течение 12 недель отмечено снижение числа мочеиспусканий за сутки на 20%, снижение среднего числа эпизодов недержания мочи до 40%, увеличение объема мочеиспускания на 18,8%.
Новым препаратом, с успехом применяемым для лечения ГАМП, является M-холиноблокатор солифенацин (Везикар). Солифенацин – активное вещество препарата Везикар – является специфическим конкурентным ингибитором мускариновых рецепторов (М-холинорецепторов), преимущественно М3 подтипа. При этом солифенацин имеет низкое или не имеет сродства к другим рецепторам и ионным каналам. Максимальный эффект после приема Везикара в дозах 5 или 10 мг может быть выявлен через 4 недели, что было показано в двойных слепых рандомизированных клинических испытаниях у мужчин и женщин с синдромом ГАМП. Клинический эффект от приема Везикара наблюдается уже в течение первой недели лечения, а эффективность сохраняется в течение по крайней мере 12 месяцев. Нет необходимости корректировать дозу Везикара в зависимости от возраста пациента. Площадь под кривой концентрация/время (AUC) сходна у пожилых (65-80 лет) и у здоровых молодых людей (менее 55 лет). Время достижения максимальной концентрации несколько ниже, а период полувыведения увеличивается на 20% у пожилых пациентов. Эти различия не являются клинически значимыми.
Начальная доза Везикара составляет 5 мг 1 раз в сутки, при необходимости доза может быть увеличена до 10 мг 1 раз в сутки. Наиболее частый побочный эффект Везикара – сухость во рту (отмечается у 11% пациентов при суточной дозе 5 мг и у 4%, получавших плацебо). Для солифенацина характерна низкая частота типичных для антимускариновых средств побочных эффектов (например, сухость во рту), что обусловлено более высокой селективностью препарата к тканям мочевого пузыря. Везикар более селективен в отношении мочевого пузыря, чем толтеродин и оксибутинин (таблица 3).
Эффективность препарата в дозах 5 мг 10 мг изучена и доказана во многих клинических исследованиях у больных с синдромом ГАМП: отмечено статистически значимое снижение числа мочеиспусканий (включая ночные), эпизодов ургентности, увеличение среднего объема мочеиспусканий. Эффект проявлялся уже в течение 1-й недели лечения, достигая максимальной величины через 4 недели. Эффективность препарата сохраняется в течение длительного применения (по меньшей мере 12 месяцев).
По данным проведенных исследований, на фоне применения солифенацина в дозе 5 мг и 10 мг в сутки число эпизодов ургентности снижается на 49% и 55% соответственно, число эпизодов ургентного недержания мочи – на 58% и 62% соответственно, частота мочеиспусканий (на 5 мг в сутки) – на 19%, а объем выделенной мочи увеличивается на 21% (VesicareÒ SmPC, Astellas, 2005).
С учетом высокой селективности и хорошей переносимости препарата отмечается его высокая эффективность при длительном (до 60 недель) применении. По результатам исследования, проведенного Haab F. и соавт. (2005), после 60-недельного использования солифенацина в дозировке 5 мг в сутки 62,7% пациентов стали удерживать мочу, у 43,1% снизились эпизоды ургентности, у 41,8% снизилась частота мочеиспусканий, 23,1% больных избавились от ноктурии. 81% больных, участвующих в исследовании, завершили его до конца, и лишь 4,8% выбыли из-за нежелательных побочных явлений.
Из незарегистрированных пока в России М-холиноблокаторов необходимо отметить дарифенацин и фезотеродин. Дарифенацин является антагонистом М3-рецепторов, но характеризуется более избирательным действием по сравнению с другими антихолинергическими препаратами. Пока известно, что в дозе 2,5 мг он не влияет на слюнные железы. При лечении дарифенацином уродинамические параметры улучшаются лишь в случае применения дозы 10 мг в день (24).
Фезотеродин – новый антагонист мускариновых рецепторов, также применяемый в качестве лекарственного препарата для лечения синдрома ГАМП. Эффективность фезотеродина была показана в слепых рандомизированных контролируемых исследованиях в сравнении с плацебо и с толтеродином. Европейское медицинское агенство (European Medicines Agency) в апреле 2007 года одобрило использование фезотеродина в клинической практике. Рекомендуемая стартовая доза фезотеродина составляет 4 мг в сутки однократно (доза может быть увеличена до 8 мг однократно). Бионакопление активного метаболита фезотеродина составляет 52%. После однократно или многократно принятой per os дозы фезотеродина от 4 мг до 28 мг плазменные концентрации активного метаболита пропорциональны принятой дозе. Приблизительно после 5 часов достигаются максимальные плазменные уровни препарата. Накопления препарата в крови не происходит даже при многократно принятой дозе фезотеродина. Результаты клинических 12-недельных исследований фезотеродина в отношении основных симптомов ГАМП представлены в таблице 4.
Помимо указанной выше селективности в отношении мочевого пузыря, важным свойством Везикара и других селективных М-холинолитиков является удобство приема – 1 раз в сутки, что наряду с высокой безопасностью существенно повышает приверженность к лечению со стороны пациентов. Появление подобных современных лекарственных средств дает надежду на более эффективное, безопасное и удобное лечение больных ГАМП в будущем. Результаты проведенных исследований демонстрируют более значимые показатели эффективности М-холиноблокаторов в комплексе с a-адреноблокаторами у различных групп пациентов, а также препаратами для заместительной гормонотерапии у женщин в климактерии.
Вероятно, в будущем необходимо отходить от принципов монотерапии симптомов комплекса императивных нарушений мочеиспускания, так как реальный путь повышения эффективности лечения этого сложного заболевания мы видим в проведении комплексной терапии, включающей не только различные виды фармакотерапии, но и физические, психологические и другие методы лечения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.