Нарушение механизмов циркадианной регуляции при возрастзависимых нейродегенеративных заболеваниях
- Аннотация
- Статья
- Ссылки
- English
Введение
Циркадианные ритмы – это физиологические и поведенческие циклы, которые обеспечиваются собственным внутренним осциллятором и сохраняются в отсутствие внешнего «регулятора» [1]. Способность поддерживать 24-часовой суточный ритм является фундаментальной характеристикой циркадианной системы, позволяющей организму адаптироваться к условиям окружающей среды.
Работа циркадианной системы обеспечивается четырьмя основными компонентами:
- светочувствительными нейронами сетчатки и ретиногипоталамическим трактом, по которому световые сигналы поступают из окружающей среды;
- внутренним циркадианным осциллятором, генерирующим ритмы и осуществляющим их синхронизацию с окружающей средой;
- сигнальными путями, по которым информация передается от центрального регулятора к периферическим генераторам ритмов;
- периферическими генераторами ритмов – часовыми генами и белками в периферических клетках [1].
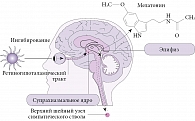
Внутренний циркадианный осциллятор, или генератор циркадианных ритмов, – это парные супрахиазменные ядра (СХЯ) в передних отделах гипоталамуса. Каждое СХЯ состоит из 8000–10 000 нейронов, автономно генерирующих циркадианные ритмы, что подтверждено в экспериментах с изоляцией отдельных клеток in vitro. Внутренний период осцилляций СХЯ примерно (но не точно) составляет 24 часа, поэтому он синхронизируется с 24-часовым циклом вращения Земли. Этот процесс, известный как фоторегулировка (англ. photo-entrainment), обеспечивается через световой незрительный путь от сетчатки к СХЯ – ретиногипоталамический тракт [2]. Он начинается от небольшой группы светочувствительных ганглионарных клеток сетчатки, содержащих светочувствительный белок меланопсин. Светочувствительные ганглионарные клетки деполяризуются под воздействием света в спектре 480–460 нм (голубой свет), после чего по эфферентным волокнам сигнал передается в СХЯ. Однако в экспериментах с мышами, нокаутными по гену, синтезирующему меланопсин, и мышами с врожденным отсутствием светочувствительных клеток показано, что палочки и колбочки также способны частично брать на себя подобную функцию, участвуя в фоторегулировке [2].
Результаты, полученные в ряде экспериментов с использованием генетических, молекулярных и биохимических методов у многоклеточных организмов, продемонстрировали, что практически все клетки генерируют собственный суточный ритм. Кроме того, такие физиологические процессы, как колебания температуры тела, секреция гормонов, употребление пищи, тоже участвуют в синхронизации циркадианной системы [3]. СХЯ в свою очередь рассматривается как главный синхронизатор, объединяющий множество периферических подсетей, генерирующих ритмы, в одну систему.
Выделяют два основных пути передачи информации от СХЯ подчиненным структурам:
- через нейронные сети, с помощью которых нейроны СХЯ проецируются на ряд отделов головного мозга;
- химический – с помощью синтеза сигнальных молекул [4].
СХЯ образует нейронные связи с некоторыми отделами головного мозга, прежде всего с ядрами ствола, отвечающими за регуляцию процессов сна и бодрствования [5]. Например, СХЯ имеет прямые связи с суправентрикулярной областью, преоптической областью, дорсомедиальными отделами гипоталамуса, дугообразным и паравентрикулярным ядрами [4].
Известно, что трансплантация СХЯ восстанавливает нарушенные циркадианные ритмы у животных, у которых собственные СХЯ были удалены. В экспериментах с изоляцией трансплантата СХЯ полимерной капсулой для ограничения роста нервных отростков и образования связей с другими отделами мозга доказано существование не только нервных, но и гуморальных путей регуляции циркадианных ритмов [5]. В СХЯ синтезируются сигнальные молекулы, такие как аргинин-вазопрессин, вазоактивный интестинальный пептид, кардиотропин-подобный цитокин, прокинетин 2, эпидермальный фактор роста и трансформирующий фактор роста альфа [1, 4].
Одним из основных гормонов-регуляторов циркадианных ритмов является мелатонин, секретируемый во многих тканях организма, включая сетчатку и желудочно-кишечный тракт. Однако основным источником секреции мелатонина остается шишковидная железа [6]. Мелатонин – одно из звеньев процесса фоторегулировки: в течение дня свет, попадающий на сетчатку, активирует ее светочувствительные ганглионарные клетки, информация от которых передается через ретиногипоталамический тракт и далее – в СХЯ. Сигналы из СХЯ передаются в паравентрикулярное ядро гипоталамуса, после чего в составе интермедиолатерального столба спинного мозга доходят до верхнего шейного ганглия. Симпатические постганглионарные норадренергические волокна иннервируют мелатонин-секретирующие клетки в эпифизе. Норадреналин действует на постсинаптические бета-1- и альфа-1-адренорецепторы в клетках эпифиза, которые запускают синтез мелатонина. Возбуждение СХЯ под действием света вызывает не активацию, а торможение нейронов верхнего шейного узла. Соответственно они уменьшают выброс норадреналина, а эпифиз в ответ на это снижает секрецию мелатонина [7]. Таким образом, в ночное время секреция мелатонина усиливается, днем уменьшается (рис. 1) [6].
У новорожденных шишковидная железа не функционирует в полной мере, и необходимый мелатонин они получают с материнским молоком. Не случайно его замена искусственными смесями способна приводить к нарушениям циркадианных ритмов и сна [6]. На протяжении первых лет жизни пиковые концентрации мелатонина увеличиваются и достигают максимума к двум – четырем годам, после чего начинают снижаться и к моменту полового созревания выходят на плато. По окончании полового созревания секреция мелатонина продолжает ежегодно уменьшаться [8]. С возрастом уменьшается как базальная, так и пиковая концентрация мелатонина: сглаживается суточная кривая секреции мелатонина и снижается пик ночной секреции.
В ряде экспериментов на животных продемонстрированы антиоксидантные свойства мелатонина. Его добавление в рацион крыс приводило к увеличению продолжительности жизни и уровня тестостерона у самцов [9, 10].
В исследовании V.A. Lesnikov и W. Pierpaoli трансплантация шишковидной железы от молодых к более старым особям увеличивала продолжительность их жизни на 42% и, наоборот, трансплантация эпифиза более старых особей молодым снижала ее на 29% [11].
На фоне применения мелатонина у стареющих мышей увеличивалась не только продолжительность жизни, но и объем тимуса, надпочечников и яичек, что сопровождалось повышением уровня тестостерона и гормонов щитовидной железы в крови [12].
В ряде исследований мелатонин продемонстрировал нейропротективный эффект при нейродегенеративных заболеваниях. Мелатонин уменьшает токсичность бета-амилоида и предотвращает гибель клеток в экспериментальных моделях болезни Альцгеймера (БА), а также уменьшает окислительный стресс в моделях болезни Паркинсона (БП) [6].
С учетом антиоксидантных свойств мелатонина возрастзависимое снижение секреции может быть обусловлено активацией процессов окислительного стресса и повышением риска заболеваемости нейродегенеративными заболеваниями. Таким образом, снижение синтеза мелатонина, вероятно, играет не последнюю роль в процессах старения [9].
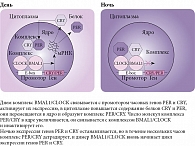
Молекулярная основа регуляции циркадианных ритмов обеспечивается часовыми генами, работа которых осуществляется по принципу петель положительной и отрицательной обратной связи. Накопившиеся в течение дня белки BMAL1 и CLOCK образуют комплекс BMAL1/CLOCK. Димер BMAL1/CLOCK активирует транскрипцию генов PER (PER1, PER2, PER3) и CRY (CRY1, CRY2). Синтезированные белки PER и CRY также формируют димер PER/CRY, действующий по принципу отрицательной обратной связи. PER/CRY перемещается в ядро клетки и ингибирует активность комплекса BMAL1/CLOCK, что приводит к снижению экспрессии белков PER и CRY. В течение ночи комплекс PER/CRY разрушается, и цикл начинается заново (рис. 2). Весь цикл занимает около 24 часов [2]. Другой часовой ген, участвующий в регуляции данного цикла, – REV-ERB-альфа. Комплекс BMAL1/CLOCK активирует транскрипцию гена, что приводит к накоплению в клетке белка REV-ERB-альфа. Белок REV-ERB-альфа в свою очередь ингибирует транскрипцию гена BMAL1 и предположительно генов CLOCK и CRY1.
Нарушения циркадианных ритмов при болезни Паркинсона
Нарушения циркадианных ритмов, а также нарушения сна и бодрствования встречаются у 75% пациентов с БП [2] и наряду с другими немоторными симптомами опережают моторные проявления болезни на несколько лет.
Известный феномен БП – моторные флуктуации, которые обычно возникают на поздних стадиях заболевания на фоне терапии леводопой. Однако моторные проявления БП могут зависеть не только от приема дофаминергических препаратов, но и от времени суток. Как известно, при использовании одинаковых доз леводопы пациенты чувствуют себя в послеобеденное и вечернее время хуже, чем в первой половине дня.
U. Bonuccelli и соавт. оценивали гипокинезию, тремор и ходьбу, а также метаболизм леводопы в трех группах пациентов с БП: с недавно диагностированной БП, на развернутой стадии БП без моторных флуктуаций и с БП и моторными флуктуациями [13]. Все пациенты получали стандартные дозы леводопы/карбидопы в 08.00, 12.00 и 16.00 часов. Результаты показали, что у больных на ранних стадиях заболевания отсутствуют выраженные колебания моторных симптомов в течение дня. На развернутых стадиях отмечается прогрессирующее ухудшение симптомов во второй половине дня без существенных изменений фармакокинетики леводопы. У больных наблюдается спонтанное улучшение симптомов утром после сна без дополнительного приема препаратов, которое длится от нескольких минут до нескольких часов и напоминает феномен при дофа-зависимой дистонии.
Суточные флуктуации характерны и для немоторных симптомов, в том числе вегетативных, поведенческих, когнитивных [13, 14]. Нарушения суточного профиля артериального давления и вариабельности сердечного ритма возникают на ранних стадиях заболевания. Согласно результатам ряда исследований, у пациентов с БП изменяется циркадианный паттерн колебаний артериального давления с увеличением его вариабельности, ортостатической гипотензией и гипотензией после еды и недостаточным снижением в ночное время. При холтеровском мониторировании определяется снижение вегетативной регуляции в течение дня с уменьшением вариабельности сердечного ритма и исчезновением утреннего пика [15].
При проведении актиграфии у пациентов с БП наблюдается изменение профиля суточной физической активности за счет снижения физиологических пиков активности и периодов повышенной активности в ночное время по сравнению с группой контроля [16].
Показано также, что дезорганизация циркадианного паттерна физической активности усиливается с течением заболевания [13]. Известно, что у больных БП уплощена кривая суточной секреции мелатонина и смещен ночной пик выделения мелатонина. С течением заболевания эти проявления усиливаются [2]. У пациентов с БП имеют место и другие нарушения функций, контроль над которыми осуществляет СХЯ. В отличие от пациентов с БА и пациентов контрольной группы у пациентов с БП помимо базальной гиперкортизолемии уплощена кривая суточной экскреции кортизола [17]. При БП нарушается суточный профиль образования и выделения мочи. В норме максимальная экскреция мочи отмечается в послеобеденное время, минимальная – в полночь [18]. Однако у пациентов с БП в дневное время выделяется только 43% объема мочи, пик экскреции в ночное время повышается до 57%. Наконец, у пациентов с БП отмечаются флуктуации цветовосприятия в течение суток с ухудшением цветочувствительности сетчатки в послеобеденное время [19].
Нарушения циркадианных ритмов при болезни Альцгеймера
Нарушения циркадианных ритмов, нарушения сна и бодрствования, такие как фрагментация сна, повышенная дневная сонливость и императивные засыпания, встречаются не менее чем у 30–50% пациентов с БА [20].
Клинически пациенты с БА демонстрируют десинхроноз в виде изменения ритмов суточной физической активности, сумеречный синдром – дезориентацию и психомоторное возбуждение в вечернее и ночное время (англ. sundowning) и флуктуации суточной температуры тела.
У пациентов с БА нарушен паттерн секреции мелатонина, снижено содержание рецепторов к мелатонину в СХЯ [21]. Более того, по данным патоморфологических исследований, уровень мелатонина в ликворе обратно коррелирует со степенью распространенности нейродегенеративного процесса при БА [22].
Патофизиология нарушений циркадианных ритмов при нейродегенеративных заболеваниях
Старение ассоциировано с изменениями в работе циркадианной системы. Уменьшение амплитуды и периода продолжительности циркадианных ритмов, увеличение вариабельности колебаний физиологических процессов в течение одного суточного цикла способствуют дестабилизации ежедневных ритмичных колебаний. Нарушение циркадианных ритмов приводит к изменению суточного профиля физической активности, нарушению ночного сна, повышенной дневной сонливости и изменению других физиологических функций.
Неудовлетворенность сном отмечают 25% мужчин и 50% женщин пожилого возраста. Более 25% пациентов регулярно или часто принимают снотворные средства. Нарушение сна – один из факторов, позволяющих оценить качество жизни пожилых. От бессонницы страдает примерно 30% людей старше 55 лет. У лиц старше 75 лет частота инсомнии удваивается по сравнению с лицами среднего возраста [23].
Нарушения циркадианных ритмов характерны для нейродегенеративных заболеваний, включая БП и БА. Среди механизмов, лежащих в основе их развития, выделяют:
- первичное повреждение структур циркадианной системы из-за нейродегенеративного процесса;
- побочные эффекты дофаминергической терапии;
- дезорганизацию профиля суточной активности вследствие моторных и немоторных флуктуаций.
Патологоанатомическим субстратом болезни служат нейроны, погибшие вследствие избыточного накопления в них белка альфа-синуклеина и формирования невритов и телец Леви. Измененные нейроны еще на ранних стадиях болезни обнаруживаются в ядрах ствола головного мозга, гипоталамусе и переднем мозге – центрах регуляции процессов сна и бодрствования и циркадианных ритмов [24]. В частности, поражаются норадренергические нейроны голубоватого пятна, холинергические нейроны педункулопонтинного ядра и переднего мозга, серотонинергические нейроны ядер шва, дофаминергические нейроны передних отделов покрышки среднего мозга и орексинергические нейроны латерального гипоталамуса [24]. Для нейродегенеративного процесса при БП характерны определенный паттерн и темп распространения с избирательным повреждением конкретных зон. Вовлечение ядер гипоталамуса типично для БП, в большей степени повреждаются туберомамиллярные ядра, а также латеральные и задние отделы. При этом тельца и невриты Леви длительное время не выявляются в СХЯ [25]. В действительности профиль секреции мелатонина у пациентов с БП de novo не отличается от контрольной группы, но по мере прогрессирования заболевания снижается его амплитуда [26].
N. Aziz и соавт. показали, что суточные колебания концентрации гормонов, паттерн секреции которых регулируется СХЯ, таких как гормон роста, тиреотропный гормон, пролактин, лептин, адипонектин и резистин, не изменяются у пациентов с БП de novo [27]. Напротив, при БА бета-амилоид и тау-протеин выявляются в СХЯ еще на преклинической стадии, равно как и изменения суточного профиля секреции мелатонина. Это говорит о раннем вовлечении СХЯ в патологический процесс [21], хотя нарушения циркадианных ритмов при БА развиваются позже и выражены меньше, чем при БП.
Обобщая результаты перечисленных исследований, можно предположить, что повреждение СХЯ не относится к ведущим причинам нарушения циркадианных ритмов при нейродегенеративных заболеваниях.
Возрастные изменения хрусталика, в том числе снижение его прозрачности, а также уменьшение размера зрачков приводят к снижению количества света, попадающего на сетчатку. Этот показатель у 45-летнего человека в два раза ниже, чем у десятилетнего ребенка, а в возрасте 95 лет уменьшается в десять раз [28]. У пациентов с БП и БА, по данным оптико-когерентной томографии, снижена толщина сетчатки, а гистологические исследования подтверждают последующую атрофию зрительных нервов [28].
По данным патологоанатомических исследований, у пациентов с БП альфа-синуклеин выявляется и в клетках сетчатки, в том числе светочувствительных ганглионарных клетках.
Таким образом, результаты исследований подтверждают, что нарушения процесса фоторегулировки играют ключевую роль в патогенезе циркадианной дисфункции при нейродегенеративных заболеваниях [2].
Дофаминергическая терапия – один из факторов, влияющих на циркадианные ритмы, сон и бодрствование. Наблюдение пациентов с БП de novo в течение года показало, что дофаминергическая терапия (леводопа или агонисты дофаминовых рецепторов) приводит к возникновению или усилению имеющейся повышенной дневной сонливости [29]. Известно, что дофаминергические препараты подавляют стадию сна с быстрыми движениями глаз и удлиняют ее латентность как у пациентов с БП, так и у здоровых добровольцев [30].
Механизм влияния дофаминергических средств на процессы сна и бодрствования сложен и зависит от дозы, времени приема препарата и типа рецепторов, на которые он действует. Как уже отмечалось, профиль секреции мелатонина у пациентов с БП de novo не отличается от такового в группе контроля. Тем не менее у пациентов, получающих леводопу, наблюдаются уплощение суточной кривой и сдвиг пика секреции на более ранние часы, что клинически проявляется синдромом ранней фазы сна [26].
Механизм, лежащий в основе изменения секреции мелатонина, при назначении дофаминергических средств не совсем ясен. Скорее всего, смещение фазы секреции мелатонина, индуцированной леводопой, – следствие прямого воздействия на нейроны СХЯ леводопы или образованного из нее дофамина. На это указывает наличие D1, D2-дофаминовых рецепторов в СХЯ, а также изменение экспрессии ряда часовых генов в СХЯ при введении нейролептиков [2].
Моторные и другие немоторные симптомы (моторные флуктуации, в частности ночной тремор и акинезия, синдром беспокойных ног, синдром обструктивного апноэ сна, никтурия) тоже могут приводить к нарушениям циркадианных ритмов, сна и бодрствования.
Установлено, что пациенты с нейродегенеративными заболеваниями демонстрируют десинхроноз на молекулярном уровне. В лейкоцитах крови пациентов с БП обнаруживается снижение уровня экспрессии гена Bmal1 в вечернее время по сравнению с контрольной группой [31]. Кроме того, уменьшается экспрессия гена BMAL2. Вместе с тем данные в отношении генов CLOCK и DEC1 не отличаются в группе БП и контрольной группе [32].
Изменения в работе часовых генов показаны и на животных моделях БП. У животных, которым вводили инъекции 6-гидроксидопамина, снижалась дневная экспрессия гена PER2 в клетках стриатума. В то же время в другом эксперименте на модели трансгенных мышей с повышенной экспрессией альфа-синуклеина экспрессия PER2 не изменялась [14].
В ротеноновой модели БП также выявлено снижение пиков экспрессии PER2, CRY1, CRY2 и BMAL1 и базального уровня экспрессии PER1, CRY1 и BMAL1 [33]. С целью регуляции ритма экспрессии генов применяли мелатонин, но его назначение сопровождалось восстановлением экспрессии только PER1 и не влияло на другие часовые гены, что свидетельствовало о различной чувствительности генов к мелатонину [32].
C. Liu и соавт. предположили, что нарушение экспрессии часовых генов при БП обусловлено изменением процессов метилирования ДНК [34]. Изменения метилирования ДНК (эпигенетический дрейф) наблюдаются и при нормальном старении, но они связаны с развитием ряда заболеваний и в большей степени выражены при нейродегенеративной патологии.
В крупном китайском исследовании по результатам генотипирования восьми часовых генов NPAS2, CLOCK, RORB, ARNTL, CRY1, CRY2, PER1 и NR1D1 в группе больных БП (1394 пациента) и здоровых добровольцев (n = 1342) были получены следующие данные. Вариант rs900147 гена ARNTL и rs2253820 гена PER1 был ассоциирован с БП. Более того, вариант rs900147 ARNTL чаще встречался у пациентов с дрожательной формой, чем с акинетико-ригидной, а вариант rs2253820 PER1 был ассоциирован с акинетико-ригидной формой [35].
При БА также нарушается экспрессия часовых генов в периферических клетках, в том числе BMAL1 [36].
Патоморфологические исследования выявили нарушение ритмичности транскрипции BMAL1, PER1 и CRY1 у пациентов на развернутых и преклинических стадиях БА [37].
D. Craig и соавт. показали, что полиморфизм в гене моноаминооксидазы А, усиливающий ее активность и снижающий содержание свободного серотонина – источника синтеза мелатонина, связан с нарушениями циркадианных ритмов [38].
Как уже отмечалось, нарушения регуляции хронобиологических процессов приводят к колебаниям симптомов в течение суток и нарушениям цикла «сон – бодрствование». Однако связь циркадианных ритмов и нейродегенеративного процесса может быть намного глубже, если учитывать их влияние на предрасположенность к развитию заболевания и течение процесса нейродегенерации. Нарушения циркадианных ритмов влекут за собой усиление процессов окислительного стресса, митохондриальной дисфункции и воспаления, что может способствовать ускорению нейродегенеративного процесса. Кроме того, одной из функций сна является удаление продуктов метаболизма нейромедиаторов. И нарушение этой функции тесно связано с повышением риска развития нейродегенеративных заболеваний.
Лечение нарушений циркадианных ритмов
В настоящее время существует несколько методик, направленных на усиление собственных циркадианных ритмов и их синхронизацию с окружающей средой. Одна из них – подкрепление процесса фоторегулировки за счет фототерапии. Снижение количества света, попадающего на сетчатку, вследствие возрастных изменений тканей глаза и социальных факторов (уменьшение времени, проводимого вне помещения), равно как и снижение числа светочувствительных ганглионарных клеток, приводит к тому, что уменьшается поступление афферентных сигналов из окружающей среды в СХЯ. Результаты исследований показали эффективность фототерапии при нарушениях сна, аффективных и когнитивных нарушениях у пожилых.
Известно несколько вариантов применения фототерапии. Классический предполагает использование лампы искусственного освещения мощностью свыше 1000 люкс, устанавливаемой на уровне глаз на расстоянии метра от пациента. Более естественный вариант фототерапии предполагает создание в помещении переменного уровня освещенности в зависимости от времени суток (англ. dawn-dusk simulation). Согласно данным множества исследований, фототерапия при БА способствует укреплению внутренних циркадианных ритмов в виде улучшения паттерна суточной физической активности, ночного сна, уменьшения вечерней ажитации и дневной сонливости [39]. Кроме того, при БП фототерапия улучшала циркадианные функции за счет снижения дневной сонливости и повышения физической активности в дневное время [40]. Основной недостаток фототерапии – кратковременный эффект (несколько недель после лечения) [36].
В условиях in vitro и экспериментах на моделях животных установлено, что мелатонин характеризуется антиоксидантными и нейропротективными свойствами, а также является основным гормоном-регулятором циркадианных ритмов [36].
Применение мелатонина у макак с MPTP-индуцированным паркинсонизмом, сопровождающимся фрагментацией сна и дневной сонливостью, приводило к удлинению ночного сна и повышению индекса эффективности сна [41].
Эффективность мелатонина при БП оценивали в двух плацебоконтролируемых рандомизированных двойных слепых исследованиях. В первом 40 пациентов с БП получали мелатонин в дозе 5 и 50 мг за 30 минут до сна в течение двух недель. По сравнению с плацебо мелатонин не только улучшал субъективную оценку сна, но и удлинял продолжительность ночного сна по данным актиграфии [42]. В другом исследовании 18 пациентов с БП принимали 3 мг мелатонина или плацебо за час до сна. На фоне лечения отмечалось значительное субъективное улучшение качества сна. Питтсбургский индекс качества сна в основной группе был в два раза ниже, чем в группе плацебо, что, однако, не отразилось на результатах полисомнографии [43].
В качестве синтетического аналога мелатонина, доступного для применения в Российской Федерации, используется препарат Мелаксен («Юнифарм Инк», США). В отечественном исследовании 30 пациентов с БП получали этот препарат в дозе 3 мг в течение шести недель. На фоне его применения отмечалось улучшение показателей сна больных (оценка по Питтсбургскому индексу качества сна), а также выраженности дневной сонливости и депрессивных проявлений [44].
Мелатонин продемонстрировал эффективность и у больных БП с расстройствами поведения в фазе сна с быстрыми движениями глаз, уровень доказательности B [45]. В исследовании Е.А. Ляшенко и соавт. (2015) на фоне применения мелатонина в дозе 3–6 мг в течение четырех недель у 60 больных БП в 84% случаев отмечалось уменьшение выраженности этого расстройства сна, а также показателей дневной сонливости, тревоги и депрессии [46].
У пациентов с БА мелатонин увеличивал продолжительность сна, индекс его эффективности и сокращал время засыпания по данным полисомнографии [36].
Еще один фактор регуляции циркадианных ритмов наряду со светом, мелатонином и другими гормонами – физическая нагрузка. Физические упражнения влияют на работу СХЯ. Механизм действия сложен и затрагивает ядра ствола, таламуса и гипоталамуса. Физические упражнения восстанавливают нарушенные циркадианные ритмы у мышей и изменяют профиль экспрессии часового гена PER2 в периферических клетках. У здоровых добровольцев физические упражнения смещают фазу сна вперед и при выполнении вечером приводят к симпатикотонии в ночное время, при выполнении утром – к ваготонии [47].
В рандомизированном клиническом исследовании изучали эффективность комплекса физических упражнений по 60 минут три раза в неделю у 17 пациентов с БП в течение шести месяцев. У пациентов основной группы отмечались улучшение ночного сна и повышение уровня повседневной активности по сравнению с контрольной группой, пациенты которой не выполняли физических упражнений. В другом исследовании оценивали эффект комбинированных аэробных и гимнастических упражнений, проводимых в течение трех месяцев, у 20 пациентов с БП. По окончании курса наблюдалось улучшение качества жизни и качества сна, уровня повседневной активности [48]. Аналогичные результаты продемонстрировали и пациенты с БА при выполнении мультимодального комплекса физических упражнений по 60 минут три раза в неделю в течение шести месяцев. При сравнении с группой контроля после курса лечения у пациентов основной группы отмечалось улучшение сна и уровня физической активности в дневное время [49].
Прием пищи – еще один фактор синхронизации внутреннего циркадианного ритма с 24-часовым суточным периодом. У пациентов с БА и другими деменциями измененный паттерн приема пищи: максимальное потребление пищи приходится на утро, а количество потребляемой пищи в послеобеденное и вечернее время ниже, чем в контрольной группе [36]. На экспериментальных моделях нейродегенеративных заболеваний показано, что соблюдение строгого режима приема пищи восстанавливает фазы локомоторной активности и нарушенную экспрессию часовых генов в печени грызунов. В одном из исследований прием пищи грызунами только в ночное время замедлял прогрессирование заболевания и приводил к нормализации суточных колебаний температуры тела [36].
O.V. Babkina, M.G. Poluektov, O.S. Levin
Russian Medical Academy of Continuous Professional Education, Moscow
I.M. Sechenov First Moscow State Medical University (Sechenovskiy University)
Contact person: Olga Viktorovna Babkina, olga_bo2010@mail.ru
Alterations of circadian rhythms belong to the typical symptoms of neurodegenerative disease. Pathophysiology of circadian disorders is still not enough investigated despite its wide prevalence and role in decline of quality of life and activities of daily living. This article provides a review of current literature about structures of circadian system and mechanisms of its damage in age-dependent neurodegenerative diseases – Parkinson's disease and Alzheimer's disease, as well as methods for the treatment of these circadian disturbances.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.