Неалкогольная жировая болезнь печени у пациентов с сахарным диабетом 2 типа: особенности патогенеза и лечения
- Аннотация
- Статья
- Ссылки
- English
У больных сахарным диабетом (СД) заболевание встречается в 85–90% случаев. При СД 2 типа и инсулинорезистентности эндокринная функция желчных кислот нарушается, уменьшается их абсорбция. Как следствие, увеличивается жировая инфильтрация печени, нарушается метаболизм липидов, происходит накопление триглицеридов и липопротеинов низкой плотности в печени и плазме. Уменьшение циркулирующих желчных кислот приводит к развитию билиарной недостаточности и прогрессированию НАЖБП.
В патогенезе НАЖБП немаловажную роль также играет дефицит таурина. Последний участвует во всех видах обмена веществ. Кроме того, таурин снижает содержание продуктов жизнедеятельности микроорганизмов в толстой кишке (короткоцепочечных жирных кислот, эндотоксина, оксида азота).
Таурин (Дибикор) оказывает противовоспалительное, антиоксидантное, детоксицирующее и мембраностабилизирующее действие. Его прием ассоциируется с уменьшением степени активности неалкогольного стеатогепатита у пациентов c НАЖБП и СД 2 типа.
У больных сахарным диабетом (СД) заболевание встречается в 85–90% случаев. При СД 2 типа и инсулинорезистентности эндокринная функция желчных кислот нарушается, уменьшается их абсорбция. Как следствие, увеличивается жировая инфильтрация печени, нарушается метаболизм липидов, происходит накопление триглицеридов и липопротеинов низкой плотности в печени и плазме. Уменьшение циркулирующих желчных кислот приводит к развитию билиарной недостаточности и прогрессированию НАЖБП.
В патогенезе НАЖБП немаловажную роль также играет дефицит таурина. Последний участвует во всех видах обмена веществ. Кроме того, таурин снижает содержание продуктов жизнедеятельности микроорганизмов в толстой кишке (короткоцепочечных жирных кислот, эндотоксина, оксида азота).
Таурин (Дибикор) оказывает противовоспалительное, антиоксидантное, детоксицирующее и мембраностабилизирующее действие. Его прием ассоциируется с уменьшением степени активности неалкогольного стеатогепатита у пациентов c НАЖБП и СД 2 типа.

Введение
Неалкогольная жировая болезнь печени (НАЖБП) уже несколько десятилетий является предметом пристального внимания врачей разных специальностей. НАЖБП признана основным компонентом метаболического синдрома и главным фактором риска развития сердечно-сосудистых осложнений [1–4].
Поражение печени при данном заболевании характеризуется жировой дистрофией (стеатоз) с воспалением и повреждением гепатоцитов (неалкогольный стеатогепатит (НАСГ)) и развитием фиброза. При прогрессировании существует риск перехода НАЖБП в цирроз.
В 75% случаев НАЖБП сочетается с ожирением, дислипидемией, артериальной гипертензией, сахарным диабетом (СД) 2 типа или нарушением толерантности к глюкозе (НТГ) [1, 5, 6]. Указанные патологические процессы относятся к факторам риска прогрессирования атеросклероза и развития сердечно-сосудистых заболеваний.
Определенная роль в патогенезе НАЖБП отводится снижению синтеза и нарушению транспорта желчных кислот (ЖК), что обусловлено повреждением мембран гепатоцитов, ингибированием ферментных систем и воспалением.
Желчные кислоты – стероидные монокарбоновые кислоты, производные холановой кислоты. Они образуются в гладком эндоплазматическом ретикулуме гепатоцитов и являются секретом эпителиальных клеток печени.
Биосинтез ЖК считается одним из важных путей выведения холестерина (ХС). Пул ЖК у человека представлен примерно в равных количествах высокогидрофобными холевой, хенодезоксихолевой, дезоксихолевой кислотами. Первичные ЖК конъюгируются с глицином и таурином, что повышает их гидрофильность. Они являются активаторами ядерных рецепторов, регулирующих экспрессию генов, участвующих в секреции, транспорте и метаболизме первичных ЖК, ХС и триглицеридов (ТГ) в гепатоцитах и плазме [3, 7, 8].
При СД 2 типа и инсулинорезистентности (ИР) эндокринная функция ЖК нарушается, уменьшается их абсорбция. Как следствие, увеличивается жировая инфильтрация печени, нарушается метаболизм липидов, в печени и плазме накапливаются ТГ и липопротеины низкой плотности (ЛПНП). Развивается билиарная недостаточность, которая в свою очередь приводит к уменьшению количества желчи и циркулирующих ЖК. В результате развиваются жировая болезнь печени и холелитиаз [3, 4, 6, 9–12].
ЖК являются активаторами липолитических ферментов, повышают активность липазы в 10–15 раз. В крови желчные кислоты транспортируются главным образом с альбумином, а также с липопротеинами высокой плотности (ЛПВП).
Образование желчи, транспорт ЖК связан с активностью Na/K-АТФазы, играющей важную роль в захвате гепатоцитами хлоридов и бикарбонатов из плазмы. Нарушение активности Na/K-АТФазы обусловливает снижение чувствительности рецепторов к инсулину.
Нарушение транспортных функций гепатоцитов приводит к нарушению метаболизма лекарств, изменению их токсичности и эффективности.
При воспалении значительно снижается активность многих белков-транспортеров. В первую очередь происходят нарушения в мембранных белках транспортеров глюкозы. Это приводит к ИР, провоцирует развитие сосудистой воспалительной реакции из-за избыточной продукции жировой тканью воспалительных цитокинов [4, 10, 12]. Перекисное окисление липидов подавляет активность ферментов – цитохромоксидазы (таким образом угнетается тканевое дыхание) и гидроксилазы (участвует в превращении холестерола в ЖК). Под влиянием активных форм кислорода нередко образуются аномальные формы ЖК, липопротеинов, липидов и других продуктов секреции желчи. Как следствие, изменяются их физико-химические свойства, физиологические функции, развивается и прогрессирует НАСГ. Пероксинитрит тормозит ферменты дыхательной цепи митохондрий – мембранную Na/K-АТФазу и блокирует натриевые каналы. Избыток в клетках свободных жирных кислот (СЖК) усиливает продукцию активных форм кислорода, активизируется синтез эндотелием синтазы оксида азота (NO) и его образование. При избытке СЖК уменьшается связывание инсулина рецепторами гепатоцитов и развивается гиперинсулинемия. Инсулин стимулирует образование NO. Высокая продукция NO наблюдается при эндотоксинемии, септическом шоке и увеличенной кишечной проницаемости при воспалительных заболеваниях кишечника [13, 14].
Эндотоксинемия угнетает антиоксидантную систему, что сопровождается повышением деконъюгации ЖК, образованием токсичных солей и повышением реабсорбции. При этом синтез ЖК уменьшается, ХС – увеличивается.
В патогенезе НАЖБП немаловажную роль играет дефицит таурина.
Таурин – жизненно необходимая сульфоаминокислота, которая является конечным продуктом обмена серосодержащих аминокислот (метионина, цистеина, цистеамина) [15, 16]. Молекула таурина состоит из двух атомов углерода, сульфоновой группы (SO3H) и аминогруппы (NH2). Однако биологически синтезируемого таурина недостаточно для поддержания биохимических процессов в организме, в которых он задействован. Основным источником таурина считаются мясные и рыбные продукты. При недостаточности поступления таурина с пищей или вследствие каких-либо иных причин (ишемия, СД, стресс, травма и др.) страдают все виды обмена веществ в каждой клетке каждого органа. Так, дефицит таурина в печени ассоциируется с нарушением выделения желчи, образованием камней, изменением обмена ХС и липидов.
Известно, что таурин, соединяясь с холевой кислотой, участвует во всасывании жиров и жирорастворимых витаминов.
Таурин может соединяться с атомом хлора, источником которого является гипохлорная кислота, производимая активированными нейтрофилами. В данном случае таурин выступает в качестве окислителя и компонента антибактериальной защиты.
В митохондриях хлораминотаурин влияет на сборку белков дыхательной цепи и оказывает антиоксидантное воздействие. Это соединение уменьшает воспалительный сигнал в клетках животных через ингибирование активации нуклеарного фактора каппа B.
В свободном состоянии таурин выполняет жизненно важную для животной клетки функцию – регуляцию осмотического давления и ионов кальция.
Таурин участвует в регуляции желчевыделения. Первичные ЖК (холевая и хенодезоксихолевая) синтезируются в гепатоцитах печени из ХС. Вторичные (литохолевая, урсодезоксихолевая, аллохолевая и др.) – образуются из первичных ЖК в толстой кишке.
В желчном пузыре ЖК присутствуют главным образом в виде конъюгатов – парных соединений с глицином и таурином. Продуктом конъюгации ЖК с таурином являются таурохолевая, таурохенодезоксихолевая и тауродезоксихолевая кислоты. Конъюгация с ЖК обеспечивает их устойчивость – не выпадают в осадок при низких значениях рН в желчных протоках и двенадцатиперстной кишке. Важная роль ЖК в пищеварении заключается в способствовании всасыванию ряда гидрофобных веществ: ХС, жиров, жирорастворимых витаминов, растительных стероидов. В отсутствие ЖК всасывание вышеперечисленных компонентов практически невозможно.
Таурохолевая кислота снижает количество Escherichia coli в слепой кишке [17].
В отличие от ЖК, конъюгированных с глицином, тауроконъюгаты ЖК обладают холеретическим действием и предупреждают развитие холестаза [18, 19].
В исследовании in vitro гликолитохолевая кислота легко осаждается кальцием, чего не наблюдается с тауролитохолевой кислотой [13]. Таким образом, таурин необходим для повышения текучести желчи, увеличения продукции ЖК и предупреждения развития холестаза [14, 20].
Таурин снижает содержание продуктов жизнедеятельности микроорганизмов в толстой кишке (короткоцепочечных жирных кислот, эндотоксина, оксида азота) [21–23].
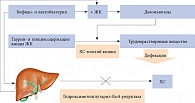
При диффузных заболеваниях печени таурин увеличивает кровоток, улучшает микроциркуляцию и уменьшает выраженность цитолиза [24]. Доказано его положительное влияние на углеводный и липидный обмен. Антиоксидантное, гипогликемическое, детоксицирующее действие таурина и его способность выводить ХС (рис. 1) позволяют рассматривать его в качестве препарата для терапии НАЖБП.
У больных СД таурин уменьшает ИР, защищает бета-клетки поджелудочной железы, оказывает сахароснижающее действие, не вызывая развития гипогликемии [14, 20].
В деконъюгации комплексов ЖК с таурином и глицином активно участвуют ферменты различных бактерий. В норме дезоксихолевая и хенодезоксихолевая кислоты при участии секреторного иммуноглобулина А, влияющего на их антимикробную активность, подавляют рост патогенных и условно патогенных микроорганизмов даже в физиологических концентрациях [2]. При нарушении энтерогепатической циркуляции ЖК в кишечнике образуется их значительный дефицит. В тонкой кишке недостаток ЖК обусловливает изменение работы всего пищеварительно-транспортного конвейера, нарушение всасывания и переваривания пищи (синдром нарушенного всасывания). В толстой кишке их дефицит (помимо многочисленных метаболических нарушений) ассоциируется со снижением «стерилизующих» и нутритивных свойств желчи. Прогрессирование дисбиоза, брожение, дисфункция баугиниевой заслонки и усиление микробной контаминации тонкой (подвздошной) кишки, с одной стороны, поддержание хронического воспаления в печени вследствие поступления через систему воротной вены с кровью повышенного количества эндотоксина грамотрицательной микрофлоры – с другой, способствуют прогрессированию стеатогепатита (рис. 2 и 3).
В связи с вышеизложенным необходимым условием эффективного лечения НАЖБП представляется восстановление энтерогепатической циркуляции желчных кислот: нормализация синтеза желчи в печени и ее адекватное поступление в кишечник [25]. Поэтому назначение препаратов, одновременно обеспечивающих антиоксидантную защиту, стабилизацию мембран гепатоцитов, противовоспалительное действие, нормализацию состава метаболитов кишечной микрофлоры, обоснованно.
Цель исследования
В ходе исследования было поставлено три цели:
- определить общее содержание ЖК в сыворотке крови пациентов с НАЖБП и СД 2 типа;
- оценить влияние маркеров воспаления (NO, эндотоксина, фосфолипазы А2 (ФЛА2), малонового диальдегида (МДА)) на синтез и транспорт ЖК;
- проанализировать фармакодинамические показатели метаболитов NO и бактериального эндотоксина, биохимические показатели крови и липидного спектра на фоне терапии таурином (препаратом Дибикор) у больных НАЖБП и СД 2 типа.
Материал и методы исследования
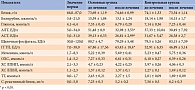
Обследовано 158 пациентов с НАЖБП (90 женщин и 68 мужчин). Средний возраст больных – 55,5 ± 7,5 года. С СД 2 типа 46 пациентов, с НТГ – 112. Индекс массы тела обследованных более 30 кг/м2. Диагноз верифицирован клиническими, биохимическими, инструментальными и морфологическими методами.
Общее содержание ЖК в сыворотке крови определяли ферментным методом на биохимическом анализаторе Olimpus с использованием тест-систем Randox (Англия). Содержание ФЛА2 – иммуноферментным методом с использованием диагностических наборов PLAC TEST ELiSA Kit (США). Перекисное окисление липидов – по содержанию МДА с тиобарбитуровой кислотой. Для оценки уровня эндотоксина применяли хромогенный метод по конечной точке с использованием LAL-теста (Limulus Amebocyte Lysate). Уровень метаболитов NO оценивали скрининг-методом в биологических жидкостях с хлоридом ванадия (Германия).
В двойное слепое плацебоконтролируемое исследование включено 40 больных, страдающих НАЖБП и СД 2 типа: 30 женщин и 10 мужчин. Их средний возраст составил 56,35 ± 8,75 года. Методом случайных чисел пациентов разделили на две группы. Первая (основная группа) получала таурин (Дибикор, ООО «ПИК-ФАРМА»), вторая (контрольная группа) – плацебо.
Дибикор назначали в дозе 0,5 г два раза в день за 20 минут до еды. Длительность применения – три месяца. Статистическую обработку данных проводили с использованием программы «Биостат».
Результаты и их обсуждение
Общее содержание ЖК в сыворотке крови. У больных НАЖБП без нарушений углеводного обмена (68 пациентов) среднее содержание ЖК в сыворотке крови составило 5,4 ± 1,8 мкмоль/л. У больных НАЖБП с НТГ – 8,88 ± 4,94 мкмоль/л. У 59 пациентов с НАЖБП и СД 2 типа их содержание было достоверно ниже на 45% и составило 2,97 ± 0,2 мкмоль/л (р = 0,001). У пациентов с НАЖБП, которая наблюдается при ожирении в 90% случаев [1, 3], изменяется состав желчи, увеличивается ее литогенность и развиваются билиарный сладж и холелитиаз. Желчные кислоты регулируют метаболизм глюкозы и липидов. Биосинтез и транспорт ЖК связан с активностью фермента Na/K-AТФазы. ЖК восстанавливают чувствительность рецепторов к инсулину [4, 6, 9, 12], лептину, грелину и адипонектину.
При развитии воспаления снижается активность НNF4-альфа (гепатоцитарный ядерный фактор для синтеза и конъюгации ЖК) [4, 6, 9, 10, 12].
Оксид азота ингибирует и блокирует натриевые каналы, подавляет активность фермента холестеролгидроксилазы, осуществляющей превращение холестерола в ЖК.
При воспалении, гипоксии, эндотоксиновой агрессии нарушаются функции эндотелия. Макрофаги под действием эндотоксина выделяют NO, который легко проникает в клетки и, взаимодействуя с ферментами и белками-переносчиками, влияет на конъюгацию ЖК, липопротеинов и глюкозы.
Уровень стабильных метаболитов NO в группе НАЖБП и СД 2 типа оказался достоверно выше и составил в среднем 137,7 ± 35,96 мкмоль/л по сравнению с группой НАЖБП и НТГ и контрольной группой – 66,75 ± 17,01 и 32,15 ± 0,51 мкмоль/л (р = 0,0001). Содержание метаболитов NO возрастало параллельно концентрации аминотрансфераз (r = 0,86) и ФЛА2 (r = 0,658). ФЛА2 гидролизует окисленный фосфатидилхолин с образованием жирной кислоты и лизофосфатидилхолина, который изменяет активность синтазы NO и количество синтезируемого NO или снижает его биодоступность.
Утилизация глюкозы в жировой и мышечной тканях NO-зависима, при блокировании как нейрональной, так и эндотелиальной NO-синтазы развивается гипергликемия [19]. Оксид азота ингибирует Na/K-АТФазу. В результате снижается чувствительность к инсулину, ингибируются митохондриальные ферменты, цитохром Р-450, который метаболизирует ЖК и ХС, происходит накопление СЖК в клетках печени.
Уровень ФЛА2 в сыворотке крови пациентов с НАЖБП и СД 2 типа в среднем составил 621,9 ± 84,71 нг/мл (медиана – 605 (504–826) нг/мл) (р = 0,0001), пациентов с НАЖБП и НТГ – 423,2 ± 45,2 нг/мл (медиана – 430 (324–497) нг/мл) (р = 0,0001).
При попадании в кровоток ФЛА2 связывается и транспортируется с ЛПНП. Между ФЛА2 и ЛПНП отмечена корреляционная зависимость (r = 0,957): чем выше в плазме крови уровень ХС ЛПНП, тем более активно формируется атероматоз интимы артерий, тем больше выражен дефицит в клетках эссенциальных полиеновых жирных кислот. Как следствие, повышается вязкость фосфолипидов в мембране клеток, нарушается функция белков мембраны, в том числе глюкозных транспортеров, что приводит к развитию СД 2 типа.
Содержание эндотоксина в сыворотке крови в группе НАЖБП и СД 2 типа было увеличено в 12 раз по сравнению с содержанием эндотоксина в контрольной группе – 3,69 ± 1,44 ЕЭ/мл (норма – 0,3 ± 0,05 ЕЭ/мл). В группе НАЖБП и НТГ его уровень составил 1,43 ± 0,24 ЕЭ/мл (р = 0,0001). Повышение эндотоксина и NO выявлено при прогрессировании воспалительной инфильтрации в печени (рис. 4). Эндотоксин активирует Са2+-каналы на мембране гладкомышечных клеток, что приводит к активации ФЛА2.
Показатели перекисного окисления липидов. Содержание МДА у пациентов с НАЖБП и СД 2 типа в зависимости от степени выраженности воспаления оказалось увеличенным в два раза. При гипергликемии и чрезмерном накоплении липидов в гепатоцитах усиливаются процессы перекисного окисления первых, что проводит к некрозу гепатоцитов, нарушению функции митохондрий, развитию фиброза и формированию стеатогепатита (см. рис. 2–4).
Выявлена также связь перекисного и фосфолипазного механизмов повреждения мембран гепатоцитов. Отмечена корреляционная зависимость между ФЛА2 и МДА. Коэффициент корреляции – -578 (р = 0,005).
Уровень метаболитов NO у пациентов с НАЖБП и СД 2 типа до лечения был повышен в 6,8 раза и составлял 220,7 ± 14,27 мкмоль/л (норма – 32,15 ± 0,51 мкмоль/л) (р = 0,001). После лечения Дибикором их содержание снизилось на 97 мкмоль/л (44%) (рис. 5).
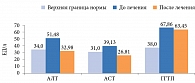
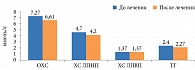
Лечение таурином сопровождалось улучшением биохимических показателей крови. Отмечалось снижение общего ХС (ОХС), ХС ЛПНП и ТГ, нормализация липидного спектра. Уровень метаболитов NO уменьшался одновременно с уменьшением уровня аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и гамма-глутамилтранспептидазы (ГГТП) (таблица, рис. 6 и 7).
Таким образом, у пациентов с НАЖБП и СД 2 типа отмечено снижение уровня ЖК на 45%, что связано с повреждением мембран клеток, ингибированием ферментных систем и воспалением. Увеличение содержания маркеров воспаления липопротеин-ассоциированной ФЛА2, NO, эндотоксина, МДА при НАЖБП и СД 2 типа связано с воспалительным процессом в печени, повышением активности печеночных ферментов и тяжелыми морфологическими изменениями.
Заключение
Полученные результаты свидетельствуют о противовоспалительном, антиоксидантном, детоксицирующем и мембраностабилизирующем действии Дибикора у пациентов с НАЖБП и СД 2 типа. На фоне приема препарата уменьшалась активность НАСГ, что сопровождалось улучшением биохимических показателей крови и липидного спектра (отмечена тенденция к снижению ОХС, ХС ЛПНП, увеличению ХС ЛПВП), снижением уровня метаболитов NO параллельно снижению уровня АЛТ, АСТ и ГГТП.
L.A. Zvenigorodskaya, A.M. Mkrtumyan, T.V. Nilova, M.V. Shinkin, A.V. Petrakov
FSFI ‘Moscow Clinical Scientific and Practical Center’ Moscow Healthcare Department
FSBEI HE ‘A.I. Yevdokimov Moscow State University of Medicine and Dentistry’
Contact person: Larisa Arsentyevna Zvenigorodskaya, msll@rambler.ru
At present, nonalcoholic fatty liver disease (NAFAD) is one of the most common liver disorders. Bile acid imbalance is considered as an important pathogenetic aspect in developing NAFAD pathogenesis.
NAFAD is recorded in 85–90% cases in diabetes mellitus patients. In patients with type 2 DM and insulin resistance endocrine function of bile acids is impaired and their absorption is lowered. As a consequence, liver fatty infiltration is increased, lipid metabolism is disturbed, which is accompanied with accumulated triglycerides and low density lipoproteins both in the liver and blood serum. Lowered level of circulating bile acids results in development of biliary insufficiency and NAFAD progression.
In addition, deficiency of taurine involved in all metabolic pathways plays an important role in NAFAD pathogenesis. Moreover, taurine reduces amount of microbial products in the colon (short chain fatty acids, endotoxin, nitric oxide).
Taurine (Dibicor) exhibits anti-inflammatory, anti-oxidant, detoxifying and membrane stabilizing effects, and its administration is associated with decreased activity of nonalcoholic steatohepatitis in patients with NAFAD and type 2 DM.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.