Неврологические проявления COVID-19
- Аннотация
- Статья
- Ссылки
- English
О коронавирусах, вызывающих развитие тяжелой пневмонии, заговорили в начале XXI в. Так, первые случаи тяжелого острого респираторного синдрома (SARS-CoV) с летальностью около 10% были зафиксированы в 2003 г. Ближневосточный респираторный синдром (MERS-CoV) с летальностью около 35% был зарегистрирован в 2012 г. И, наконец, в декабре 2019 г. появились первые сообщения о новой болезни, которую изначально приняли за вспышку SARS-CoV, но, как оказалось, это заболевание вызывается новым типом коронавируса, который 11 февраля 2020 г. получил название SARS-CoV-2, а заболевание, закономерно продолжающее череду коронавирусных пневмоний, – COVID-19.
Коронавирус, вызывающий COVID-19, – РНК-содержащий вирус семейства Coronaviridae. Он содержит в структуре несколько белков: белок шипов (spike protein, или S-protein), белок оболочки (envelope protein, или E-protein), мембранный белок (membrane protein, или M-protein) и белок нуклеокапсида (nucleocapsid protein, или N-protein). S-белок отвечает за прикрепление к клетке-хозяину. Вследствие высокого сходства S-белка с ангиотензинпревращающим ферментом 2 (АПФ2) рецепторы АПФ2 становятся мишенью для SARS-Cov-2, соответственно в любую клетку человеческого организма, содержащую рецептор АПФ2, может проникнуть коронавирус. Далее вирус инициирует сборку своих белков в рибосоме клетки-хозяина и высвобождается через экзоцитоз. Воротами инфекции при COVID-19 могут быть эпителиальные и гладкомышечные клетки дыхательного тракта, почек, пищевода, мочевого пузыря, подвздошной кишки, сердца, а также центральной нервной системы. Безусловно, самая быстро и легко достижимая цель – альвеолоциты 2-го типа, поэтому к первым и типичным симптомам заражения SARS-CoV-2 относятся кашель, одышка, повышение температуры, слабость часто как проявления вирусной пневмонии.
Согласно санитарным правилам, устанавливающим требования к организационным, санитарно-противоэпидемическим мероприятиям, направленным на обеспечение личной и общественной безопасности, защиту окружающей среды при работе с патогенными биологическими агентами [1], вирус SARS-CoV-2 относится ко второму классу патогенности, то есть к высококонтагиозным эпидемическим болезням человека, в основном из-за особенностей распространения. Источником инфекции, согласно имеющимся на текущий момент сведениям, может быть как больной человек, так и здоровый носитель. В настоящее время описаны воздушно-капельный и контактно-бытовой способы передачи. Однако согласно данным лабораторных исследований, предполагается также фекально-оральный путь передачи COVID-19 [2]. При этом пациент с SARS-CoV-2 заразен в течение инкубационного периода, всего периода заболевания и двух недель после его окончания [3]. Окончанием заболевания считается дважды (с разницей в 24 часа) отрицательный результат теста, выполненного методом полимеразной цепной реакции. Все вышесказанное, а кроме того, способность вируса сохраняться от двух до пяти суток на поверхностях при температуре 18–25 °С, безусловно, определяет его принадлежность к высококонтагиозным заболеваниям.
Летальность при COVID-19 не полностью изучена и приблизительно составляет около 3–4%. Однако показатели по странам разнятся от 0,1 до 11%, что может объясняться спецификой тестирования населения (от выборочного тестирования тяжелых случаев до тотального скрининга) и особенностями выборки заболевших пациентов. Так, согласно данным Всемирной организации здравоохранения, смертность при COVID-19 увеличивается с возрастом и составляет 0,4% у пациентов 40–49 лет, 1,3% – 50–59 лет, 3,6% – 60–69 лет, 8,1% – 70–79 лет, более 14,9% у пациентов старше 80 лет. Отмечается корреляция между сопутствующими заболеваниями и летальностью при COVID-19: наибольшая летальность выявлена при коморбидной сердечно-сосудистой патологии (13,2%), сахарном диабете (9,2%), артериальной гипертензии (8,4%), хронических заболеваниях дыхательных путей (8,1%). Взаимосвязь тяжести течения COVID-19 и сопутствующей сердечно-сосудистой патологии объяснима с учетом высокой тропности этого вируса к клеткам-мишеням, содержащим рецепторы к АПФ2 [4].
SARS-CoV-2 обладает еще рядом негативных свойств, в частности некоторым сходством его белковых последовательностей с таковыми у адренокортикотропного гормона человека (АКТГ), а также способностью подавлять путь интерферона 1 хозяина, уклоняясь от атак иммунной системы носителя. Вышеупомянутые особенности приводят к выраженной лимфоцитарной реакции, первичной продукции провоспалительных цитокинов (например, интерферона гамма, интерлейкинов 1B, 6, 12, фактора некроза опухолей) и хемокинов (CXCL10 и CCL2) и далее вследствие неэффективности иммунного ответа к продолжающейся продукции цитокинов, истощению иммунной системы и массовой гибели лимфоцитов и макрофагов. Полученное явление известно как цитокиновый шторм. Впервые этот термин был использован при описании отторжения трансплантата и создании иммунного ответа «трансплантат против хозяина» из-за сильной активации иммунной системы [6]. Степень увеличения уровня провоспалительных цитокинов зависит от выраженности поражения легких и максимальна при остром респираторном дистресс-синдроме – воспалительном повреждении альвеолярно-капиллярной мембраны с накоплением в воздушном пространстве альвеол большого количества отечной жидкости, богатой белком, с дальнейшим развитием дыхательной недостаточности. Таким образом, цитокиновый шторм чаще будет наблюдаться при тяжелом течении болезни.
Цитокиновый шторм в свою очередь может приводить к синдрому диссеминированного внутрисосудистого свертывания в результате увеличения уровня активного тромбопластина на фоне экспрессии цитокинов, дальнейшей активации перехода протромбина в тромбин, развития гиперкоагуляции и усиливающейся коагулопатии потребления. Следствием нарушения прокоагулянтно-антикоагулянтного баланса в конечном счете становятся внутрисосудистая коагуляция, множественные микротромбозы и одновременно нарастающая активация плазминогена с повышением риска кровоизлияний [5].
Исходя из имеющихся на текущий момент знаний о патогенезе COVID-19, можно предположить, что поражение нервной системы при этом заболевании способен вызывать не только непосредственный контакт с вирусом, но и иммунное воспаление, гипоксия и гипоксемия на фоне острого респираторного дистресс-синдрома, а также повышенная склонность к тромбообразованию и одновременно риску кровоизлияний на фоне синдрома диссеминированного внутрисосудистого свертывания.
Говоря о патогенезе гипоксемии при COVID-19, нужно остановиться на исследовании W. Liu и H. Li [7]. Авторы проанализировали строение белков SARS-CoV-2 и на основе трехмерного моделирования показали, что белок ORF8 может связываться с порфирином, а белок ORF10 способен атаковать 1-бета цепь гемоглобина и связываться с гемом. На основании полученных данных авторы предположили, что указанные особенности строения вируса могут быть дополнительным субстратом гипоксемии, а также объяснять механизм виремии у взрослых пациентов и более легкое течение болезни (учитывая иное строение гемоглобина) у детей. Отметим, что это исследование, основанное на вычислительных методах, немедленно подверглось критике вследствие отсутствия экспериментальных доказательств [8].
Рассматривая возможности непосредственного поражения центральной нервной системы у пациентов с COVID-19, необходимо уделить внимание такому симптому, как снижение обоняния (гипосмия). Интересно, что первичный анализ неврологических симптомов, проведенный у 214 пациентов, госпитализированных с подтвержденным диагнозом, не сообщал об ухудшении у них обоняния [9]. Однако впоследствии при распространении COVID-19 в европейской популяции исследователи разных стран отметили этот симптом как типичный для SARS-CoV-2 на ранних стадиях заболевания. Анализ полученных данных и клинических проявлений у пациентов с гипосмией позволил J. Duque Parra и соавт. предположить, что снижение обоняния возникает в результате непосредственной инвазии вируса через циркумвентрикулярные органы, а именно через organum vasculosum laminae terminalis из-за отсутствия гематоэнцефалического барьера [10]. Дальнейшее распространение SARS-CoV-2 в веществе мозга приводит к непосредственному поражению обонятельных нервов и предположительно гипоталамуса, поскольку в составе n. olfactorius есть нейроны, аксоны которых проецируются на преоптическое и супрахиазмальное ядра гипоталамуса. В таком случае гипосмия будет развиваться одновременно с изменением секреции антидиуретического гормона и уровнем артериального давления. Это предположение было сделано в том числе на основании анализа данных о поражении мозга при SARS-CoV, к настоящему времени изученного более детально. По данным R. Pal, у 40% пациентов с SARS-CoV был выявлен центральный гипокортицизм, полностью разрешившийся через год от дебюта заболевания [11]. У небольшой части пациентов, перенесших SARS-CoV, обнаружен гипотиреоз, развившийся в течение трех месяцев после выздоровления. Было высказано предположение о механизме поражения гипоталамо-гипофизарной системы. Как было уже упомянуто, SARS-CoV и SARS-CoV-2 характеризуются экспрессией определенных молекулярных последовательностей, действующих как имитаторы АКТГ. Таким образом, антитела хозяина к SARS-CoV и SARS-CoV-2 могут разрушать АКТГ, снижая его уровень и повышая уровень кортизола. Однако и клетки гипоталамуса, и клетки гипофиза содержат рецепторы к АПФ2 и, вероятно, могут непосредственно поражаться вирусом.
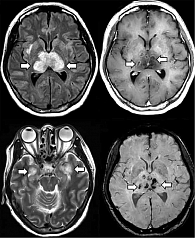
Одним из механизмов поражения вещества мозга при COVID-19 может быть аутоиммунное воспаление на фоне цитокинового шторма. N. Poyiadji и соавт. описали случай острой некротизирующей энцефалопатии у 58-летней пациентки с подтвержденным COVID-19 [12]. Пациентка обратилась за медицинской помощью через три дня лихорадки, кашля и измененного психического состояния. При поступлении она была вялой, дезориентированной. Ей было выполнено подробное исследование ликвора на вирус гриппа, герпеса, лихорадки Западного Нила, бактериальную инфекцию. Проведенные тесты оказались отрицательными, тест на COVID-19 – положительным. Компьютерная и магнитно-резонансная томографии показали симметричный некроз таламусов и глубоких отделов височных долей (рис. 1) [12]. Позднее сходные клинические и нейровизуализационные проявления были описаны у 74-летнего пациента с подтвержденным COVID-19.
T. Moriguchi и соавт. описали случай менингоэнцефалита у 24-летнего пациента с подтвержденным COVID-19 [13]. Заболевание дебютировало с головной боли, лихорадки и астении. Состояние пациента прогрессивно ухудшалось, на девятые сутки болезни он был найден лежащим на полу без сознания. Пациент был госпитализирован, в машине скорой помощи у него была впервые зафиксирована серия кратковременных генерализованных тонико-клонических судорог. По прибытии в стационар состояние пациента по шкале комы Глазго соответствовало 6 баллам, отмечалась ригидность затылочных мышц и менингеальные знаки. Компьютерная томография легких показала двустороннюю пневмонию с изменениями по типу «матового стекла». Исследование ликвора подтвердило диагноз COVID-19. Магнитно-резонансная томография была выполнена через 20 часов после госпитализации, режим DWI показал зону повышенного сигнала вдоль стенки нижнего рога правого бокового желудочка. В режиме FLAIR были выявлены зоны повышенного сигнала в правой височной доле и гиппокампе в сочетании с некоторым уменьшением объема гиппокампа. Авторы предположили, что менингоэнцефалит у пациента развился вследствие непосредственного поражения вещества мозга вирусом SARS-CoV-2.
Говоря о возможном поражении мозга при COVID-19, нужно подробнее остановиться на опосредованном поражении вещества мозга в результате влияния на сердечно-сосудистую систему. Так, первое исследование на эту тему, выполненное Т. Guo и соавт., показало, что сильным независимым от пола пациентов фактором риска тяжелого течения заболевания была артериальная гипертензия [14]. Эти данные, в дальнейшем подтвержденные другими исследователями, вошли в официальную статистику Всемирной организации здравоохранения как факторы, определяющие летальность при COVID-19.
E. Baldi и соавт., используя данные Lombardia CARe, сравнили частоту развития внебольничных остановок сердца, которые произошли в провинциях Лоди, Кремона, Павия и Мантуя в течение первых 40 дней вспышки COVID-19 (с 21 февраля по 31 марта 2020 г.) и за тот же период 2019 г. (с 21 февраля по 1 апреля, с учетом високосного 2020 г.) [15]. В 2020 г. было зарегистрировано 362 случая внебольничной остановки сердца по сравнению с 229 случаями, выявленными за тот же период в 2019 г. (рост на 58%). Кроме того, авторы сопоставили данные по внезапной сердечной смерти и заболеваемости COVID-19 (включая клинические симптомы и подтвержденный лабораторно SARS-CoV-2 как прижизненно, так и посмертно). За исследуемый период зарегистрировано 9806 случаев заболевания COVID-19. Совокупная частота внебольничной остановки сердца в 2020 г. была тесно связана с совокупной заболеваемостью COVID-19 (коэффициент ранговой корреляции Спирмена 0,87; 95%-ный доверительный интервал 0,83–0,91; p < 0,001) и увеличением числа случаев (+133) внебольничной остановки сердца по сравнению с 2019 г. В общей сложности 103 пациентам с внебольничной остановкой сердца был поставлен диагноз COVID-19 при жизни или посмертно (87 и 16 пациентов соответственно). На основании полученных сведений исследователи предположили, что SARS-CoV-2 может увеличивать риск развития нарушений сердечного ритма и остановки сердца. Похожие данные были приведены и другими авторами [16, 17]. Предположительно причиной нарушения ритма сердца могут быть миокардит, гипоксия, нейрогуморальные нарушения, цитокиновый шторм, а также терапия хлорохином, гидроксихлорохином и комбинацией «лопинавир + ритонавир».
Ранее уже говорилось о возможном развитии гиперкоагуляции у пациентов на фоне тяжелого течения COVID-19. Гиперкоагуляция нередко в сочетании со склонностью к кровоизлияниям неоднократно описывалась в различных работах, посвященных SARS-CoV-2. Так, M. Panigada и соавт. показали повышение уровней фибриногена и D-димера у пациентов со среднетяжелым и тяжелым течением заболевания [18]. F. Klok и соавт. изучали частоту возникновения тромботических осложнений в наблюдательном исследовании с участием 184 пациентов с тяжелым течением COVID-19 из трех голландских больниц [19]. Антикоагулянтные препараты принимали 9,2% пациентов, у 38% было зарегистрировано нарушение свертываемости крови. У 31 пациента развилась тромбоэмболия, у трех – ишемический инсульт. Полученные данные позволили исследователям предположить, что ишемический инсульт может быть типичным осложнением COVID-19 при условии среднетяжелого или тяжелого течения болезни. С этой точкой зрения согласны и другие авторы. В частности, первое исследование частоты неврологических проявлений у 214 пациентов в Ухане показало, что неврологические осложнения были зарегистрированы у 78 (36,4%) пациентов, в том числе ишемический инсульт у 5 (5,7%) пациентов [9]. У всех пациентов с развившимся на фоне COVID-19 острым нарушением мозгового кровообращения отмечалась сопутствующая сердечно-сосудистая патология: артериальная гипертензия, сахарный диабет, гиперлипидемия, ожирение. A. Avula и соавт. привели похожее наблюдение пяти пациентов с ишемическим инсультом на фоне подтвержденного COVID-19 [20]. Все пациенты (возраст от 73 до 88 лет) имели сопутствующую сердечно-сосудистую патологию, в основном артериальную гипертензию и гиперлипидемию.
На фоне ожидаемого повышения частоты ишемических инсультов у пожилых пациентов с сочетанием COVID-19 и сердечно-сосудистой патологии неожиданным стало описание нескольких молодых, соматически здоровых пациентов, инфицированных SARS-CoV-2, с серией тромбоэмболий легочной артерии и повторяющимися ишемическими инсультами. Так, сообщалось о развитии ишемического инсульта у молодого пациента без соматической патологии [21]. Пациент был госпитализирован со среднетяжелым течением COVID-19, потребовавшим его нахождения в отделении интенсивной терапии. После того как состояние пациента улучшилось и его перевели в общую палату, у него развилось несколько последовательных тромбоэмболий легочной артерии. Были назначены антикоагулянты, но на фоне терапии уже после выписки из стационара у пациента развился ишемический инсульт в бассейне левой средней мозговой артерии. В апреле 2020 г. под наблюдением находилось еще шесть молодых, соматически здоровых пациентов с инсультами после перенесенного COVID-19 вследствие тромбоза общей сонной артерии и ее крупных ветвей. У всех пациентов были существенно повышены уровни D-димера, ферритина и С-реактивного белка в крови. У трех пациентов был выявлен тромбоз в нескольких ветвях средней мозговой артерии, у двух – рецидивирующее течение острого нарушения мозгового кровообращения на фоне терапии антикоагулянтами. Один пациент умер [21].
Пять похожих случаев острого нарушения мозгового кровообращения у соматически здоровых пациентов в возрасте до 50 лет с подтвержденным COVID-19 были описаны группой исследователей из Нью-Йорка [22]. Сообщается также о трех молодых пациентах из Уханя без сердечно-сосудистой патологии, но с развитием массивных тромбозов сонной артерии и ее ветвей [23]. Таким образом, взаимосвязь гиперкоагуляции, соматической патологии и тромбозов легочных и сонных артерий у пациентов с COVID-19 нуждается в дальнейшем пристальном изучении.
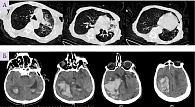
Геморрагический инсульт у пациентов, инфицированных SARS-CoV-2, встречается значительно реже, чем острое нарушение мозгового кровообращения по ишемическому типу. A. Sharifi-Razavi и соавт. приводят описание 79-летнего пациента, который был госпитализирован в отделение интенсивной терапии с повышением температуры и потерей сознания (оценка по шкале комы Глазго 7 баллов) [24]. Пациент не страдал артериальной гипертензией и не принимал антикоагулянты. Компьютерная томография легких выявила пневмонию с рентгенологическими признаками «матового стекла» в левой нижней доле, а компьютерная томография головного мозга – массивный правосторонний геморрагический инсульт с прорывом крови в желудочки мозга и субарахноидальное пространство (рис. 2) [24]. Диагноз COVID-19 был подтвержден лабораторно.
Анализируя результаты наблюдения пациентов, перенесших SARS-CoV, можно предположить, что в ряде случаев и SARS-CoV, и SARS-CoV-2 сочетаются с поражением периферической нервной системы. Так, L. Tsai и соавт. проанализировали данные 76 пациентов, которые находились в Национальной больнице Тайваньского медицинского университета в связи с SARS-CoV [25]. У четырех пациентов (один мужчина и три женщины, средний возраст 46 лет) через три недели от дебюта заболевания развилось поражение мышц и периферических нервов, которое было расценено как сочетание сенсомоторной полинейропатии и миопатии. Похожее описание дали Z. Sedaghat и соавт. при SARS-CoV-2 [26]. 65-летний мужчина без неврологической патологии в анамнезе поступил в отделение интенсивной терапии с прогрессирующим симметричным восходящим периферическим тетрапарезом и двусторонним парезом лицевого нерва. За две недели до госпитализации у пациента были лихорадка, кашель и одышка. Диагноз COVID-19 был установлен уже в отделении интенсивной терапии на основании положительного результата лабораторных тестов одновременно с синдромом Гийена – Барре.
Таким образом, имеющиеся на сегодняшний день данные позволяют предположить возможность поражения при COVID-19 и центральной, и периферической нервной системы. Наиболее типичное проявление – ишемический инсульт, особенно у пациентов с тяжелым и среднетяжелым течением заболевания и сопутствующей сердечно-сосудистой патологией. Поражение нервной системы реализуется через прямое действие вируса, а также вследствие аутоиммунного поражения нервной системы на фоне цитокинового шторма как следствие гипо- и гиперкоагуляции при обострении имеющейся сердечно-сосудистой патологии или развитии нового заболевания (например, миокардита). Безусловно, ввиду всего пятимесячной заболеваемости COVID-19 делать полноценные выводы о частоте и представленности неврологических проявлений заболевания, равно как и об отсроченных осложнениях, нельзя. Все представленные данные, описанные и обобщенные в настоящей статье, являются предварительными.
I.S. Preobrazhenskaya, PhD, Prof.
I.M. Sechenov First Moscow State Medical University
Contact person: Irina S. Preobrazhenskaya, irinasp2@yandex.ru
The article discusses the neurological manifestations and complications of COVID-19, based on the publication of confirmed disease clinical cases during February – May 2020 in China, the United States and the European Union. It should be noted that due to the recent development of SARS-CoV-2, all data presented should be considered as preliminary ones.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.