Опыт использования комбинации HDAC-ингибитора и анти-PD1-моноклонального антитела при метастатической увеальной меланоме
- Аннотация
- Статья
- Ссылки
- English
Введение
Увеальная меланома – опухоль нейроэктодермального происхождения, возникающая из меланоцитов сосудистой (увеальной) оболочки глаза. Чаще опухоль локализуется в хориоидее (около 80% всех случаев увеальных меланом) [1]. Согласно данным, у 50% пациентов независимо от метода лечения первичной опухоли (энуклеация глаза, лучевая терапия) диагностируется метастатическая болезнь [2]. Как известно, однолетняя выживаемость больных с отдаленными метастазами составляет 15%, а медиана выживаемости колеблется от 4 до 15 месяцев [3–5]. Это обусловлено биологией самой опухоли, а также различными вариантами лечения метастатической формы: от локального лечения метастазов в печени до использования химиотерапевтических препаратов с низкой на сегодняшний день эффективностью.
Несмотря на активное применение ингибиторов BRAF и МЕК, блокаторов иммунного ответа (анти-СTLA4-, анти-PD-моноклональных антител) при диссеминированной меланоме кожи, данные подходы не нашли обоснования при метастатической увеальной меланоме. С одной стороны, это связано с тем, что при меланоме хориоидеи практически не встречаются мутации в гене BRAF [6] и возможности таргетной терапии соответственно ограниченны, с другой – скромные результаты лечения блокаторами иммунного ответа могут быть обусловлены низкой иммуногенностью опухоли [7].
В настоящее время активно изучается группа препаратов под названием HDAC (histone deacetylases, гистоновые деацетилазы), специфические ингибиторы (HDACi). Ожидаются результаты исследования данной группы препаратов при метастатической увеальной меланоме. Описан интересный феномен ингибиторов HDAC в клинических исследованиях in vitro: HDAC-ингибиторы оказывают положительные эффекты на экспрессию раково-тестикулярных антигенов в опухолях у человека [8]. Таким образом повышается иммуногенность опухоли.
В исследовании L.A. Kottschade и соавт. на фоне применения анти-PD1-моноклонального антитела у семи пациентов с метастатической увеальной меланомой, ранее получавших системную терапию, был достигнут один полный и один частичный ответ [8, 9]. С учетом того что это одни из наилучших показателей частоты объективных ответов при системном лечении метастатической увеальной меланомы на сегодня, было принято решение комбинировать ингибитор HDAC с анти-PD1 с целью повышения иммуногенности опухоли и достижения наилучшего ответа на лечение. В России зарегистрирован HDAC-ингибитор препарат вориностат (Золинза®) для лечения Т-клеточной лимфомы кожи.
Клинический случай
У пациентки К., 1970 г.р., в августе 2012 г. была диагностирована меланома хориоидеи левого глаза. В сентябре 2012 г. проведена лучевая терапия (брахитерапия) на ложе опухоли. В апреле 2014 г. из-за роста опухоли выполнена энуклеация левого глаза. В августе 2016 г. пациентка с жалобами на боль в эпигастрии и правом подреберье обратилась к гастроэнтерологу. Эффективность назначенной консервативной терапии оказалась незначительной, болевой синдром сохранялся. При дополнительном обследовании в ноябре 2016 г. обнаружены множественные метастазы в печени. Медиана выживаемости без прогрессирования составила 48 месяцев.
Пациентка обратилась в отделение биотерапии опухолей Национального медицинского исследовательского центра онкологии им. Н.Н. Блохина. С ноября 2016 г. по январь 2017 г. проведено два курса химиотерапии: гемцитабин 1000 мг/м2 и треосульфан 3500 мг/м2 внутривенно, капельно в 1-й и 8-й дни каждого 28-дневного цикла.
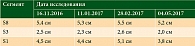
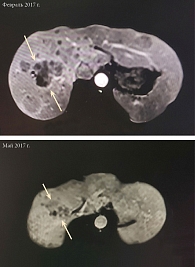
По результатам магнитно-резонансной томографии брюшной полости с внутривенным контрастированием диагностирована стабилизация процесса (таблица). С января по февраль 2017 г. выполнено еще два курса химиотерапии по указанной выше схеме. Отмечалось клиническое прогрессирование – возобновление болевого синдрома в правом подреберье (2-я cтепень (CTC v 4.0)). По данным обследования – незначительный рост контрольных очагов в печени (таблица). Было принято решение о назначении препарата Золинза® в дозе 400 мг/сут в течение 14 дней, курс лечения – 28 дней. В перерыве между первым и вторым циклом проведена иммунотерапия ниволумабом 2 мг/кг каждые две недели. Эффективность оценивали в мае 2017 г. Клинически зафиксировано отсутствие болевого синдрома (на основании критериев RECIST 1.1). Размеры опухоли уменьшились на 20% (таблица, рисунок).
Несмотря на химиорезистентность опухоли, изначально наличие неблагоприятных факторов прогноза (выживаемость без прогрессирования менее трех лет, болевой синдром в правом подреберье, по данным МРТ – увеличение печени в размерах), использование нестандартного подхода – комбинации HDAC-ингибитора и анти-PD1-ингибитора позволило достичь клинического и радиологического ответа на лечение, улучшить качество жизни и увеличить ее продолжительность. В настоящее время пациентка продолжает лечение по данной схеме при сохранном качестве жизни и отсутствии жалоб.
Заключение
Как известно, метастатическая увеальная меланома считается неизлечимой болезнью. Однако использование нестандартных подходов, а также изучение новых комбинаций препаратов может повлиять на увеличение продолжительности жизни пациентов и сохранение ее качества.
V.V. Nazarova, K.V. Orlova, I.A. Utyashev, B.M. Medvedeva, L.V. Demidov
N.N. Blokhin National Medical Research Center of Oncology
Contact person: Valeriya Vitalyevna Nazarova, jezerovel@gmail.com
Until now, there are no universally recognized standards for the treatment of metastatic uveal melanoma. Unsatisfactory results of therapy of patients with metastatic uveal melanoma, the lack of available clinical studies in the Russian Federation significantly poor the prognosis of the disease. In the treatment of metastatic skin melanoma, immune response inhibitors (ipilimumab, nivolumab, pembolizumab) are actively used. Unfortunately, with metastatic uveal melanoma, monotherapy with these drugs has not demonstrated high efficacy. A promising area is the possibility to increase the immunogenicity of the tumor and make it ‘visible’ for immune-oncological drugs.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.