количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
От препаратов порознь к их комбинации
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Кардиология и ангиология" №1 (8)
- Аннотация
- Статья
- Ссылки
В рамках VIII Национального конгресса терапевтов состоялся симпозиум «От препаратов порознь к их комбинации» (Москва, 21 ноября 2013 г.). В представленных докладах профессор Г.П. Арутюнов (Москва) и профессор Д.В. Небиеридзе (Москва) обобщили новые рекомендации по диагностике и лечению артериальной гипертензии (АГ) с акцентом на нефропротекцию и применение комбинированной терапии. Показано, что большинству больных АГ требуется стартовая комбинированная терапия, к преимуществам которой относятся удобство применения, хорошая переносимость, достижение более сильного антигипертензивного и органопротективного эффектов и, следовательно, более значимое улучшение сердечно-сосудистого прогноза и замедление прогрессирования поражения почек. Как один из предпочтительных комбинированных препаратов для лечения АГ, в том числе для нефропротекции, докладчики выделили Корипрен®, объединяющий два препарата с разными механизмами нефропротекции и снижения сердечно-сосудистого риска: лерканидипин – уникальный антагонист кальция, который способен уменьшать внутриклубочковую гипертензию и протеинурию, замедляя прогрессирование хронической болезни почек, и эналаприл – ингибитор ангиотензинпревращающего фермента, который усиливает антигипертензивное и органопротективное свойства и ослабляет побочные эффекты антагониста кальция.

Профессор Г.П. Арутюнов
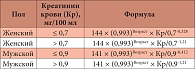
Таблица 1. Расчет скорости клубочковой фильтрации по формуле CKD-EPI (модификация 2011 г.) у пациентов белой расы
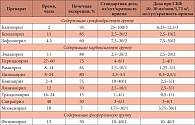
Таблица 2. Фармакокинетические показатели ингибиторов АПФ и стартовые дозы при нормальной и нарушенной функции почек
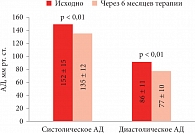
Рис. 1. Снижение артериального давления (АД) на фоне терапии лерканидипином 20 мг/сут у пациентов с протеинурией
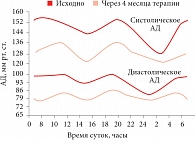
Рис. 2. Дневная и ночная эффективность лерканидипина
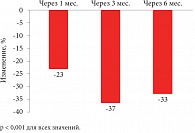
Рис. 3. Снижение показателей протеинурии на фоне терапии лерканидипином 20 мг/сут у пациентов с ХБП

Профессор Д.В. Небиеридзе
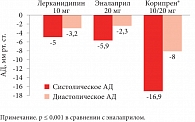
Рис. 4. Гипотензивная эффективность Корипрена в сравнении с монотерапией лерканидипином и эналаприлом

Рис. 5. Частота развития отеков нижних конечностей на фоне терапии Корипреном в сравнении с амлодипином
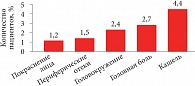
Рис. 6. Частота развития нежелательных реакций на фоне терапии Корипреном 10/20 мг у больных АГ
Органопротекция в лечении артериальной гипертензии. Почки как мишень
Арутюнов Г.П. (проф.)
Проблеме поражения почек и нефропротекции у пациентов с артериальной гипертензией (АГ) был посвящен доклад д.м.н., профессора Григория Павловича АРУТЮНОВА (ФГБУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва). Докладчик выделил несколько групп риска, у которых проблема нефропротекции особенно актуальна: дети, рожденные с массой тела ниже расчетной (у них исходно снижено количество клубочков почек); пациенты с абдоминальной формой ожирения; женщины, пережившие токсикоз второй половины беременности; больные сахарным диабетом, АГ и пациенты с недостаточностью кровообращения. У таких пациентов в почках под действием различных механизмов нарушается динамическое равновесие между образованием и разрушением внеклеточного матрикса, происходит накопление в почечной ткани коллагена, отмечается активная миграция фагоцитов и фибробластов в место повреждения. Почка превращается в орган, который продуцирует системное воспаление и ускоряет развитие атеросклероза. У больного с нелеченой АГ примерно через 13 лет развивается нефросклероз, клубочки запустевают и замещаются рубцовой тканью. Почки так быстро видоизменяются во времени, что терапевт должен поторопиться с нефропротекцией – через 13 лет спасать будет уже нечего.
Говоря о механизмах развития гломерулосклероза, профессор Г.П. Арутюнов выделил роль внутриклубочковой гипертензии. Кровь поступает в клубочек через приносящую артериолу, затем проходит по капиллярам клубочка и уходит через выносящую артериолу, диаметр которой регулируется ангиотензином II. В норме диаметр приносящей артериолы в два раза больше, чем диаметр выносящей артериолы. При избытке ангиотензина II возникает спазм выносящей артериолы, что приводит к внутриклубочковой гипертензии и переполнению капиллярных петель. Петли разрываются и начинают давить на ножки подоцитов. Это меняет их электрический заряд, они перестают отталкивать альбумин, и появляется первый признак поражения почек – микроальбуминурия. Этот прогностический фактор прогрессирующей почечной недостаточности не имеет обратного развития, мы можем только замедлить скорость патологического процесса. Следовательно, важное направление нефропротекции – коррекция внутриклубочковой гипертензии.
Сужение выносящей артериолы вызывает также диффузную ишемию, а затем и фиброз тубулоинтерстиция, атрофию канальцевого эпителия и нарушение выведения натрия. При задержке натрия повышается жесткость сосудистой стенки и растет артериальное давление (АД). Ишемия тубулоинтерстициальной ткани значимо повышает вероятность нарушения мозгового кровообращения. Именно поэтому пациенты, у которых есть ишемия тубулоинтерстиция, нуждаются в нефропротекции.
Не следует также забывать и о возрастном снижении почечной функции. Абсолютное уменьшение количества клубочков начинается с 26-летнего возраста. В клубочках откладывается коллаген, они замещаются соединительной тканью и перестают функционировать. Каждый год здоровый человек теряет 1 мл/мин скорости клубочковой фильтрации (СКФ). Как следствие, в возрасте 25 и 75 лет СКФ различается на
40–50 мл/мин. Таким образом, замедление скорости потери клубочков – главная задача нефропротекции. Отложение коллагена уменьшается при снижении активности ангиотензина II и альдостерона. Депозицию коллагена способны уменьшить несколько классов препаратов: петлевой диуретик торасемид, калийсберегающий диуретик спиронолактон, все ингибиторы ангиотензинпревращающего фермента (АПФ), антагонисты рецепторов ангиотензина II. Косвенно уменьшают депозицию коллагена и бета-адреноблокаторы, подавляя секрецию ренина юкстагломерулярным аппаратом и тем самым снижая синтез альдостерона.
40–50 мл/мин. Таким образом, замедление скорости потери клубочков – главная задача нефропротекции. Отложение коллагена уменьшается при снижении активности ангиотензина II и альдостерона. Депозицию коллагена способны уменьшить несколько классов препаратов: петлевой диуретик торасемид, калийсберегающий диуретик спиронолактон, все ингибиторы ангиотензинпревращающего фермента (АПФ), антагонисты рецепторов ангиотензина II. Косвенно уменьшают депозицию коллагена и бета-адреноблокаторы, подавляя секрецию ренина юкстагломерулярным аппаратом и тем самым снижая синтез альдостерона.
Нефропротекция должна включать в себя контроль массы тела пациента. Абдоминальное ожирение, которое нередко не вызывает тревоги ни у пациента, ни у врача, приводит к гиперактивации рениновой системы. Как следствие, начинается отложение коллагена у внешне здоровых людей. Коллаген откладывается не только в почках, но и в сосудах и миокарде, увеличивает жесткость миокарда, нарушая расслабление и диастолическое наполнение желудочка. Если миокард не может расслабиться, в нем возникают участки ишемии, и развивается застой по малому кругу. Эту ишемию потенцирует тахикардия – пульс больше 72 ударов в минуту сокращает диастолу, миокард недополучает кровь. Как это связано с почками? Тахикардия ухудшает также плазмоток через почку, и возрастает задержка натрия.
В целом ретенция натрия происходит при снижении числа действующих клубочков в почке, ишемизации почки, ее повреждении при нескольких рентгеноконтрастных процедурах и бесконтрольном приеме нестероидных противовоспалительных средств, при высоком АД и др. Задержка натрия повышает жесткость сосудистой стенки, увеличивает отраженную пульсовую волну и еще больше повышает давление в дуге аорты. Следовательно, такой больной имеет высокий риск кровоизлияния в головной мозг, угрозу фибрилляции желудочка, соответственно, нуждается в нефропротекции, поскольку она способна значительно улучшить жизненный прогноз.
Еще одна мишень нефропротекции – недостаточное снижение АД ночью, наблюдающееся при заболеваниях почек. Чем выше АД в ночные часы, тем хуже для почки, тем быстрее почка склерозируется.
При всем многообразии нарушений, состояний и заболеваний, при которых пациент должен быть включен в программу нефропротекции, важно понимать: если почка включилась в патологический процесс, неумолимо будет падать СКФ и неуклонно будет нарастать величина теряемого объема нефронов. Прекратить этот процесс мы не можем, но в наших силах его замедлить. Таким образом, нефропротекция – это замедление падения СКФ и уменьшение экскреции альбумина с мочой.
Для оценки выраженности изменений почки у больного необходимо правильно рассчитать СКФ. Формула Кокрофта – Голта, хотя и не самая точная, но позволяет рассчитать СКФ у постели больного: СКФ = (1,22 (140 - возраст в годах) × масса тела в кг) / креатинин сыворотки в мкмоль/л (для женщин результат умножить на 0,85). Более точную оценку клубочковой фильтрации позволяет сделать формула MDRD (применялась в исследовании Modification of diet in renal disease study), однако расчеты по ней затруднены, так как наряду с сывороточным креатинином необходим ряд биохимических показателей. Самая точная формула для расчета СКФ – CKD-EPI (разработана в ходе выполнения проекта Chronic kidney disease epidemiology collaboration). Сегодня формула CKD-EPI считается обязательной в практике терапевта (табл. 1)[1].
Что дают показатели СКФ для терапевта и кардиолога? При СКФ ниже 60 мл/мин/1,73 м² начинаются самые тяжелые изменения в почке, и пациент имеет очень высокий сердечно-сосудистый риск. При СКФ 40 мл/мин/1,73 м² терапевт должен уточнить, какие ингибиторы АПФ принимает больной, поскольку только три ингибитора АПФ минимально выводятся через почки: трандолаприл (на 15–33%), спираприл (на 15–50%) и фозиноприл (на 50%). Перед врачом стоит задача: либо менять ингибитор АПФ, либо уменьшать дозу того ингибитора, который пациент получает. СКФ, равная
30 мл/мин/1,73 м², – это тяжелая ситуация, когда функция почек снижена существенно; такой больной должен уменьшить дозу потребляемого белка. СКФ
15 мл/мин/1,73 м² означает, что больной не сможет жить без гемодиализа. Знание СКФ позволяет установить стадию хронической болезни почек (ХБП) у больного. В новых клинических рекомендациях по диагностике, классификации и лечению ХБП, разработанных в 2013 г. группой KDIGO (Kidney Diseases: Improving Global Outcomes), выделено 5 стадий ХБП в соответствии с СКФ. Например, стадия С3 определяется при СКФ ниже 60 мл/мин/1,73 м²; С3а означает, что СКФ ниже 60 мл/мин/1,73 м², но все еще выше 44 мл/мин/1,73 м², а С3б говорит о том, что уровень СКФ находится в диапазоне от 44 до 30 мл/мин/1,73 м². Терапевт в основном работает с больными, имеющими СКФ от 60 мл/мин/1,73 м² до 30 мл/мин/1,73 м². При значении СКФ 30 мл/мин/1,73 м² к лечению больного должен подключиться нефролог. Проводя нефропротекцию, врач также должен определить тип и выраженность протеинурии у больного. Новая классификация ХБП выделяет 3 стадии альбуминурии в зависимости от ее выраженности: А1 – при суточной экскреции альбумина с мочой < 30 мг/сут, А2 – 30–300 мг/сут и А3 – ≥ 300 мг/сут.
Терапевт должен знать два главных положения нефропротекции: если у больного уровень теряемого белка больше 30 мг/сут (то есть при ХБП с протеинурией А2–А3 степени), в терапию нужно обязательно включать ингибиторы АПФ или сартаны даже в отсутствие АГ; если у больного СКФ ниже 60 мл/мин/1,73 м², его также необходимо лечить ингибиторами АПФ или сартанами пожизненно. Поскольку эти препараты оказывают антипротеинурическое и ренопротективное действие, они представляют собой основу нефропротекции.
Профессор Г.П. Арутюнов представил результаты нескольких исследований, в которых изучали нефропротекцию у больных с недиабетическим нарушением функции почек. В исследовании AASK (African American study of kidney disease and hypertension) проверяли гипотезу об эффективности терапевтической стратегии жесткого контроля АД как метода нефропротекции, а также изучали сравнительную нефропротективную эффективность трех классов препаратов (бета-адреноблокатор, ингибитор АПФ и антагонист кальция). Выяснилось, что очень жесткий контроль давления у афроамериканцев не приводил к защите почки, а из трех классов препаратов самыми эффективными были ингибиторы АПФ. В ходе исследования COOPERATE (Combination treatment of angiotensin-II receptor blocker and angiotensin-converting-enzyme inhibitor in non-diabetic renal disease) изучали комбинацию ингибитора АПФ с сартанами. Был получен неожиданный результат: добавление лозартана к трандолаприлу значимо повышало нефропротективный эффект этого ингибитора АПФ. Однако позже эти результаты исследования COOPERATE были признаны ошибочными, и сегодня комбинация ингибитора АПФ и сартана в нефропротекции считается опасной. В исследовании ESPRILE (Effects of antihypertensive treatment on progression of renal insufficiency) был поставлен вопрос об эффективности антагонистов кальция, исследователи сравнили нифедипин (таблетку GITS) с фозиноприлом. Ингибитор АПФ опять оказался победителем в самом широком диапазоне колебаний уровня креатинина. Позже в исследовании NEPHROS (Renoprotective effect of ACE inhibition in chronic renal disease) оценили эффективность фелодипина (на тот момент этот препарат имел самое высокое сродство к сосудистой стенке, сегодня таковым является лерканидипин) у больных с очень высоким уровнем экскреции альбумина с мочой. Оказалось, что препарат сравнения рамиприл эффективнее фозиноприла. Таким образом, в ходе ряда крупных исследований у больных с ХБП недиабетического генеза была показана высокая эффективность ингибиторов АПФ при любом уровне креатинина и при любом уровне теряемого белка, дополнительное назначение антагониста кальция не усиливало антипротеинурического эффекта.
Было проведено несколько исследований, в которых изучали нефропротекцию при сахарном диабете. Так, результаты исследований IDNT (Irbesartan diabetic nephropathy trial) и IRMA-2 (Irbesartan microalbuminuria Type 2 diabetic study) доказали независимый от антигипертензивного нефропротективный эффект сартанов. Как показали данные исследования NESTOR (Natrilix SR versus enalapril study in hypertensive Type 2 diabetics with microalbuminuria), хорошо известный мочегонный препарат с вазодилатирующим действием индапамид оказался значимым нефропротектором, индапамид переиграл эналаприл в борьбе с гипертрофией левого желудочка, а также продемонстрировал способность понижать уровень теряемого белка.
Самым крупным исследованием, которое поставило точку в общепринятой на данный момент концепции нефропротекции, стало исследование MDRD. Авторы задались вопросами: спасет ли почку жесткий контроль АД у пациента европеоидной расы и какие из классов препаратов окажутся самыми эффективными. Выяснилось, что в отличие от афроамериканцев у пациентов белой расы жесткий контроль АД приводил к снижению уровня экскреции альбумина с мочой, замедлял прогрессирование нефропатии, а наибольшую эффективность продемонстрировали ингибиторы АПФ. Последним крупным исследованием стало ROADMAP (Randomized olmesartan and diabetes microalbuminuria prevention) с применением олмесартана у больных сахарным диабетом до дебюта микроальбуминурии, в ходе которого было показано, что этот препарат может приостановить патологический процесс в почках.
Таким образом, препаратами выбора для нефропротекции являются ингибиторы АПФ или сартаны. Перечисленные выше исследования определили стратегию выбора доз разных препаратов – ингибиторов АПФ в зависимости от СКФ в начале лечения (табл. 2). Как подчеркнул докладчик, нельзя начинать лечение, не зная СКФ, поскольку стартовая доза препарата рассчитывается в зависимости от этого показателя. Самая сложная ситуация для терапевта при СКФ ниже 30 мл/мин/1,73 м². У таких больных начальные дозы большинства ингибиторов АПФ, как и сартанов, должны быть снижены.
Профессор Г.П. Арутюнов затронул такой спорный аспект нефропротекции, как назначение статинов. В ряде исследований было показано, что статины способствуют снижению уровня альбумина, теряемого почками. Однако это происходит при достижении уровня липопротеинов низкой плотности ниже 1,8 ммоль/л. Это уникальная цифра в современной кардиологии, уровень новорожденного ребенка; достижение его у взрослого замедляет коронарный атеросклероз и радикально сказывается на функции почки, оказывая протективное действие на клубочек и сосуды почки.
Еще одна неоднозначная ситуация – место антагонистов кальция в нефропротективной терапии. Антагонисты кальция расширяют выносящую артериолу и улучшают отток, не приводя к еще большему скоплению крови в клубочках. Верапамил, первый из антагонистов кальция, до сих пор применяют в нефропротекции. Он обладает уникальным свойством оказывать влияние на разные сосуды почек, расширяет выносящие артериолы и уменьшает давление внутри клубочка. Антагонисты кальция представляют собой гетерогенную группу препаратов, в зависимости от химического строения выделяют неорганические антагонисты (ионы магния), фенилалкиламины (верапамил), бензодиазепины (дилтиазем) и дигидропиридины. На сегодняшний день из всех дигидропиридинов только три препарата имеют значение в клинике внутренних болезней: амлодипин, лацидипин и лерканидипин. Из них только лерканидипин обладает способностью открывать преимущественно выносящие артерии почек, благодаря чему происходит быстрое падение давления внутри клубочков. Следовательно, лерканидипин можно рассматривать как предпочтительный препарат для контроля АД у пациентов, нуждающихся в нефропротекции (рис. 1)[2].
Все антагонисты кальция блокируют открытие медленных кальциевых каналов (L-типа), ингибируют поступление ионов кальция в клетку, снижают скорость деполяризации и проведения по проводящим путям, уменьшают способность миокарда развивать механическое напряжение. Они расширяют коронарные артерии и увеличивают кровоснабжение миокарда. Особенность химической структуры лерканидипина – в наличии липофильной «якорной группы», он прочно связывается с липофильной мембраной клеток и очень долго поддерживает связь с кальциевым каналом. Это означает, что лерканидипин обладает, во-первых, выраженным сродством к сосудистой стенке, а не к кардиомиоцитам, и, расширяя сосуды, не уменьшает сократительную способность миокарда, и, во-вторых, стабильным и постоянным эффектом. Уникальность лерканидипина для нефропротекции в том, что препарат расширяет выносящую артерию и снижает давление в клубочке. Когда лерканидипин связывается с кальциевым каналом, поступление кальция в клетку уменьшается. Это способствует ослаблению жесткости миокарда, увеличению коронарного кровотока, расширению сосудов на периферии и уменьшению работы левого желудочка. Такие свойства лерканидипина, как вазоселективность, высокая липофильность, плавный, но постоянный эффект в контроле коронарного сопротивления и коронарного кровотока, снижение АД, снижение давления внутри клубочка, делают его препаратом выбора для нефропротекции.
Лерканидипин выводится примерно в равных пропорциях печенью и почками, поэтому при выраженной патологии почки удар принимает печень, а при выраженной патологии печени с экскрецией легко справляются почки. Еще одна важная особенность лерканидипина – длительность эффекта, которая позволяет при однократном приеме предотвращать раннее утреннее повышение АД и защитить больного от кровоизлияния в мозг утром (рис. 2)[3].
При применении лерканидипина почечный кровоток возрастает, снижается давление в клубочках, а в отсутствие внутриклубочковой гипертензии нет и воспаления сосудистой стенки, как и склерозирования клубочка. Профессор Г.П. Арутюнов подчеркнул, что лерканидипин – единственный из дигидропиридинов, способный снижать уровень протеинурии при ХБП
(рис. 3)[2].
(рис. 3)[2].
Обобщая представленные данные, профессор Г.П. Арутюнов отметил, что нефропротекция должна включать раннее назначение базовых препаратов – ингибиторов АПФ и сартанов, элиминацию такого фактора риска, как абдоминальное ожирение, и контроль АД. При недостаточной эффективности этих мероприятий он рекомендовал присоединение лерканидипина – единственного дигидропиридинового антагониста кальция, который снижает давление внутри капилляров клубочков почек и мощно уменьшает выраженность протеинурии, то есть обладает реальным нефропротективным эффектом. Существует удобная комбинация лерканидипина с эналаприлом (препарат Корипрен®), объединяющая два механизма нефропротекции. Эффективность нефропротекции оценивают по уровню теряемого белка, а также по АД, в первую очередь по уровню ночного АД. При эффективной нефропротекции микроальбуминурия должна снижаться к концу 12-й недели, то есть третий месяц регулярной терапии определяет дальнейший прогноз пациента.
Актуальные вопросы диагностики и лечения артериальной гипертензии в свете современных рекомендаций
Небиеридзе Д.В. (проф.)
За последнее время произошли важные изменения в рекомендациях по ведению больных АГ. Так, в 2013 г. принята очередная версия европейских рекомендаций[4], некоторые положения этого документа будут учтены и в российских рекомендациях по АГ. Д.м.н., профессор Давид Васильевич НЕБИЕРИДЗЕ (ФГБУ «Государственный научно-исследовательский центр профилактической медицины» Минздрава России, Москва) ознакомил врачей с новыми положениями европейского документа, представляющими большой практический интерес.
Врач ставит диагноз АГ на основании хотя бы двух визитов, но теперь для подтверждения диагноза АГ необходимо дополнительное измерение АД вне клиники. Измерение АД самими пациентами и суточное мониторирование АД рассматриваются как равноценные возможности для того, чтобы подтвердить или опровергнуть диагноз АГ. Особенно это касается ситуаций, когда необходимо исключить так называемую гипертонию белого халата или, наоборот, выявить замаскированную АГ. Последняя опасна для пациента тем, что на приеме у врача определяется высокое нормальное или даже нормальное АД, но при этом уже есть поражения органов-мишеней. Главное, как подчеркнул профессор Д.В. Небиеридзе, с одной стороны, не завысить диагностику АГ, а с другой – не пропустить заболевание.
Мы прекрасно знаем, что на каждого гипертоника следует собрать максимум информации – выявить факторы риска, наличие поражения органов-мишеней, сопутствующие сердечно-сосудистые заболевания. Особое значение в новых европейских рекомендациях придается обнаружению латентных поражений органов-мишеней: гипертрофии левого желудочка, субклинического атеросклероза магистральных сосудов, почечных маркеров, низкой СКФ, микроальбуминурии. Однако в реальной клинической практике только 12% врачей собирают всю необходимую информацию по факторам риска, и только треть врачей назначают все необходимые мероприятия, направленные на выявление поражения органов-мишеней. Вывод простой – пациенты недообследуются, следовательно, мы неправильно определяем риски. Как показывают специальные исследования, если активно обследовать пациентов, даже тех, которые впервые обратились к врачу по поводу повышенного АД, субклинические поражения органов-мишеней удается обнаружить у преобладающего большинства. Одно из таких исследований, проведенное под руководством профессора С.А. Бойцова, показало, что при дуплексном сканировании сонных артерий атеросклеротические бляшки выявляются у 60% амбулаторных больных низкого и среднего риска по шкале SCORE (Systematic coronary risk evaluation). Больные АГ не сразу обращаются к врачу, и за это время происходит вовлечение органов-мишеней в патологический процесс. В европейских рекомендациях 2013 г. указывается на то, что даже если пациент попадает в группу среднего риска при оценке по шкале SCORE и даже если у пациента нет клинических проявлений атеросклероза и неосложненной АГ, в любом случае нужно активно искать поражение органов-мишеней. При этом очень большое значение придается эхокардиографическому измерению, определению микроальбуминурии и оценке толщины комплекса интима-медиа или субклинического атеросклероза сонных артерий. Именно поэтому стандарт обследования пациентов с АГ, помимо программы минимум, рекомендуется дополнить определением микроальбуминурии (тест-полоска, при положительном результате – количественное определение), эхокардиографическим и ультразвуковым исследованием сонных артерий. Эти диагностические мероприятия позволят наиболее полно выявить поражение органов-мишеней и максимально точно произвести оценку группы риска, от которой зависит выбор алгоритма ведения пациента. Если мы отнесли пациентов к группе высокого или очень высокого риска, мы по определению должны назначить медикаментозное лечение. Если пациент попадает в группу среднего или низкого риска, сначала идут рекомендации по здоровому образу жизни и только потом медикаментозное лечение. В случае «пропуска» поражения органа-мишени мы тем самым переводим больного в группу среднего и низкого риска, а значит, теряем время, не назначаем препараты и ухудшаем его прогноз. Таким образом, как отметил профессор
Д.В. Небиеридзе, полноценное обследование пациентов – необходимое условие адекватного лечения.
Стратегия ведения пациентов с АГ предполагает достижение целевого уровня АД. Но очень важно не просто снизить давление, а максимально уменьшить сердечно-сосудистый риск, то есть необходимо корригировать все сопутствующие факторы риска. В этой связи особое значение придается органопротекции. А поскольку у пациентов обычно уже есть поражение органов-мишеней, следует подобрать такие препараты, которые обладают органопротективными эффектами.
В последней версии европейских рекомендаций даны дифференцированные значения целевого АД. Напомним, в российских рекомендациях предложено достигать АД в пределах 140/90 мм рт. ст., и если пациент хорошо переносит этот уровень АД, мы идем на его дальнейшее снижение до 130–139/80–89 мм рт. ст. Но врачи, особенно неврологи, опасаются такого интенсивного снижения АД. Когда европейские эксперты проанализировали данные многочисленных исследований, оказалось, что достижения уровня систолического АД менее 140 мм рт. ст. и диастолического менее 90 мм рт. ст. достаточно для того, чтобы получить максимальное снижение сердечно-сосудистого риска для большинства больных. Единственное исключение делается для пациентов с сахарным диабетом, у которых при достижении диастолического АД 80 мм рт. ст. и ниже уменьшение сердечно-сосудистого риска будет более выраженным, чем при 90 мм рт. ст. Таким образом, новые европейские рекомендации определяют целевое АД для большинства пациентов 140/90 мм рт. ст. и ниже, а для пациентов с сахарным диабетом – систолическое – 140, а диастолическое АД – 85, 80 и ниже. При этом у большинства пациентов, за исключением больных сахарным диабетом, интенсивно снижать АД не нужно.
Часто поднимается вопрос о целевом уровне АД у пожилых больных. В европейских рекомендациях 2013 г. по этому поводу сказано, что лечение пожилых пациентов необходимо начинать при систолическом АД выше 160 мм рт. ст. (в отличие от более молодых пациентов, когда мы можем начинать лечение, если систолическое АД больше 140 мм рт. ст.). С учетом доказательной базы эксперты рекомендуют более осторожный подход к снижению АД у пожилых больных с достижением целевого уровня в пределах 140–150 мм рт. ст. Опять же делается оговорка, что, если пациенты хорошо переносят лечение, его можно начинать и при систолическом АД больше 140 мм рт. ст. с достижением целевых уровней АД, как и у более молодых пациентов.
Рассматривая вопросы коррекции факторов риска, направленной на то, чтобы в сочетании с медикаментозным лечением получить максимальное снижение сердечно-сосудистого риска, профессор Д.В. Небиеридзе подчеркнул, что отказ от курения даже более значим для жизненного прогноза, чем прием, например, аспирина, бета-адреноблокаторов и статинов.
Особо профессор Д.В. Небиеридзе выделил важность органопротекции при лечении АГ. Специальный анализ, проведенный у пациентов с гипертрофией левого желудочка, показал, что лечение препаратами, которые обеспечивают регресс гипертрофии, дает дополнительное трехкратное снижение сердечно-сосудистого риска по сравнению с эффектом лечения препаратами, которые только снижают АД[5]. Эти данные доказывают: кардиопротекция имеет самостоятельное значение. То же самое можно сказать в отношении нефропротекции. В крупномасштабном международном проспективном рандомизированном двойном слепом исследовании LIFE (Losartan intervention for endpoint reduction in hypertension) было показано, что любая степень снижения микроальбуминурии приводит к дополнительному уменьшению сердечно-сосудистого риска[6]. Наиболее выраженными органопротективными эффектами обладают 3 класса препаратов: блокаторы рецепторов ангиотензина II, ингибиторы АПФ, антагонисты кальция, каждый из которых имеет свою специфику. Например, антагонисты кальция больше известны как препараты с вазопротективным эффектом; есть доказательства того, что они тормозят прогрессирование атеросклероза. А ингибиторы АПФ и блокаторы рецепторов ангиотензина II больше известны как кардиопротекторы и нефропротекторы.
Пациенты с высоким риском, а это большинство больных, требуют стартовой комбинированной терапии двумя антигипертензивными препаратами. Этот вид терапии является основой быстрого достижения целевого уровня АД, что благоприятно влияет на прогноз. Рациональные комбинации препаратов в зависимости от показаний к их назначению представлены в российских рекомендациях[7]. Однако если исходить из того, что нам важно не просто достичь целевых уровней АД, но еще получить и органопротективные эффекты, то наиболее предпочтительными в этом отношении, по мнению докладчика, являются комбинации ингибиторов АПФ и антагонистов кальция, блокаторов рецепторов ангиотензина II и антагонистов кальция, так как препараты в составе таких комбинаций усиливают эффекты друг друга.
В стратегии комбинированной терапии важны фиксированные комбинации – они удобны и для врача, и для пациента, поскольку характеризуются простотой назначения и титрования дозы, благодаря чему повышается приверженность пациентов лечению. Назначение препарата в форме фиксированной комбинации гарантированно ограждает врача от выбора нерациональной комбинации. Кроме того, по сравнению со свободной комбинацией 2 препаратов комбинированные препараты имеют фармакоэкономические преимущества, а также обладают способностью не только потенцировать антигипертензивный эффект, но и уменьшать частоту побочных эффектов отдельных препаратов, входящих в состав комбинации.
Среди фиксированных комбинаций для лечения эссенциальной гипертензии профессор Д.В. Небиеридзе выделил препарат Корипрен®, в состав которого входит антагонист кальция третьего поколения лерканидипин и ингибитор АПФ эналаприл. Препарат выпускается в двух дозах: 10/10 мг (назначается при неэффективности монотерапии лерканидипином 10 мг) и 10/20 мг (при неэффективности монотерапии эналаприлом 20 мг). Благодаря уникальному механизму действия препарата, который проникает в мембрану клеток, накапливается в ней и плотно и длительно связывается кальциевыми каналами, лерканидипин в отличие от других антагонистов кальция дает меньше таких побочных эффектов, как тахикардия, отеки, покраснение лица, головная боль и проч.[8] Кроме того, такой механизм действия обеспечивает плавное начало и длительность действия препарата, постепенно нарастающий антигипертензивный эффект[9]. Когда в одной комбинации объединяются антагонист кальция и ингибитор АПФ, это означает, с одной стороны, усиление антигипертензивного эффекта, а с другой – органопротективного эффекта. Так, в двойном слепом плацебоконтролируемом исследовании у пожилых пациентов было показано, что Корипрен® эффективнее снижает систолическое и диастолическое АД по сравнению с монотерапией препаратами, входящими в состав комбинации (рис. 4)[10]. Присутствие ингибитора АПФ в такой комбинации существенно снижает риск развития побочных эффектов, в частности отеков лодыжек, из-за разных механизмов влияния на прекапиллярные и посткапиллярные русла (рис. 5). В целом Корипрен® характеризуется благоприятным профилем безопасности (рис. 6)[11].
Что касается других возможных комбинаций антигипертензивных препаратов, профессор Д.В. Небиеридзе предостерег от использования комбинации ингибиторов АПФ и блокаторов рецепторов ангиотензина II, которая одно время считалась перспективной для нефропротекции. В последней версии европейских рекомендаций сказано, что такая комбинация повышает риск развития терминальной почечной недостаточности и оба класса препаратов повышают уровень калия и креатинина.
В заключение профессор Д.В. Небиеридзе отметил, что в европейских рекомендациях 2013 г. основные положения по ведению больных АГ, пусть с небольшой коррекцией, остаются прежними. Для объективной диагностики АГ и выбора адекватной лечебной тактики первоочередное значение имеет полнота обследования пациента, особенно в отношении выявления поражения органов-мишеней. Чтобы добиться конечной цели лечения АГ, то есть максимально снизить сердечно-сосудистый риск, необходима интеграция медикаментозного и немедикаментозного подходов: современной фармакотерапии с рекомендациями по здоровому образу жизни. Выбор лекарственных препаратов зависит от конкретной клинической ситуации, но преимущество имеют препараты, которые оказывают органопротективный эффект. При этом нужно учитывать, что большинство наших пациентов являются кандидатами на стартовую комбинированную терапию, в рамках которой предпочтение следует отдавать фиксированным комбинациям (например, препарату Корипрен®).
1. Levey A.S., Stevens L.A., Schmid C.H. et al. A new equation to estimate glomerular filtration rate // Ann. Intern. Med. 2009. Vol. 150. № 9. P. 604–612.
2. Robles N.R., Romero B., de Vinuesa E.G. et al. Treatment of proteinuria with lercanidipine associated with renin-angiotensin axis-blocking drugs // Ren. Fail. 2010. Vol. 32. № 2. P. 192–197.
3. Macchiarulo C., Pieri R., Mitolo D.C. et al. Antihypertensive effects of six calcium antagonists: evidence from Fourier analysis of 24-hour ambulatory blood pressure recordings // Curr. Ther. Res. 2001. Vol. 62. № 4. P. 236–253.
4. Mancia G., Fagard R., Narkiewicz K. et al. 2013 ESH/ESC Guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // J. Hypertens. 2013. Vol. 31. № 7. P. 1281–1357.
5. Verdecchia P., Schillaci G., Borgioni C. et al. Prognostic significance of serial changes in left ventricular mass in essential hypertension // Circulation. 1998. Vol. 97. № 1. P. 48–54.
6. Ibsen H., Olsen M.H., Wachtell K. et al. Reduction in albuminuria translates to reduction in cardiovascular events in hypertensive patients: losartan intervention for endpoint reduction in hypertension study // Hypertension. 2005. Vol. 45. № 2. P. 198–202.
7. Диагностика и лечение артериальной гипертензии. Российские рекомендации (четвертый пересмотр) // Системные гипертензии. 2010. № 3. С. 5–26.
8. Borghi С., Prandin M.G., Dormi A. et al. The use of lercanidipine can improve the individual tolerability in dihydropyridine calcium blockers in hypertensive patients // J. Hypertens. 2000. Vol. 18. Suppl. 2. P. S155–S156.
9. Herbette L.G., Vecchiarelli M., Leonardi A. Lercanidipine: short plasma half-life, long duration of action // J. Cardiovascul. Pharmacol. 1997. Vol. 29. Suppl. 1. P. S19–S24.
10. Jamerson K.A., Bakris G.L., Wun C.C. et al. Rationale and design of the avoiding cardiovascular events through combination therapy in patients living with systolic hypertension (ACCOMPLISH) trial: the first randomized controlled trial to compare the clinical outcome effects of first-line combination therapies in hypertension // Am. J. Hypertens. 2004. Vol. 17. № 9. P. 793–801.
11. Puig J.G., Calvo C., Luurila O. et al. Lercanidipine, enalapril and their combination in the treatment of elderly hypertensive patients: placebo-controlled, randomized, crossover study with four ABPM // J. Hum. Hypertens. 2007. Vol. 21. № 12. P. 917–924.
Новости на тему
20.10.2021
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.