Оценка эффективности и безопасности биологически активной добавки к пище Гастрокур в комбинации с пантопразолом у больных с Helicobacter pylori
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Десять пациентов с подтвержденной по данным 13С-уреазного дыхательного теста инфекцией H. pylori в течение четырех недель получали биологически активную добавку Гастрокур по две капсулы три раза в день в комбинации с пантопразолом 40 мг один раз в день. Особым условием было соблюдение температурного режима хранения Гастрокура от +4 до +10 °С. Эффективность эрадикации оценивали с помощью 13С-уреазного дыхательного теста через 30 дней после завершения лечения.
Результаты. Эрадикация H. pylori была достигнута у двух из 10 (20%) пациентов по критерию ITT и у двух из девяти (22,2%) пациентов по критерию PP. К 14-му дню терапии у 80% пациентов полностью были купированы симптомы диспепсии с сохранением эффекта в течение месяца после окончания терапии. В течение первых двух недель терапии у трех пациентов отмечалось вздутие живота, у пяти – кашицеобразный стул не чаще трех раз в день. Эти явления были невыраженными и не потребовали прерывания лечения. Один пациент выбыл из исследования в связи с обострением розового лишая на 21-й день приема терапии, самостоятельно прошедшим через два дня после прекращения лечения.
Заключение. Курс терапии биологически активной добавкой к пище Гастрокур в комбинации с пантопразолом привел к эрадикации H. pylori в 20% случаев. На фоне терапии наблюдалась положительная клиническая динамика. Не зарегистрировано серьезных нежелательных явлений, за исключением обострения розового лишая у одного пациента.
Материал и методы. Десять пациентов с подтвержденной по данным 13С-уреазного дыхательного теста инфекцией H. pylori в течение четырех недель получали биологически активную добавку Гастрокур по две капсулы три раза в день в комбинации с пантопразолом 40 мг один раз в день. Особым условием было соблюдение температурного режима хранения Гастрокура от +4 до +10 °С. Эффективность эрадикации оценивали с помощью 13С-уреазного дыхательного теста через 30 дней после завершения лечения.
Результаты. Эрадикация H. pylori была достигнута у двух из 10 (20%) пациентов по критерию ITT и у двух из девяти (22,2%) пациентов по критерию PP. К 14-му дню терапии у 80% пациентов полностью были купированы симптомы диспепсии с сохранением эффекта в течение месяца после окончания терапии. В течение первых двух недель терапии у трех пациентов отмечалось вздутие живота, у пяти – кашицеобразный стул не чаще трех раз в день. Эти явления были невыраженными и не потребовали прерывания лечения. Один пациент выбыл из исследования в связи с обострением розового лишая на 21-й день приема терапии, самостоятельно прошедшим через два дня после прекращения лечения.
Заключение. Курс терапии биологически активной добавкой к пище Гастрокур в комбинации с пантопразолом привел к эрадикации H. pylori в 20% случаев. На фоне терапии наблюдалась положительная клиническая динамика. Не зарегистрировано серьезных нежелательных явлений, за исключением обострения розового лишая у одного пациента.
Введение
Helicobacter pylori (H. pylori) – широко распространенная инфекция [1], вызывающая гастрит у всех инфицированных, на фоне которого могут развиваться язвенная болезнь, MALT-лимфома и рак желудка [2, 3]. С H. pylori ассоциирован также ряд заболеваний, таких как идиопатическая тромбоцитопеническая пурпура, В12- и железодефицитная анемия [4, 5]. Эрадикация H. pylori является основным терапевтическим подходом в лечении инфицированных лиц и способна предотвратить развитие данных заболеваний [3].
Длительное время для эрадикации H. pylori применяется антибактериальная терапия, прежде всего стандартная тройная с использованием ингибитора протонной помпы, кларитромицина и амоксициллина или метронидазола [6]. Однако эффективность этих схем в последние годы снизилась до неприемлемых показателей ниже 80% [7, 8], что связано с формированием устойчивости H. pylori к основным антибиотикам [9, 10].
Утрата эффективности традиционных схем эрадикации H. pylori повысила актуальность поиска новых и альтернативных схем лечения инфекции, в том числе без применения антибиотиков. Были проведены исследования пробиотиков для монотерапии H. pylori [11–14]. Комбинации некоторых штаммов пробиотиков со стандартными режимами терапии продемонстрировали способность повышать уровень эрадикации H. pylori, в основном за счет уменьшения частоты и выраженности побочных эффектов антибактериальных препаратов [15–17].
В клинических исследованиях H. pylori было показано, что некоторые компоненты пищевых продуктов могут проявлять ингибирующую активность в отношении роста этой бактерии in vitro и in vivo [18]. Рядом авторов опубликованы данные об эффективности лекарственных средств растительного происхождения для лечения инфекции H. pylori. Было показано, что изотиоцианат сульфорафан (SF), который в изобилии содержится в ростках брокколи, обладает сильным бактерицидным действием против H. pylori. Ежедневное употребление ростков брокколи способствует снижению бактериальной колонизации желудка, ослаблению экспрессии фактора некроза опухоли альфа (ФНО-α) и интерлейкина (ИЛ) 1β в слизистой оболочке, уменьшает воспаление и, вероятно, предотвращает появление атрофии [19]. В большинстве случаев молекулярный механизм действия активных ингредиентов растительных экстрактов в отношении H. pylori неизвестен. В качестве возможных обсуждаются ингибирование фермента уреазы, разрушение клеточной мембраны бактерий и модуляция иммунной системы человека [20].
В недавно опубликованном критическом обзоре B. Salehi и соавт. проанализированы данные об экстрактах растений и изолированных биологически активных соединениях растительного происхождения, используемых в качестве средств против инфекции H. pylori [21]. В ряде исследований продемонстрировано, что метанольные и ацетоновые экстракты некоторых лекарственных растений способны ингибировать активность уреазы. Такие экстракты содержатся в цветках Acacia nilotica, листьях и цветках Calotropis procera, плодах Casuarina equisetifolia [22], цветках Chamomilla recutita [23], экстракте коры Euphorbia umbellata [24], водном экстракте цветков Peumus boldus [25]. Некоторые растительные экстракты обладают антимикробной активностью в отношении H. pylori: Agrimonia eupatoria, Hydrastis canadensis, Filipendula ulmaria и Salvia officinalis [26]. Был продемонстрирован эквивалентный ампициллину антибактериальный потенциал экстракта корня пиона молочноцветкового, который привел к ингибированию колонизации H. pylori [27].
В качестве перспективной для лечения инфекции H. pylori рассматривается биологически активная добавка (БАД) на основе дигидрокверцетина и индол-3-карбинола Гастрокур (свидетельство о государственной регистрации № RU.77.99.88.003.E.002249.06.19 от 28.06.2019). Дигидрокверцетин, известный также как таксифолин, относится к антиоксидантам натурального происхождения, или биофлавоноидам. Содержится в большом количестве в коре сибирской лиственницы или даурской лиственницы [28], в семенах Mimusops balata [29]. Богатый таксифолином экстракт из шелухи коры лиственницы был недавно одобрен в качестве нового безопасного пищевого ингредиента в нескольких категориях пищевых продуктов и пищевых добавок [28]. В исследованиях in vitro таксифолин демонстрирует антиоксидантные, противораковые, антимикробные, антиальцгеймеровские, гепатопротекторные и кардиопротекторные свойства [30]. Экспериментальные исследования in vitro показали, что таксифолин ингибирует гидроксильный радикал (OH•) в клетке и защищает ДНК от окислительного повреждения, проявляя антиоксидантную активность [31]. Таксифолин, выделенный из семян Mimusops balata, произрастающего в Бразилии, продемонстрировал гастропротекторное действие in vitro со снижением активности протонных помп на 41% [32]. В исследовании на модели ишемического реперфузионного повреждения желудка у мышей была продемонстрирована антиоксидантная активность таксифолина, обусловленная его способностью предотвращать снижение уровня глутатиона в ткани желудка [33].
Индол-3-карбинол – фитохимическое вещество, содержащееся в овощах семейства крестоцветных, проявляет несколько видов биологической активности на клеточном и молекулярном уровнях. В настоящее время признано, что индол-3-карбинол обладает антипролиферативным потенциалом [34]. Результаты клинических исследований свидетельствуют также о его роли в профилактике хронических заболеваний [35].
На базе Московского клинического научно-практического центра (МКНЦ) им. А.С. Логинова было проведено пилотное клиническое исследование, целью которого явилась оценка эффективности и безопасности четырехнедельного приема биологически активной добавки к пище Гастрокур в комбинации с пантопразолом у больных с H. pylori.
Основные задачи исследования:
- оценить динамику клинических симптомов заболевания и лабораторных показателей у пациентов с выявленной инфекцией H. pylori;
- изучить частоту эрадикации H. pylori;
- оценить частоту нежелательных явлений при комбинированной терапии БАД Гастрокур и пантопразолом.
Исследование одобрено решением локального комитета по этике при МКНЦ им. А.С. Логинова № 2/2020 от 17.02.2020 и № 4/2021 от 21.04.2021.
Материал и методы
В исследовании принимали участие пациенты в возрасте от 18 до 60 лет с подтвержденной с помощью 13C-уреазного дыхательного теста (13С-УДТ) инфекцией H. pylori, подписавшие информированное согласие, одобренное локальным этическим комитетом при МКНЦ им. А.С. Логинова.
Критерии невключения:
- больные с эрозивно-язвенными поражениями пищевода, желудка и двенадцатиперстной кишки;
- больные, принимавшие антибиотики, ингибиторы протонной помпы, висмутсодержащие препараты в течение 30 дней до визита;
- наличие новообразований желудочно-кишечного тракта;
- наличие клинически значимых аллергических реакций в анамнезе;
- наличие тяжелых клинически значимых неврологических, сердечно-сосудистых, желудочно-кишечных, печеночных, почечных, иммунных и прочих заболеваний в анамнезе;
- психические заболевания, в том числе ранее перенесенные, которые, по мнению исследователя, делают неприемлемым участие пациента в исследовании;
- беременность и период лактации;
- пациенты, склонные к отказу от исследования и выполнения предписаний врача;
- отказ пациента дать информированное согласие на участие в исследовании или на выполнение требований исследования.
Из исследования были исключены больные, отказавшиеся от дальнейшего обследования и терапии при ухудшении объективных показателей состояния больного, а также при появлении заболеваний, требующих приема препаратов, которые могут повлиять на оценку эффективности терапии (антибиотики, висмутсодержащие препараты), и при возникновении серьезных нежелательных явлений.
Дизайн исследования
В исследование были включены 10 пациентов, которые получали комбинированную терапию – БАД Гастрокур в дозе две капсулы три раза в день натощак и пантопразол в дозе 40 мг за 30 минут до завтрака в течение четырех недель.
На основании стандартизированного опросника у всех пациентов в динамике оценивали следующие жалобы: боли в эпигастрии натощак; боли в эпигастрии после приема пищи; тяжесть в эпигастрии после приема пищи, тошноту, рвоту и другие симптомы при наличии. Выраженность симптомов оценивали по четырехбалльной системе: 0 – отсутствие симптомов, 1 – слабо выраженный симптом, проявляющийся время от времени; 2 – умеренно выраженный симптом; 3 балла – выраженный симптом.
Диагностику инфекции H. pylori проводили всем пациентам с помощью 13С-УДТ до начала терапии и через месяц после ее окончания. Собранные пробы воздуха анализировали на инфракрасном спектрометре IR-force 200. Значения более 2,0 ‰ (промилле) оценивались как положительный результат теста, указывающий на наличие инфекции H. pylori.
До начала терапии всем пациентам проводили эзофагогастродуоденоскопию для оценки состояния слизистой оболочки, при выявлении эрозивных и язвенных изменений пациенты в исследование не включались. До начала и по окончании терапии проводили забор венозной крови для клинического и биохимического (оценка уровня печеночных показателей: аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы, гамма-глутамилтранспептидазы; азотистых оснований: мочевина, креатинин) анализов крови.
Пациенты вели дневник, в котором ежедневно отмечали факт приема препарата, оценивали выраженность симптомов и указывали возможные нежелательные явления.
Исследование состояло из двух этапов. На первом этапе прошли скрининг и получили комбинированную терапию БАД Гастрокур + пантопразол 10 пациентов. При контрольном исследовании у одного пациента, начавшего терапию первым, была достигнута эрадикация H. pylori. Было высказано предположение о возможной нестабильности активных веществ БАД Гастрокур при хранении при комнатной температуре, что получило подтверждение в лаборатории производителя. В связи с этим было принято решение о проведении второго этапа исследования, при котором температурный режим хранения БАД Гастрокур составил от +4 до +10 °С. Дизайн исследования не менялся. Таким образом, в настоящей работе были проанализированы и представлены результаты второго этапа.
В исследовании приняли участие 10 пациентов (трое мужчин, шесть женщин; средний возраст – 46,7 ± 8,9 лет), у всех до начала лечения был положительный результат 13С-УДТ. Оценка эрадикации H. pylori была выполнена через месяц после окончания терапии девяти больным, которые завершили курс лечения.
Статистический анализ данных
Количественные данные представлены с помощью их среднего значения и стандартного отклонения. Качественные данные представлены с помощью доли (%). Количественные показатели оценивались на соответствие нормального распределения с использованием критерия Шапиро – Уилка.
Для определения статистической значимости различий средних величин применяли критерий Стьюдента, для попарного сравнения количественных данных – парный критерий Вилкоксона. Значение p < 0,05 рассматривали как свидетельство значимого различия групп по данному признаку.
Эффективность терапии оценивали по критериям ITT (intention-to-treat – анализ данных всех пациентов, начавших терапию) и PP (per-protocol – анализ данных пациентов, которые полностью закончили терапию).
Результаты исследования
Оценка эрадикации H. pylori по данным 13С-уреазного дыхательного теста
Эрадикация H. pylori была достигнута у двух из 10 (20%) пациентов по критерию ITT и у двух из 9 (22,2%) пациентов по критерию PP (p = 0,453).
Оценка жалоб пациентов
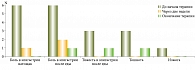
До начала терапии шестерых пациентов беспокоили боли в эпигастрии до еды или после приема пищи, у трех была тяжесть в эпигастрии после приема пищи и тошнота, изжога беспокоила одного пациента. К 14-му дню терапии у пяти пациентов были купированы жалобы на боли в эпигастрии натощак, у четырех – жалобы на боли в эпигастрии после еды. Полностью были купированы жалобы на тяжесть в эпигастрии после еды, тошноту, изжогу.
К окончанию терапии у всех пациентов были купированы боли в эпигастрии натощак. У одного пациента сохранялись жалобы на боли в эпигастрии после еды, у одного пациента на фоне терапии появились кратковременные жалобы на тошноту и у одного – тяжесть в эпигастрии после еды (рисунок).
Оценка переносимости терапии
В течение первых двух недель терапии у трех пациентов появилось вздутие живота, у пяти – кашицеобразный стул до трех раз в день. Эти явления были невыраженными, не потребовали прерывания лечения и назначения дополнительной терапии. На третьей неделе терапии указанные явления самостоятельно прошли. Один пациент выбыл из исследования в связи с обострением розового лишая на 21-й день приема препаратов, через два дня после их отмены кожные проявления редуцировались. Следует отметить, что на первом этапе исследования нежелательные явления отмечались у четырех пациентов: троих беспокоил метеоризм, у одного был кашицеобразный стул, и у одного пациента возникла тошнота.
Оценка показателей клинического и биохимического анализов крови
У одного пациента до начала терапии отмечался синдром цитолиза (АСТ – до пяти, АЛТ – до двух верхних границ нормы), в контрольном анализе по окончании терапии показатели в пределах референсных значений. У остальных пациентов на фоне терапии отклонений в клиническом и биохимическом анализах крови не наблюдалось.
Обсуждение
Представленные данные пилотного исследования свидетельствуют, что четырехнедельный курс комбинированной терапии, включавшей биологически активную добавку к пище Гастрокур и пантопразол, привел к эрадикации H. pylori в 20% (ITT) и 22,2% (PP) случаев. Безусловно, такой уровень эрадикации выглядел бы недостаточным при обсуждении схем, включающих антибиотики, но в нашей работе применяли препарат растительного происхождения. По сути, речь идет о возможности достижения эрадикации значимой и распространенной инфекции без применения антибиотиков у части больных. Если эффект такого лечения не достигнут, ничто не мешает проведению плановой эрадикационной терапии эффективными в данном регионе схемами. Подчеркнем, что эти данные были получены на небольшой выборке больных, тем не менее они вселяют оптимизм и являются основой для дальнейших исследований.
На фоне лечения наблюдалась положительная клиническая динамика в виде снижения выраженности и устойчивого устранения симптомов диспепсии. Лечение хорошо переносилось больными. При детальном опросе пациентов было выяснено, что два из них исходно страдали запором, поэтому появление кашицеобразного стула в первые две недели терапии они расценили позитивно, дискомфорт не испытали. После прекращения лечения запор у данных пациентов возобновился. Данное изменение характера стула обусловлено усилением моторики желудочно-кишечного тракта на фоне приема дигидрокверцетина, который демонстрирует прокинетическое и слабительное действие [36].
У одного пациента до начала терапии отмечалось повышение уровня АЛТ и АСТ в сыворотке. Невыраженный синдром цитолиза не явился противопоказанием к терапии, в контрольном анализе по окончании лечения уровень этих ферментов нормализовался. Ввиду единичного наблюдения мы не можем судить о характере влияния БАД Гастрокур на функцию печени. Тем не менее имеется ряд исследований, подтверждающих гепатопротективное свойство таксифолина, связанное с его антиоксидантным действием [37–39]. В исследовании на мышах таксифолин значительно снижал уровни АЛТ и АСТ в сыворотке, а также уменьшал инфильтрацию CD4+ и CD8+ Т-клеток в поврежденных тканях печени. Кроме того, таксифолин подавлял провоспалительные цитокины (ФНО-α, интерферон гамма, ИЛ-2, ИЛ-4 и ИЛ-10), факторы апоптоза (Fas и FasL), хемокин остеопонтин, факторы транскрипции, которые регулируют дифференцировку Th-клеток, перфорин, гранзим B [38].
У остальных пациентов до и после окончания курса терапии отклонений в клиническом и биохимическом анализах крови не наблюдалось, что указывает на безопасность применения данной биологически активной добавки.
На фоне терапии не зарегистрировано серьезных нежелательных явлений, за исключением обострения розового лишая у одного пациента, самостоятельно прошедшего после отмены приема исследуемых препаратов и не потребовавшего специального лечения.
Следует отметить, что при хранении БАД Гастрокур необходимо соблюдение температурного режима от 4 до 10 °С.
Исследования демонстрируют гастропротективное свойство дигидрокверцетина за счет его антиоксидантного действия [32, 33], однако влияние его на бактерию H. pylori недостаточно изучено. В одном исследовании на модели хронической язвы желудка у крыс было продемонстрировано гастропротективное свойство таксифолина (дигидрокверцетина), пероральный прием которого уменьшал размер язвы желудка на 63% по сравнению с контрольной группой, получавшей омепразол (на 57%), при этом был зафиксирован дозозависимый эффект таксифолина. Отмечено ингибирующее влияние таксифолина на H. pylori in vitro [40], вероятно обусловленное повреждением клеточной оболочки грамотрицательных бактерий [41, 42]. Авторы рассматривают эти результаты в качестве свидетельства противоязвенного эффекта таксифолина, обусловленного стимулированием защитных факторов желудка (усиление продукции слизи, снижение активности миелопероксидазы и повышение содержания восстановленного глутатиона в области язвы), а также его ингибирующим воздействием на H+/K+-АТФазу и H. pylori [40].
Полученные в рамках представленного пилотного исследования данные об эрадикационной эффективности БАД Гастрокур нуждаются в дальнейшем изучении как в рамках клинических, так и наблюдательных исследований. Фитопрепараты могут быть полезны при ведении инфицированных H. pylori в тех случаях, когда антибактериальная терапия неэффективна, противопоказана или может быть отложена.
D.S. Bordin, PhD, Prof., I.N. Voynovan, PhD
A.S. Loginov Moscow Clinical Scientific Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Tver State Medical University
Contact person: Dmitry S. Bordin, d.bordin@mknc.ru
The results of a clinical study of the efficacy and safety of taking a dietary supplement Gastrokur in combination with pantoprazole in patients with Helicobacter pylori are presented.
Material and methods. 10 patients with H. pylori infection confirmed according to 13C-urease respiratory test for four weeks received the dietary supplement Gastrokur two capsules three times a day in combination with pantoprazole 40 mg once a day. A special condition was the compliance with Gastrokur temperature regime of storage from +40 to +100 С. The efficacy of eradication was evaluated using a 13C urease breath test 30 days after completion of treatment.
Results. H. pylori eradication was achieved in two out of 10 (20%) patients according to the ITT criterion and in two out of nine (22.2%) patients according to the PP criterion. By the 14th day of therapy, 80% of patients had completely stopped symptoms of dyspepsia with the effect remaining for a month after the end of therapy. During the first two weeks of therapy, three patients had bloating, five had mushy stools no more than three times a day. These phenomena were not pronounced and did not require interruption of treatment. One patient dropped out of the study due to an exacerbation of pink lichen on the 21st day of therapy, which independently passed two days after discontinuation of treatment.
Conclusion. A course of therapy with a biologically active food supplement Gastrokur in combination with pantoprazole led to the eradication of H. pylori in 20%. Against the background of therapy, a good positive clinical dynamics was observed. No serious adverse events have been reported, with the exception of an exacerbation of pink lichen in one patient.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.