Препараты сульфонилмочевины в терапии сахарного диабета 2 типа: свойства, эффективность, безопасность глимепирида
- Аннотация
- Статья
- Ссылки
- English

Сахарный диабет (СД) 2 типа – одно из самых распространенных хронических заболеваний, приводящее к снижению продолжительности и качества жизни. Неуклонный рост заболеваемости СД 2 типа связан с увеличением средней продолжительности жизни и числа больных ожирением.
Как правило, изначально нарушения углеводного обмена протекают бессимптомно, и при выявлении СД 2 типа многие пациенты уже имеют микро- и макрососудистые осложнения. Частота сопутствующих сердечно-сосудистых заболеваний у больных СД 2 типа в 2–4 раза выше, чем у лиц без нарушений углеводного обмена. Лечение, основанное на использовании препаратов, характеризующихся высоким антигипергликемическим эффектом, минимальным количеством побочных реакций, удобством в применении, считается оптимальным и позволяет улучшить контроль над диабетом и сократить расходы на лечение его осложнений [1].
Причины нарушения углеводного обмена
В основе нарушений углеводного обмена при СД 2 типа лежит инсулинорезистентность (неадекватный биологический ответ клеток на достаточное физиологическое содержание инсулина в крови) и дисфункция бета-клеток поджелудочной железы. Различают базальную и стимулированную секрецию инсулина. Базальная секреция инсулина постоянна, имеет место в отсутствие каких-либо экзогенных стимулов. Ее роль заключается в снижении базальной продукции глюкозы печенью, уровня глюкозы натощак и свободных жирных кислот. В бета-клетке выявлены два вида инсулиновых гранул. У каждого из них свое назначение. Первая фаза секреции инсулина регистрируется после внутривенного введения глюкозы, достигается за счет быстрого увеличения уровня ионов кальция в бета-клетке и создает ранний пик секреции за счет немедленного инсулинового ответа. Несмотря на то что количество выделяемого при этом инсулина всего около 10% от количества инсулина, секретируемого за сутки, значение раннего пика секреции в регуляции велико. Ранний пик секреции инсулина:
- вызывает немедленное подавление продукции глюкозы печенью, контролируя рост гликемии;
- подавляет липолиз и секрецию глюкагона;
- повышает чувствительность периферических тканей к действию инсулина, способствуя утилизации глюкозы;
- удерживает прандиальную гликемию в пределах нормы.
Вторая, более продолжительная фаза секреции инсулина обеспечивается стабильным пулом гранул [2].
Классическим нарушением функции поджелудочной железы при СД 2 типа является отсутствие первой фазы секреции инсулина при внутривенном или пероральном введении глюкозы. У пациентов наблюдаются снижение реакции бета-клеток в ответ на другие секретагоги, подавление пульсаторного характера секреции инсулина, уменьшение секреторных резервов, гиперпродукция проинсулина.
Ведущую роль в развитии функциональных и структурных изменений бета-клеток играют возрастные факторы, наследственная предрасположенность, инсулинорезистентность, глюкозотоксичность, нарушение эффектов инкретинов и др. Гиперинсулинемия и постоянная гипергликемия сначала снижают чувствительность, а затем блокируют инсулиновые рецепторы. При этом в соответствии с уровнем гиперинсулинемии не только уменьшается количество инсулиновых рецепторов, но и подавляются пострецепторные механизмы, опосредующие их действие. На фоне гиперинсулинемии поступающие с пищей жиры депонируются жировой тканью, подавляется распад жира, что способствует прогрессированию ожирения. В результате усиливается инсулинорезистентность [3].
Международные и отечественные рекомендации по ведению пациентов с СД 2 типа
Патогенетические подходы к терапии отражены в алгоритме ведения пациентов с СД 2 типа, разработанном при совместном участии Американской диабетической ассоциации (American Dietetic Association – АDА) и Европейской ассоциации по изучению сахарного диабета (Еuropean Association for the Study of Diabetes – ЕАSD) в 2006 г. и обновленном в 2009 г. с целью стандартизации оказания медицинской помощи больным на разных стадиях заболевания. Некоторые позиции этого базового документа активно дискутировались [4]. В октябре 2009 г. был опубликован совместный алгоритм Американской ассоциации клинических эндокринологов (American Association of Clinical Endocrinologists – ААСЕ) и Американского колледжа эндокринологии (American College of Endocrinology – АСЕ), учитывающий основные недостатки алгоритма ADA/EASD. Принципиальными отличиями алгоритма ААСЕ/АСЕ-2009 от алгоритма ADA/EASD-2009 являются:
- стратификация лечения в зависимости от исходного уровня HbА1с;
- использование всех зарегистрированных классов сахароснижающих препаратов;
- приоритет эффективности и безопасности лечения над стоимостью и длительностью использования в клинической практике.
Совет экспертов Российской ассоциации эндокринологов (РАЭ) в 2011 г. разработал Консенсус по инициации и интенсификации сахароснижающей терапии СД 2 типа, приняв за основу алгоритм ААСЕ/АСЕ-2009. Международные клинические рекомендации полностью вошли в шестое издание алгоритмов специализированной медицинской помощи больным СД в России в рамках федеральной программы «Сахарный диабет». В 2012 г. были изданы обновленные рекомендации ADA/EASD, также учитывающие современные взгляды на лечение больных СД 2 типа. Кроме того, национальные и международные программы по терапии СД 2 типа ежегодно обновляются и дополняются с учетом последних данных.
Этапы терапии
Главная цель лечения СД 2 типа – достижение уровня глюкозы крови, максимально приближенного к норме, без высокого риска гипогликемий, сохранение функции бета-клеток и снижение инсулинорезистентности.
Индивидуальный подход к больному и определение индивидуального целевого уровня HbA1c – два основных фактора, влияющих на выбор сахароснижающей терапии.
Механизмы действия сахароснижающих препаратов различны, но в целом направлены на устранение трех основных метаболических нарушений, приводящих к гипергликемии при СД 2 типа: нарушения секреции инсулина поджелудочной железой, периферической инсулинорезистентности и избыточной продукции глюкозы печенью.
К настоящему моменту накоплен большой клинический опыт использования таблетированных сахароснижающих препаратов различных групп (бигуанидов, препаратов сульфонилмочевины (ПСМ), агонистов гамма-рецепторов, активируемых пролифератором пероксисом (PPAR-гамма), ингибиторов глюкозидаз, глинидов, агонистов рецепторов глюкагоноподобного пептида 1 (ГПП-1), ингибиторов дипептидилпептидазы 4 (ДПП-4). Их роль в терапии СД четко определена.
Первый этап лечения СД 2 типа предусматривает изменение образа жизни. И это понятно: снижение массы тела и увеличение физической нагрузки благоприятно влияют на углеводный и липидный обмен. Правда, поддерживать уровень гликемии в норме немедикаментозными методами лечения удается далеко не всем пациентам. Именно поэтому одновременно с модификацией образа жизни целесообразно начинать терапию метформином, ингибиторами ДПП-4 или агонистами рецепторов ГПП-1. Если по истечении шести месяцев нецелевой уровень гликированного гемоглобина сохраняется или снижается менее чем на 0,5%, рекомендуется перейти ко второму этапу.
Второй этап терапии СД 2 типа предусматривает усиление медикаментозной терапии. Причем выбор препарата определяется уровнем HbA1c. Кроме того, учитываются особенности течения СД, сопутствующие заболевания, возраст, стаж диабета, что формирует индивидуальные целевые показатели гликемии. У молодых пациентов с целью предупреждения поздних осложнений рекомендуется добиваться поддержания гликемии натощак и через два часа после еды, а также HbA1c на уровне, близком к норме. У пожилых пациентов с тяжелой сопутствующей патологией необходимо поддерживать гликемию натощак и в течение дня на более высоком уровне в связи с большей вероятностью развития гипогликемий.
В последних рекомендациях Международной диабетической федерации (International Diabetes Federation – IDF-2013), ADA-2014, РАЭ-2011, базирующихся на крупномасштабных международных клинических исследованиях (ADVANCE – Action in Diabetes and Vascular Disease-Preterax and Dimicron Modified Released Controlled Evaluation, ACCORD – Action to Control Cardiovascular Risk in Diabetes, VADT – Veteran Affairs Diabetes Trial), особое внимание уделяется гипогликемическим состояниям и их последствиям. Доказано, что сердечно-сосудистые осложнения и летальный исход чаще имеют место при интенсифицированном снижении уровня гликемии, наличии гипогликемических эпизодов (особенно тяжелых гипогликемий) [5]. В группу риска развития тяжелой гипогликемии входят пациенты:
- пожилого возраста;
- с длительным течением СД;
- нарушенным распознаванием гипогликемии;
- сниженной функцией почек и печени;
- получающие бета-блокаторы (особенно неселективные или слабоселективные).
Приоритет в подобной клинической ситуации следует отдавать средствам с минимальным риском развития гипогликемий [4].
ПСМ при исходном уровне HbA1c 6,5–7,5% не являются препаратами выбора. Монотерапия ПСМ, за исключением глибенкламида, может быть альтернативой метформину или другим препаратам первого ряда (при наличии противопоказаний или непереносимости). При уровне HbA1c 7,6–9,0% уже в дебюте следует назначать комбинированную терапию. При неэффективности двухкомпонентной схемы возможно сочетание трех сахароснижающих препаратов или начало инсулинотерапии.
ПСМ, как и метформин, имеют полувековой клинический опыт использования. Механизм действия максимально реализуется только при сохраненной функции инсулярного аппарата поджелудочной железы и обусловлен связыванием ПСМ со специфическими рецепторами плазматической мембраны бета-клеток, которые интегрированы в структуру АТФ-зависимых калиевых каналов плазматических мембран. Как только ПСМ связывается с рецептором, АТФ-зависимый канал бета-клетки закрывается, поступление калия из внеклеточного пространства внутрь бета-клетки блокируется. Это вызывает деполяризацию клеточной мембраны. В ответ потенциал-зависимые кальциевые каналы клеточной мембраны открываются, кальций поступает в бета-клетку, его концентрация в ней повышается, что стимулирует секрецию инсулина [6].
Глимепирид – препарат выбора
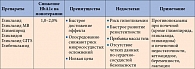
За последние десятилетия было создано три поколения ПСМ. Препараты первого поколения толбутамид и хлорпропамид имели существенный недостаток: их взаимодействие с другими лекарственными средствами, применяемыми для лечения сопутствующих заболеваний, иногда приводило к развитию тяжелых эпизодов гипогликемии. При разработке препаратов второго поколения (гликлазида, глипизида, глибенкламида) данная проблема была частично решена. В отличие от предшественников препараты второго поколения не вызывают гипогликемию при сочетанном применении. Вместе с тем их использование сопровождается по крайней мере тремя неблагоприятными эффектами (табл. 1) [4]:
- эпизодами гипогликемии, в частности при нерегулярном приеме пищи, физической нагрузке и сочетанном применении с некоторыми лекарственными средствами;
- увеличением массы тела;
- возможным отрицательным воздействием на сердечно-сосудистую систему.
Создание ПСМ третьего поколения (глимепирида, Амарила) позволило нивелировать такие эффекты [7]. Глимепирид связывается с участком рецептора сульфонилмочевины, молекулярная масса которого 65 кДа, тогда как другие ПСМ взаимодействуют с его субъединицей молекулярной массой 140 кДа. Глимепирид характеризуется меньшей аффинностью к рецептору и быстрой ассоциацией и диссоциацией в активном центре рецептора. Исходя из этого можно сделать вывод, что связывание с белком молекулярной массой 65 кДа обусловливает менее устойчивую блокаду рецепторов по сравнению с другими препаратами сульфонилмочевины, модулирует функцию высвобождения инсулина и ассоциируется с низкой вероятностью развития гипогликемии. Глимепирид связывается с рецептором в 2,5–3 раза быстрее, чем другие ПСМ, и отличается более быстрым началом действия. Из связи с рецептором глимепирид высвобождается в 8–9 раз быстрее, что обусловливает более редкие гипогликемические реакции [8]. В отличие от глибенкламида при приеме глимепирида сохраняется физиологическое подавление секреции инсулина при низком уровне глюкозы крови (например, при физической нагрузке). Таким образом, риск гипогликемии минимален [9]. Подобное свойство глимепирида делает его применение предпочтительным у физически активных больных СД 2 типа. Глимепирид стимулирует не только вторую, но и первую фазу секреции инсулина [10, 11]. Это очень важно, поскольку, как уже отмечалось, нарушение ранней секреции инсулина – один из патогенетических механизмов развития СД 2 типа.
Улучшение второй и первой фаз секреции инсулина имеет значение с клинической точки зрения, в частности для предупреждения прогрессирования заболевания. В экспериментальных исследованиях показано, что глимепирид улучшает поступление глюкозы в клетки мышц, повышает синтез гликогена и снижает продукцию эндогенной глюкозы. Все это обеспечивает значимый гипогликемический эффект препарата.
После приема внутрь глимепирид быстро всасывается, его биодоступность достигает 100% независимо от приема пищи. Более 90% глимепирида циркулирует в крови в связанном с белками плазмы виде, преимущественно с альбумином. Глимепирид подвергается биотрансформации в печени сначала до метаболита, обладающего 33%-ной активностью (от основного вещества). Далее образуется второй метаболит, не обладающий гипогликемической активностью. Около 60% метаболитов выводится почками, оставшиеся 40% – с калом (менее 1% вещества выводится в неизмененном виде с мочой) [12–14].
Как продемонстрировали результаты клинических исследований, у пациентов, получавших глимепирид, значительно реже развивались эпизоды гипогликемии по сравнению с пациентами, принимавшими глибенкламид [15–17].
Хорошая переносимость (отсутствие случаев гипогликемии) доказана в крупномасштабном постмаркетинговом наблюдательном исследовании. Из 22 000 пациентов, принимавших участие в исследовании, лишь у 0,3% развивалась гипогликемия. Среди больных, впервые применявших препарат, гипогликемия наблюдалась у 0,4% [18].
В двойном слепом исследовании GUIDE (GUIDE study: double-blind comparison of once-daily gliclazide MR and glimepiride in type 2 diabetic patients, 2004 г.) глимепирид в дозе 1–6 мг и Гликлазид MВ в дозе 30–120 мг сопоставимо снижали уровень гликозилированного гемоглобина и препрандиальную гликемию. Отметим, что суммарная частота подтвержденных гипогликемических состояний (% от всех симптоматических) в группе глимепирида была выше, чем в группе Гликлазида МВ (68,3 и 48,9% соответственно), при сопоставимых количествах подтвержденных и симптоматических гипогликемий. Однако при перерасчете количества пациентов, испытавших подтвержденные гипогликемии, на одного пациента различий между глимепиридом и Гликлазидом МВ не наблюдалось. Исследование имело ряд методологических недостатков, и его результаты были подвергнуты критике.
Нельзя не вспомнить о флорентийском регистре, который привлек внимание данными о годовой смертности больных СД 2 типа, получавших комбинацию метформина и ПСМ. Самая высокая смертность регистрировалась у тех, кто получал метформин и глибенкламид. Показатель смертности был в 4 раза меньше при комбинации метформина и гликлазида и в 20 раз – при комбинации метформина и глимепирида [19]. Это можно объяснить частотой возникновения гипогликемий при использовании метформина в комбинации с ПСМ. Глибенкламид вызывает более частое развитие гипогликемий по сравнению с гликлазидом или глимепиридом. Этот факт в настоящее время не вызывает сомнений и подтвержден соответствующими рекомендациями по использованию данных препаратов у больных СД 2 типа.
Необходимо отметить ряд экстрапанкреатических эффектов глимепирида:
- ингибирование глюконеогенеза в печени за счет повышения концентрации ингибитора глюконеогенеза фруктозы-2,6-бифосфата, что позволяет снизить уровень гликемии натощак и между приемами пищи;
- антиатерогенное действие за счет уменьшения перекисного окисления липидов;
- снижение агрегации тромбоцитов за счет избирательного ингибирования циклооксигеназы, участвующей в образовании тромбоксана А2 [20, 21].
Большинство больных СД 2 типа имеют избыточную массу тела. На фоне лечения ПСМ не отмечается какого-либо положительного влияния на данный показатель. Преимущество глимепирида состоит в том, что он не вызывает увеличения массы тела на фоне эффективного контроля гликемии, что достоверно показано в ряде исследований [7, 18, 22].
ПСМ взаимодействуют с АТФ-зависимыми калиевыми каналами, расположенными не только в поджелудочной железе, но и в сосудах. Это может обусловливать отрицательное влияние на сердечно-сосудистую систему. Эффект глимепирида реализуется иным способом.
В исследованиях у животных показано отсутствие его взаимодействия с АТФ-зависимыми калиевыми каналами в сосудистой стенке, что свидетельствует о меньшем влиянии на функции сердечно-сосудистой системы по сравнению с глибенкламидом и гликлазидом. Вероятно, это связано с особенностями связывания глибенкламида с рецепторами. Несмотря на то что глимепирид обладает сродством к АТФ-зависимым каналам кардиомиоцитов, он не подавляет ишемическое прекондиционирование миокарда (то есть механизм адаптации миокарда к эпизодам ишемии после ишемических атак). Одним из вероятных механизмов ишемического прекондиционирования миокарда является открытие АТФ-зависимых митохондриальных каналов. Глимепирид более селективно взаимодействует с АТФ-зависимыми каналами сарколеммы кардиомиоцитов и обладает меньшим сродством к митохондриальным каналам в отличие от других ПСМ [23, 24]. Это означает, что по сравнению с другими ПСМ влияние глимепирида в отношении панкреатических клеток более избирательно. Данные сведения позволяют сделать вывод, что глимепирид может быть более безопасным при использовании у пациентов с СД 2 типа при наличии сопутствующей сердечно-сосудистой патологии.
Преимущественно печеночный метаболизм глимепирида позволяет использовать его у лиц с нарушениями функции почек. Однако, поскольку он является стимулятором секреции инсулина, клиренс инсулина при снижении функции почек будет замедлен, что повысит риск развития гипогликемии.
B. Rosenkranz и соавт. изучали действие глимепирида у больных с нарушением функции почек. У большинства больных со сниженной скоростью клубочковой фильтрации (СКФ) дозы глимепирида 1–4 мг было достаточно, чтобы достичь целевых значений гликемии. Всего 1 мг в сутки глимепирида требовалось больным с выраженными поражениями почек (СКФ < 22 мл/мин/1,73м2). Предположительно повышение относительного клиренса препарата при хронической болезни почек (ХБП) может быть связано с нарушением связывания его с белками: при поражении почек часть глимепирида находится в несвязанном состоянии [13]. Важно и то, что даже при повторных приемах препарат не кумулируется [25, 26].
В последнее время показания к применению глимепирида у больных СД 2 типа и ХБП расширились. Наряду с ограниченным рядом других препаратов глимепирид разрешен к применению у пациентов с ХБП 4-й стадии [27], а по данным National Kidney Foundation (KDOQI), опубликованным в 2012 г., даже у пациентов с ХБП 5-й (додиализной) стадии [14]. Лечение следует начинать с минимальной дозы 1 мг, при необходимости постепенно изменяя ее под контролем гликемии (табл. 2) [27].
Важным моментом фармакокинетики глимепирида является отсутствие ее различий у лиц пожилого возраста по сравнению с более молодыми. В последних рекомендациях IDF-2013, ADA-2014, Канадской диабетической ассоциации – 2013 [28–31] особое внимание уделено сахароснижающей терапии у пациентов пожилого возраста. В недавнем обзоре IDF была приведена оценка сравнительной безопасности четырех препаратов – глибурида, гликлазида, глимепирида, глипизида, используемых в лечении СД 2 типа у пожилых пациентов. Применение глибенкламида/глибурида не рекомендовано у пациентов старше 60 лет. В этой ситуации с учетом прежде всего низкого риска гипогликемии, а также удобства применения глимепирид, как и гликлазид, имеет преимущества перед другими ПСМ.
Свойство глимепирида оказывать быстрый сахароснижающий эффект позволяет индивидуально подобрать и откорректировать дозу в короткий срок и тем самым снизить риск негативного воздействия гипергликемии на органы-мишени.
Как показали результаты исследования GUIDE, некоторым пациентам было достаточно полумаксимальной дозы глимепирида по сравнению с максимальной дозой гликлазида пролонгированного действия, чтобы достичь сопоставимого снижения уровня глюкозы крови. У пациентов, получавших глимепирид за 30 минут до завтрака или непосредственно перед завтраком, существенных различий в фармакодинамике не отмечалось. При этом не наблюдалось разницы при однократном и многократном режиме приема. Все это делает глимепирид препаратом, удобным для применения.
N.V. Zaytseva
The National Research Center for Endocrinology
Contact person: Natalya Vladislavovna Zaytseva, nata.zaec@gmail.com
Glimepiride is a safe and effective drug, сlassified as the third-generation therapy for patients with type 2 diabetes mellitus whose blood glucose levels are not effectively controlled by lifestyle modification or using other first-line drugs. Glimepiride can be used in combination with other antidiabetic agents or long-acting insulin. The drug does not influence weight gain. Glimepiride is safe for use in elderly patients with risk of hypoglycemia and in patients with chronic kidney disease. It's application is advisable in patients with underlying cardiovascular disease.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.