Применение парентеральной формы препарата Темодал® (темозоломид) в терапии глиобластом
- Аннотация
- Статья
- Ссылки
- English
Введение
Злокачественные глиомы составляют 50–60% всех первичных опухолей центральной нервной системы. Прогноз их лечения неблагоприятный, а качество жизни больных снижается вследствие тяжелых неврологических нарушений и осложнений на фоне применяемой терапии. Алгоритм лечения предусматривает хирургическую резекцию с последующей лучевой терапией и химиотерапией [1]. При глиальных опухолях используются противоопухолевые препараты: темозоломид, нитрозопроизводные (ломустин, нимустин, кармустин, фотемустин), винкристин, прокарбазин, комбинация «ломустин + прокарбазин + винкристин», производные платины (цисплатин, карбоплатин), этопозид, бевацизумаб (в монотерапии или в комбинации с иринотеканом). Наиболее эффективным препаратом в лечении злокачественных глиом признан темозоломид [2].
Темозоломид – алкилирующий препарат, механизм действия которого состоит в присоединении метильной группы к ДНК, что приводит к нарушению структуры последней и гибели клетки [3]. Пероральный темозоломид обладает 100%-ной биодоступностью, а также быстрой и полной всасываемостью в кишечнике.
Необходимо отметить, что препарат включен в стандарты лечения злокачественных глиом в России и доступен для пациентов. При лечении злокачественных глиом темозоломид назначают в дозе 150–200 мг/м2 в течение пяти суток каждые 28 дней [4]. Длительный прием темозоломида – в течение всего курса радиотерапии приводит к истощению метилгуаниновой метилтрансферазы (МГМТ) – фермента, обеспечивающего клеточную репарацию ДНК и влияющего на прогноз эффективности химиотерапии, даже в отсутствие метилирования МГМТ, что дает надежду на успех лечения [5, 6].
На сегодняшний день стандартом лечения пациентов с глиобластомой в качестве первой линии после удаления или биопсии (после гистологической верификации опухоли) считается проведение комбинированной химиолучевой терапии с использованием темозоломида (его ежедневный прием во время лучевой терапии с последующими поддерживающими курсами химиотерапии данным препаратом) [2]. Добавление темозоломида к лучевой терапии на самых ранних этапах лечения глиобластом обеспечивает статистически значимое увеличение общей выживаемости и увеличение времени до прогрессирования [3]. Результаты клинических исследований показали, что все больные, получавшие темозоломид в обеих лекарственных формах, отмечали лучшую переносимость внутривенной инфузии по сравнению с пероральным приемом капсул. Наличие двух лекарственных форм расширяет возможности применения темозоломида при злокачественных глиомах, позволяет проводить лечение с наименьшей токсичностью и обеспечивать наиболее высокое качество жизни пациентов в процессе лечения [4].
Клинический случай 1
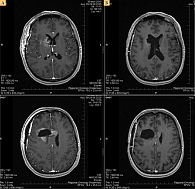
Женщина, 40 лет. Заболела остро в июле 2015 г., имел место приступ с потерей сознания. Пациентка была доставлена в клинику бригадой скорой помощи. При выполнении компьютерной томографии (КТ) головного мозга выявлена опухоль головки хвостатого ядра с поражением мозолистого тела и паравентрикулярных отделов лобной доли справа. 13 июля выполнена операция – удаление новообразований больших полушарий головного мозга с применением нейрохирургической техники под контролем навигации. Гистологически – глиобластома G4. После операции отмечался небольшой неврологический дефицит, обусловленный онемением в левой верхней конечности. Результаты магнитно-резонансной томографии (МРТ) головного мозга, проведенной 30 июля, показали наличие опухоли правой височно-лобной области с распространением на базальные ядра мозга справа и передние отделы корпуса мозолистого тела, послеоперационной порэнцефалической кисты правой височно-лобной области. Назначены химиолучевая терапия, затем шесть курсов монохимиотерапии темозоломидом. С учетом наличия в послеоперационном периоде периодических головокружений, тошноты и рвоты после приема пищи выбрана парентеральная форма препарата Темодал®. Лучевая терапия начиналась через 25 дней после операции. 3D-планирование выполнялось на планирующей системе Aмфора 2.13 с использованием КТ-топометрии и совмещения данных МРТ-сканирования режима T1 для визуализации остаточной опухоли. Облучению (доза 30 Гр) подвергался весь объем головного мозга, затем уменьшенными полями – остаточная опухоль с краем безопасности 1–2 см (суммарная доза до 60 Гр). Лечение проводилось в режиме стандартного фракционирования на гамма-терапевтическом аппарате АГАТ-Р1. Одновременно с лучевой терапией (30 фракций в суммарной дозе 60 Гр) пациентка получала темозоломид в дозе 75 мг/м2 ежедневно внутривенно в течение 42 дней. Во время лечения еженедельно проводилось исследование крови с подсчетом числа клеток. Гематологической токсичности на протяжении всего периода химиолучевого лечения не зарегистрировано. Снижения дозы и временной отмены препарата не потребовалось. Спустя четыре недели по завершении комбинированной терапии выполнено шесть курсов монохимиотерапии темозоломидом. Во время первого курса препарат назначали в дозе 150 мг/м2 внутривенно в течение пяти дней с последующим 23-дневным перерывом. С учетом того что на первом цикле гематологической и негематологической токсичности не зафиксировано, на втором курсе доза увеличена до 200 мг/м2 внутривенно. В такой же суточной дозе препарат назначали и в последующих циклах. В каждом цикле пациентка принимала препарат в течение пяти дней подряд с последующим 23-дневным перерывом. На фоне лечения неврологического дефицита не отмечалось. Контрольная МРТ головного мозга показала значительное уменьшение размера зоны патологического накопления контраста и зоны перифокального отека (рис. 1).
Ситуация на март 2016 г.: пациентка жива, продолжает работать и вести активный образ жизни, неврологическая симптоматика полностью купирована. Гематологической и негематологической токсичности на протяжении всего периода лечения не зафиксировано. Планируется продолжить монохимиотерапию парентеральной формой темозоломида до прогрессирования заболевания с оценкой эффекта (МРТ головного мозга) каждые три месяца.
Клинический случай 2
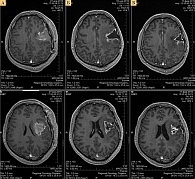
Мужчина, 39 лет. Заболел остро, в конце марта 2015 г. появились выраженные головные боли, слабость в правых конечностях, замедленная речь. Бригадой скорой медицинской помощи пациент был доставлен в клинику. При выполнении КТ головного мозга выявлено объемное образование левой лобной доли головного мозга. 13 апреля проведена операция – микрохирургическое удаление опухоли левой лобной доли, островка с применением интраоперационной навигации. Гистологически – глиобластома G4. После операции наблюдался неврологический дефицит в виде правостороннего гемипареза и нарушения речи. Контрольная МРТ головного мозга, проведенная 28 апреля, показала состояние после субтотального удаления опухоли лобно-теменной области головного мозга слева, латеральную дислокацию срединных структур вправо. Лучевая терапия начата через 28 дней после операции. 3D-планирование выполнено на планирующей системе Aмфора 2.13 с использованием КТ-топометрии и совмещения данных МРТ-сканирования режима T1 для визуализации остаточной опухоли. Облучению (доза до 30 Гр) подвергался весь объем головного мозга, затем уменьшенными полями – остаточная опухоль с краем безопасности 1–2 см (суммарная доза до 60 Гр). Лечение проводилось в режиме стандартного фракционирования на гамма-терапевтическом аппарате АГАТ-Р1. Одновременно с лучевой терапией (30 фракций в суммарной дозе 60 Гр) пациент получал Темодал® (темозоломид) в дозе 75 мг/м2 ежедневно внутривенно в течение 42 дней. Во время лечения еженедельно проводилось исследование крови с подсчетом числа клеток. Гематологической токсичности на протяжении всего периода химиолучевого лечения не зафиксировано. Снижения дозы и временной отмены препарата не потребовалось. Спустя четыре недели по окончании комбинированной терапии проведено шесть курсов монохимиотерапии темозоломидом. Во время первого курса препарат назначали в дозе 150 мг/м2 внутривенно в течение пяти дней с последующим 23-дневным перерывом. С учетом того что на первом цикле гематологической и негематологической токсичности не наблюдалось, во время второго курса дозу увеличили до 200 мг/м2 внутривенно. В такой же суточной дозе препарат назначали и на последующих циклах. В каждом цикле пациент принимал препарат в течение пяти дней подряд с последующим 23-дневным перерывом. На фоне лечения наблюдались клинически выраженная положительная динамика, уменьшение неврологического дефицита. Контрольная МРТ головного мозга продемонстрировала значительное уменьшение размера зоны патологического накопления контраста и зоны перифокального отека (рис. 2).
Ситуация на март 2016 г.: пациент жив, не работает, но выполняет всю работу по дому, полностью себя обслуживает, сохраняется незначительное нарушение речи. Гематологической и негематологической токсичности на протяжении всего лечения не зарегистрировано. Планируется продолжить монохимиотерапию парентеральной формой темозоломида до прогрессирования заболевания с оценкой эффекта (МРТ головного мозга) каждые три месяца.
Обсуждение
Рассмотренные клинические случаи иллюстрируют потенциальный благоприятный эффект темозоломида, назначенного на ранних этапах диагностики глиобластомы совместно с лучевой терапией, а также в виде адъювантной монохимиотерапии. Оба пациента продолжают получать парентеральную форму темозоломида с отмечающейся частичной ремиссией.
Данная схема лечения позволяет не только увеличить медиану общей выживаемости, но также значительно продлить время до прогрессирования и сохранить качество жизни и социальный статус больных.
Низкая токсичность препарата Темодал® (темозоломид) при внутривенном введении позволяет рекомендовать проведение инфузий в условиях дневного стационара или амбулаторно. При адъювантной химиотерапии риск нежелательных негематологических эффектов выше, в связи с чем расширяются показания к внутривенному введению темозоломида: нарушение глотания, трудности при проглатывании капсул, тяжелая тошнота и рвота при предшествующем приеме капсул, хронические заболевания органов желудочно-кишечного тракта. Таким образом, наличие двух лекарственных форм расширяет возможности применения темозоломида при злокачественных глиомах [4].
При выборе и проведении терапии глиобластом с дифференцировкой G4 следует учитывать, что заболевание неизлечимо. Медиана выживаемости, как правило, менее года с момента постановки диагноза. Даже в самых благоприятных ситуациях большинство пациентов умирают в течение двух лет. Именно поэтому основными задачами лечения являются увеличение продолжительности жизни больных (одно- и двухлетняя выживаемость), улучшение качества жизни (компенсация неврологического дефицита, профилактика и лечение осложнений терапии), сбалансированность терапевтического эффекта (в том числе выживаемости) и качества жизни пациентов [7].
В настоящее время использование лучевой терапии совместно с темозоломидом признано стандартом лечения мультиформной глиобластомы в большинстве стран, в том числе в России. Химиотерапию при глиобластоме предпочтительно начинать совместно с лучевой терапией.
На фоне лучевой терапии и применения темозоломида (75 мг/м2 ежедневно в течение всего курса лучевой терапии, а затем 150–200 мг/м2 в течение пяти суток каждые 28 дней) наблюдалось повышение двухлетней выживаемости при глиобластомах до 27,2%, трехлетней – до 16,7%, четырехлетней – до 13% (при проведении лучевой терапии без темозоломида – 11,2, 3,7 и 3,2% соответственно) [2, 7].
Возможность молекулярной диагностики глиальных опухолей позволяет прогнозировать успех химиотерапии. Пациенты со злокачественными глиомами, у которых отмечается метилирование промотора МГМТ, лучше отвечают на терапию темозоломидом. Пациенты с глиобластомой, получавшие терапию темозоломидом на фоне лучевой терапии, при наличии метилированного промотора МГМТ имели общую выживаемость 21,7 месяца, а в его отсутствие – только 15,3 месяца. При хромосомном анализе оценка потери гетерозиготности 1p/19q (1p/19q loss) в олигодендроглиальных опухолях предопределяет успех химиотерапии по схеме «ломустин + прокарбазин + винкристин». Однако результаты ряда работ показывают, что потеря гетерозиготности 1p/19q является показателем меньшей агрессивности опухоли. В лаборатории нашего центра сегодня это становится рутинным исследованием с умеренной стоимостью. Изучается определение корреляции генетических аберраций в опухолевой ткани и в плазме крови, что позволяет определять тактику лечения и прогноз заболевания на этапе дооперационного обследования [3, 5, 6].
Следующим этапом в развитии лекарственного лечения онкологических заболеваний центральной нервной системы скорее всего станет использование комбинаций современных схем с таргетной терапией. Если предварительные данные проводимых исследований подтвердятся, можно будет говорить о том, что выживаемость больных в недалеком будущем увеличится до 25 месяцев при комбинации лучевой терапии с темозоломидом и бевацизумабом. Дальнейшее понимание патогенеза глиальных опухолей поможет разделить их на несколько нозоформ с разным патогенезом, но с общими клиническими и морфологическими проявлениями. Более четкое представление о механизмах развития опухоли будет способствовать целенаправленному и точному использованию таргетных препаратов [8, 9].
Немаловажен и вопрос переносимости химиотерапевтического лечения: в рассмотренных клинических случаях в отсутствие гематологической и негематологической токсичности удалось сохранить качество жизни и социальный статус пациентов на протяжении всего периода лечения [7, 8].
Заключение
Химиолучевая терапия с темозоломидом и последующая монохимиотерапия парентеральным препаратом Темодал® (темозоломид) хорошо переносятся и приводят к значительному увеличению выживаемости без прогрессирования и общей выживаемости по сравнению с другими схемами лечения. Подобная схема является золотым стандартом первой линии терапии пациентов с глиобластомой и служит основой для разработки новых высокоэффективных режимов лечения [2, 7–9].
D.Yu. Yukalchuk, D.M. Ponomarenko, Ye.V. Snetkov, T.N. Yukalchuk, A.V. Shevchuk, M.V. Demchenkova, A.V. Shelekhov
District Oncology Dispensary (Irkutsk)
Contact person: Denis Yuryevich Yukalchuk, dyuyu558@mail.ru
Here we describe a case evaluating efficacy of temozolomide applied at early stage of diagnosing glioblastoma. It was shown that chemo-radiation therapy together with temozolomide and subsequent monochemotherapy with parenteral Temodal (temozolomide) were well tolerated, contributed to significantly increased progression-free survival rate and total survival compared to other therapeutic regimens, and considered as a golden standard of the first-line therapy in patients with glioblastoma.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.