Монотерапия эрибулином при прогрессирующем метастатическом раке молочной железы
- Аннотация
- Статья
- Ссылки
- English
Введение
Рак молочной железы (РМЖ) относится к наиболее распространенным опухолям [1]. В России в 2015 г. с впервые установленным диагнозом РМЖ поставлено на учет 62 230 больных. Показатель распространенности составил 426,4 на 100 тыс. населения [2]. Приблизительные показатели заболеваемости и смертности – 84,79 и 29,34 на 100 тыс. соответственно [3].
Ежегодно в Иркутской области РМЖ диагностируют примерно у 1000 женщин. Около 10% из них на момент первичной диагностики имеют отдаленные метастазы [3, 4].
Пятилетняя выживаемость при метастатических формах рака достигает 25% [1]. После радикального лечения у 30% больных без метастазов в регионарных лимфатических узлах и до 70% с метастазами развиваются рецидив и прогрессирование рака [5]. С появлением отдаленных метастазов цель лечения меняется с выздоровления на увеличение продолжительности жизни при сохранении удовлетворительного качества жизни [6].
Выбор терапии зависит от ряда молекулярно-генетических маркеров. Перед назначением терапии все больные проходят обязательные исследования: определение в опухолевой ткани рецепторов эстрогенов, прогестерона, онкобелка HER2, антигена Ki-67, а в ряде случаев исследование мутаций в генах BRCA1 и BRCA2 [7].
Согласно недавно представленным данным, в 33% случаев опухоль гиперэкспрессирует рецепторы HER2, в 71% – рецепторы эстрогенов и/или прогестерона. В 19% случаев опухоль может быть отнесена к трижды негативному раку в отсутствие экспрессии рецепторов гормонов и HER2 [8, 9].
При рецептор-негативном и гормонорезистентном раке методом выбора является химиотерапия, но единого стандартного подхода к ее проведению нет [10].
Полихимиотерапия характеризуется увеличением количества объективных ответов и времени до прогрессирования. Вместе с тем монохимиотерапия сопряжена с меньшей токсичностью [11–13].
Учитывая, что результаты общей выживаемости сопоставимы при использовании моно- и полихимиотерапии, у пациентов без бурного прогрессирования предпочтение следует отдавать монохимиотерапии [5, 6, 14].
Эрибулин – новый нетаксановый ингибитор микротрубочек класса галихондринов. Рассмотрим случай успешного использования эрибулина в качестве монохимиотерапии у пациентки с диссеминированным РМЖ, получившей ранее несколько линий гормоно- и химиотерапии.
Клинический случай
Пациентка Л. 1965 года рождения обратилась в Областной онкологический диспансер г. Иркутска в ноябре 2013 г. В ходе обследования выявлен рак правой молочной железы – T4N3M0, стадия IIIC. При исследовании трукат-биоптата первичной опухоли обнаружена рецептор-позитивная опухоль с отрицательным статусом HER2 – 1+. Индекс пролиферации Ki-67 – 11%. После четырех курсов неоадъювантной химиотерапии по схеме АС (циклофосфамид и адриамицин) установлена локально выраженная отрицательная динамика с появлением участков распада опухоли.
4 февраля 2014 г. выполнена мастэктомия по Маддену. При гистологическом исследовании операционного материала зафиксирована инвазивная протоковая карцинома с ростом в нижние отделы дермы, некрозами, дистрофическими изменениями клеток, лимфоидной инфильтрацией и опухолевыми эмболами в сосудах. Признаки лечебного патоморфоза 2-й степени. Из 14 исследованных лимфатических узлов в десяти обнаружены метастазы с очаговым ростом за капсулу узлов. После операции пациентке назначили адъювантную химиотерапию и гормонотерапию. Проведено шесть курсов химиотерапии доцетакселом 100 мг/м2 на курс с поддержкой колониестимулирующими факторами. После этого назначен тамоксифен 20 мг/сут.
В марте 2015 г., по данным мультиспиральной компьютерной томографии (МСКТ), диагностирован рост метастазов в легких. 11 марта 2015 г. выполнена видеоторакоскопическая атипичная резекция нижней доли правого легкого. При микроскопии выявлены структуры солидной карциномы. Проведено иммуногистохимическое исследование с антителами TTF1, CK7, CK20, CK AE1/AE3, ER, GCDFP15. В клетках карциномы – позитивная экспрессия СK AE1/AE3, GCDFP15, CK7 и негативная TTF1, ER, CK20. Заключение: метастатическая карцинома молочной железы эстроген-негативная. Адъювантная гормонотерапия тамоксифеном отменена.
С апреля 2015 г. назначена химиотерапия комбинацией карбоплатина и доцетаксела. В сентябре 2015 г. зафиксировано прогрессирование заболевания.
С сентября 2015 г. с учетом гормоноположительного статуса первичной опухоли предпринята попытка проведения гормонотерапии анастрозолом. В ноябре 2015 г. зарегистрировано прогрессирование опухоли.
С ноября 2015 г. назначена монотерапия гемцитабином. При оценке эффективности лечения в феврале 2016 г. отмечалось прогрессирование в отношении метастазов в легких.
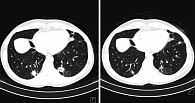
С марта 2016 г. назначена терапия эрибулином 1,4 мг/м2 в 1-й и 8-й дни 21-дневного цикла. По данным МСКТ, в июле 2016 г. достигнута частичная регрессия опухоли (рисунок).
Всего с 16 марта 2016 г. выполнено 11 циклов терапии эрибулином. Терапию пациентка переносила хорошо. Результаты МСКТ от 13 ноября 2016 г. показали прогрессирование опухоли.
Таким образом, продолжительность периода без прогрессирования составила восемь месяцев.
Обсуждение
Пациентка с диссеминированным РМЖ получила несколько линий гормоно- и химиотерапии. Такая ситуация типична для реальной клинической практики.
В рандомизированном исследовании III фазы EMBRACE сравнивали эффективность эрибулина с таковой терапии по выбору врача у больных, получивших ранее от двух до пяти линий химиотерапии по поводу рецидивного или метастатического РМЖ. 99% из них ранее проводилась терапия антрациклинами и таксанами, 73% – капецитабином. 84% пациенток получили по крайней мере одну линию гормонотерапии [9]. Несмотря на то что медиана выживаемости без прогрессирования не достигла статистической разницы и составила 3,7 месяца в группе эрибулина и 2,2 месяца в группе терапии по выбору врача (р = 0,137), различия в общей выживаемости оказались достоверны и существенно выше в группе эрибулина (13,1 и 10,6 месяца; р = 0,041).
В рассматриваемом случае у больной в анамнезе две линии гормонотерапии антиэстрогенами и ингибиторами ароматазы, терапия антрациклинами, таксанами, препаратами платины и гемцитабином. Несмотря на тяжелую «предлеченность», удалось достичь частичной регрессии опухоли с показателем выживаемости без прогрессирования восемь месяцев.
В другое исследование III фазы были включены пациенты, получившие ранее не более трех режимов химиотерапии [15]. Эрибулин и капецитабин продемонстрировали сходные результаты по показателям общей выживаемости (15,9 и 14,5 месяца соответственно; р = 0,056) и выживаемости без прогрессирования (4,1 и 4,2 месяца соответственно; р = 0,3). Однако при подгрупповом анализе лучшие результаты были выявлены в группе эрибулина у пациентов с трипл-негативным раком (общая выживаемость – 14,4 и 9,4 месяца соответственно; р = 0,01), эстроген-негативным раком (14,4 и 10,5 месяца соответственно; р = 0,02) и HER2-отрицательным раком (15,9 и 13,5 месяца соответственно; р = 0,03) [16].
В данном случае пациентка имела HER2-негативный статус, а статус гормональных рецепторов был изменен на негативный при исследовании образца метастатической опухоли.
В описанном случае проведено 11 циклов терапии эрибулином. Лечение осуществлялось амбулаторно. Зарегистрированы лейкопения максимально 3-й степени и тромбоцитопения 1-й степени. В целом эрибулин хорошо переносился пациенткой и не требовал отмены, снижения доз или увеличения интервалов между курсами.
В исследовании EMBRACE из побочных эффектов наиболее часто наблюдались слабость и нейтропения. Самыми распространенными проявлениями токсичности 3–4-й степени были лейкопения, нейтропения и нейропатия [9]. Схожие данные получены и другими авторами в отношении профиля токсичности [17, 18], а также при сравнении эрибулина с капецитабином [15].
Таким образом, терапия эрибулином показывает хороший профиль безопасности и может проводиться амбулаторно или в условиях дневного стационара.
Заключение
Эрибулин – новый нетаксановый ингибитор микротрубочек класса галихондринов. На сегодняшний день он является единственным препаратом, который продемонстрировал в ходе клинических исследований достоверное увеличение общей выживаемости у пациентов с диссеминированным раком молочной железы, получавших ранее таксаны и антрациклины после одной линии химиотерапии по поводу распространенного заболевания.
Приведенный случай подтверждает эффективность эрибулина в реальной клинической практике при распространенном РМЖ после нескольких линий гормоно- и химиотерапии и хорошую переносимость.
D.M. Ponomarenko, D.Yu. Yukalchuk, Ye.V. Panferova, D.D. Morikov, Yu.A. Chapigina, Ye.A. Likhova, A.V. Shevchuk
Irkutsk State Medical Academy of Postgraduate Education
Contact person: Dmitry Mikhaylovich Ponomarenko, ponomarenkodm@gmail.com
A case of successful chemotherapy with eribulin is described in female patient with disseminated breast cancer, who previously received several hormone and chemotherapy courses.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.