Применение вандетаниба при метастатическом медуллярном раке щитовидной железы
- Аннотация
- Статья
- Ссылки
- English
Введение
На долю медуллярного рака щитовидной железы (МРЩЖ) приходится менее 5% всех случаев рака щитовидной железы и 13,4% всех случаев смерти от рака щитовидной железы. МРЩЖ диагностируется на III и IV стадиях заболевания более чем в 50% случаев [1]. Пятилетняя выживаемость пациентов с выявленными метастазами МРЩЖ составляет около 25%, десятилетняя – около 10% [1, 2]. В 20–25% случаев МРЩЖ представлен в рамках наследственных синдромов множественной эндокринной неоплазии (МЭН) 2-го типа (синдром Сиппла – МЭН IIa, семейный МРЩЖ и МЭН IIb). В остальных случаях МРЩЖ выявляется как спорадическое заболевание.
В основе наследственных синдромов лежит мутация гена RET, кодирующего трансмембранно расположенный рецептор тирозинкиназы. Активация данного рецептора приводит к бесконтрольной пролиферации С-клеток.
Спорадический МРЩЖ может возникнуть в любом возрасте, однако пик заболеваемости приходится на 30–60 лет [1]. Агрессивность течения данной формы МРЩЖ варьируется. Соматические мутации гена RET при нем описаны в 25–71% случаев [3]. При единичных отдаленных метастазах в пределах одного органа, медленном прогрессировании процесса эффективным может быть хирургическое лечение либо применение других методов местного воздействия (радиоабляция, фотодинамическая терапия, лучевая терапия, химиоэмболизация). Указанные процедуры не приводят к излечению, но могут отсрочить проведение системной терапии, снизить вероятность болевого синдрома, сдавления окружающих структур.
Среди цитотоксических препаратов наиболее востребованным при МРЩЖ считается доксорубицин. Он применяется самостоятельно или в комбинации с цисплатином. Чувствительность к данному лечению составляет 0–22% [3]. К сожалению, ответ всегда нерадикальный и продолжается несколько месяцев. Иммунотерапия с использованием дендритных клеток может быть эффективной, но пока это объект для изучения. Имеется опыт использования радиотаргетной терапии – описано несколько ответов на лечение [Иттрий-90 DOTA]-TOC у пациентов с МРЩЖ с высоким уровнем кальцитонина, накапливающим изотоп на Октреаскане с Индием-111 [4]. В неоперабельных случаях, при значительном распространении заболевания, а также при доказанном по критерию RECIST (Response Evaluation Criteriain Solid Tumor) прогрессировании МРЩЖ методом выбора в настоящее время является системная терапия мультикиназными ингибиторами. В большинстве стран одобрены два препарата данной группы – вандетаниб (Капрелса) и кабозантиниб (Кометрик). В России пока одобрен к применению только вандетаниб (ингибитор киназ генов RET, MET, VEGFR2) [3]. В исследованиях данный препарат показал частичный ответ у 45% пациентов. Безрецидивный период составил 19,5 месяца в группе плацебо и 30,5 месяца в группе вандетаниба. Из-за развития побочных эффектов препарат был отменен у 12% пациентов. 35% больных потребовалось снижение дозы.
Достичь полной ремиссии при использовании названных препаратов невозможно. Тем не менее в ряде клинических исследований прием препаратов позволил улучшить качество жизни пациентов за счет снижения диареи и других гормональных проявлений МРЩЖ и стабилизировать процесс [5].
Клинический случай
Пациентка, 60 лет, в 2002 г. перенесла тиреоидэктомию по поводу МРЩЖ Т3N0M0, стадия III. Получала заместительную гормонотерапию L-тироксином 125 мкг/сут постоянно. Регулярно проходила контрольное обследование: ультразвуковое исследование (УЗИ) шеи и брюшной полости, компьютерная томография (КТ) шеи и грудной клетки, анализ крови на гормоны (кальцитонин, тиреотропный гормон (ТТГ), периферические тиреоидные гормоны Т3, Т4), раковый эмбриональный антиген (СЕА). В январе 2008 г. при очередном обследовании выявлено повышение уровня кальцитонина в крови до 1700 пг/мл, увеличение размеров шейного лимфоузла справа, по данным УЗИ и КТ, до 0,9 × 0,5 мм. При тонкоигольной пункции увеличенного лимфоузла обнаружена цитологическая картина медуллярного рака. По поводу метастаза в шейном лимфоузле справа выполнена операция – лимфаденэктомия шеи справа. Послеоперационное гистологическое исследование подтвердило метастатическое поражение лимфоузла МРЩЖ. После операции уровень кальцитонина снизился до 412 пг/мл. Впоследствии осуществлялось динамическое наблюдение с прежним объемом обследования.
В марте 2013 г. уровень кальцитонина увеличился до 1250 пг/мл. Диагностированы рецидив в ложе удаленной опухоли щитовидной железы и повторный метастаз в шейный лимфоузел справа.
7 апреля 2013 г. выполнена операция – удаление рецидива опухоли, лимфаденэктомия шеи справа. Иммуногистохимический анализ послеоперационного материала показал метастазы медуллярного рака в шейном лимфоузле и мягких тканях шеи. После операции уровень кальцитонина составил 775 пг/мл, CEA – 154.
В июле 2014 г. зафиксировано прогрессирование заболевания. Появились жалобы на болезненность в правой надключичной области. При обследовании уровень кальцитонина – 1055 пг/мл. Результаты КТ шеи, грудной клетки и брюшной полости показали метастаз в надключичном лимфоузле справа, подключичном лимфоузле справа, медиастинальных лимфоузлах, 11-м и 12-м грудных позвонках. Общее состояние пациентки удовлетворительное.
С 12 августа 2014 г. была начата таргетная терапия препаратом вандетаниб (Капрелса) в дозе 300 мг/сут. В качестве сопутствующей терапии назначен Панангин – одна таблетка три раза в день. На третий день приема вандетаниба отмечались боли за грудиной в течение пяти минут, прошли самостоятельно. На 12-й день приема на подбородке появились единичные высыпания, не требовавшие лечения.
Каждые две недели таргетной терапии проводились контроль клинического и биохимического анализов крови, электролитов крови (кальций, магний, калий), забор крови на гормоны (ТТГ, Т3, Т4), электрокардиограмма (ЭКГ). Каждые два месяца приема вандетаниба выполнялось контрольное обследование: УЗИ шеи, КТ шеи, грудной клетки и брюшной полости, анализ крови на гормоны (кальцитонин, ТТГ, Т3, Т4), СЕА. Дополнительной терапии не требовалось.
На 34-й день лечения из-за повышения артериального давления (АД) до 220 мм рт. ст. препарат временно отменили и назначили эналаприл 5 мг два раза в сутки.
На 37-й день терапии, согласно результатам ЭКГ, зафиксирована отрицательная динамика в виде усиления потенциалов левого желудочка, нарушения процессов реполяризации переднебоковой стенки левого желудочка. Перерыв в приеме вандетаниба составил 12 дней. Общее самочувствие улучшилось, ЭКГ – с положительной динамикой, АД стабильное. Продолжен прием вандетаниба 150 мг/сут на фоне эналаприла и Панангина.
Через два месяца терапии на контрольном обследовании при оценке опухоли по критериям RECIST констатирована стабилизация процесса.
В течение 7,5 месяца пациентка принимала вандетаниб 150 мг. Общее самочувствие удовлетворительное, ЭКГ – QT 0,38 мм/с, АД стабильное, нежелательных явлений на фоне применения сниженной дозы препарата не зарегистрировано.
В апреле 2015 г. уровень кальцитонина увеличился до 3732 пг/мл, хотя, согласно данным КТ шеи, грудной клетки и брюшной полости, стабилизация процесса сохранялась. Дозу вандетаниба увеличили до 200 мг/сут. Через две недели на фоне приема препарата в указанной дозе отмечалось снижение уровня кальцитонина до 1291 пг/мл. Общее самочувствие – без ухудшения, повышение АД до 140 мм рт. ст. Пациентка принимала эналаприл 10 мг два раза в сутки.
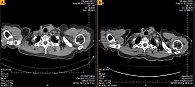
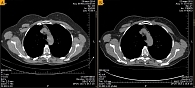
После 19-месячной терапии вандетанибом в марте 2016 г. зафиксирована положительная динамика – уменьшение размеров шейных лимфоузлов, снижение уровня кальцитонина до 1176 пг/мл, стабилизация очагов в костях. Согласно данным КТ, при оценке опухоли по критериям RECIST зарегистрирована частичная регрессия опухоли (рис. 1 и 2).
В апреле 2016 г. появились жалобы на жидкий стул до семи раз в день, повышение АД до 200 мм рт. ст. ЭКГ показала увеличение интервала QT до 0,43 мм/с. Вандетаниб временно отменили, перерыв в лечении составил 14 дней. После стабилизации состояния прием вандетаниба с коррекцией дозы 150 мг/сут был продолжен.
В декабре 2016 г. отмечалось незначительное увеличение уровня кальцитонина до 1910 пг/мл. КТ – без динамики по сравнению с исследованием в марте 2016 г.: частичная регрессия опухоли сохранялась. Дозу вандетаниба увеличили до 200 мг/сут. Через две недели уровень кальцитонина снизился до 1100 пг/мл.
В феврале 2017 г. после 30 месяцев таргетной терапии вандетанибом рентгенологически подтверждена частичная регрессия опухоли, масса тела пациентки стабильная, сохранялись жалобы на периодический жидкий стул и периодическое повышение АД до 140 мм рт. ст. Состояние по шкале ECOG – 1. Пациентка ведет активный образ жизни, продолжает работать. За два с половиной года терапии вандетанибом гематологической токсичности не зафиксировано, с негематологическими нежелательными явлениями удалось быстро справиться. Планируется продолжить терапию вандетанибом до прогрессирования по критериям RECIST с оценкой эффективности каждые два месяца.
Обсуждение
Рассмотренный клинический случай иллюстрирует потенциальный благоприятный эффект в отношении отдаленных результатов лечения при назначении вандетаниба в первой линии терапии метастатического МРЩЖ. Пациентка продолжает получать вандетаниб в течение двух с половиной лет. Отмечается частичная ремиссия. Данное лечение позволяет не только увеличить медиану общей выживаемости, но также значительно продлить время до прогрессирования, сохранить качество жизни и социальный статус больной.
Всем пациентам с установленным диагнозом МРЩЖ независимо от этиологии (спорадический, наследственный) в отсутствие данных об отдаленных метастазах показано хирургическое вмешательство с выполнением как минимум тиреоидэктомии с центральной лимфодиссекцией, при подозрении или доказанных метастазах в боковые лимфатические узлы шеи, верхнее средостение – радикальная лимфодиссекция в объеме пораженных уровней лимфоузлов [6]. Кроме хирургического лечения, возможности которого ограничены местной распространенностью и нерадикальностью вмешательства, до недавнего времени не существовало ни одного эффективного метода лечения с учетом слабой чувствительности медуллярной карциномы как представителя нейроэндокринных карцином к химиотерапии и дистанционной лучевой терапии [7]. При наличии отдаленных метастазов МРЩЖ, неоперабельных случаев местнораспространенного опухолевого процесса или высокого риска для жизни от хирургического вмешательства закономерно возникает вопрос о системной противоопухолевой терапии. Большие ожидания клиницисты возлагают на современные таргетные противоопухолевые препараты, позволяющие ингибировать ключевые киназные триггеры опухолевой активации [8]. Первым из них, подтвердившим эффективность и приемлемую безопасность в лечении больных МРЩЖ, согласно результатам клинических исследований фаз I–III, стал препарат вандетаниб (ZD6474) – низкомолекулярный ингибитор рецепторов тирозинкиназы: VEGFR2, EGRF и активности RET тирозинкиназы, в том числе RET-мутировавших онкопротеинов [9].
В рандомизированном плацебоконтролируемом клиническом исследовании фазы III (ZETA) у взрослых больных МРЩЖ на фоне приема 300 мг вандетаниба отмечалось увеличение периода без прогрессирования опухоли до 30 месяцев по сравнению с пациентами, получавшими плацебо, – 19 месяцев (относительный риск 0,46; 95%-ный доверительный интервал 0,31–0,69; p < 0,001). При этом 45% пациентов имели объективный ответ опухоли (регрессия) [5].
В работе S.A. Wells и соавт. показано, что подгруппа пациентов со спорадическим МРЩЖ и онкомутацией M918T RET лучше отвечала на лечение вандетанибом, чем те, у кого этой мутации не было [5].
Во время терапии вандетанибом необходимо следить за уровнем ТТГ, который иногда повышается. Увеличение дозы левотироксина с 91 ± 24 до 116 ± 24 мкг/м2/кг, как правило, позволяет нормализовать уровень ТТГ. Повышение уровня тиреотропина обычно не сопровождается уменьшением фракций периферических тиреоидных гормонов (Т3, Т4) ниже диапазона референсных значений нормы. Наиболее частыми побочными эффектами были диарея, кожная сыпь, тошнота и слабость. Токсичность также проявилась артериальной гипертензией, удлинением интервала QT на ЭКГ и повышением уровня ТТГ. Наиболее частыми побочными эффектами, в основном 1–2-й степени, требовавшими снижения дозы вандетаниба, были диарея (69%) и удлинение интервала QT на ЭКГ (68%). Необходимо отметить, что эти осложнения были выражены во время первого и второго цикла приема препарата, встречались в 3–6 раз реже и были менее выражены в третьем и последующих циклах [8].
Терапия вандетанибом удовлетворительно переносится и приводит к значительному увеличению выживаемости без прогрессирования и общей выживаемости по сравнению с другими методами лечения. В рассмотренном клиническом случае удалось сохранить качество жизни и социальный статус пациентки на протяжении всего периода лечения [5].
Заключение
На современном этапе вандетаниб является препаратом выбора при неоперабельном и прогрессирующем МРЩЖ. Лечение может осуществляться препаратом в дозе 300 мг/сут с непрерывным контролем возможных нежелательных побочных эффектов, регулярной оценкой объективного ответа опухоли на основании критериев RECIST и уровня специфических опухолевых маркеров в сыворотке крови (кальцитонин, СЕА) [8].
D.Yu. Yukalchuk, D.M. Ponomarenko, T.N. Yukalchuk, Ye.V. Snetkov, A.V. Shevchuk, Ye.A. Likhova
District Oncology Dispensary (Irkutsk)
Contact person: Denis Yuryevich Yukalchuk, dyuyu558@mail.ru
Here, a clinical case illustrating efficacy of vandetanib as a first line therapy for metastatic medullary thyroid carcinoma (MTC) characterized with agrressive clinical course is discussed. In half of the cases, this disease is diagnosed at late stage (III–IV) requiring systemic anti-cancer therapy. Due to a low efficacy and high toxicity of chemotherapy, tumor insensitivity to radiation therapy, great hopes are put on systemic targeted therapy with multikinase inhibitors. Among them, anti-tumor efficacy was first demonstrated for vandetanib in patients with progressive MTC. At present, vandetanib 300 mg/day is considered a prioritized approach for treatment of irresectable and progressive MTC.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.