Проблема спондилоартроза. Взгляд невролога
- Аннотация
- Статья
- Ссылки
- English
Введение
Боль в спине занимает первое место в мире среди медицинских причин снижения качества жизни населения. В России на долю пациентов с болью в спине приходится до 25% обращений на амбулаторном приеме. В то же время медицинская помощь при боли в спине плохо систематизирована и маршрутизирована. Пациенты, как правило, идут сначала к врачам первичного звена, а нередко, минуя их, к мануальным терапевтам и физиотерапевтам. Многие также обращаются к врачам вторичного звена, включая специалистов по консервативному (неврологов, ревматологов) и хирургическому (нейрохирургов, хирургов-ортопедов) лечению [1]. При этом отсутствуют единые общепринятые междисциплинарные стандарты ведения таких больных, что приводит к использованию разнообразных тактик и методов, не всегда научно обоснованных и эффективных.
Из лексикона неврологов практически исчез диагноз «остеохондроз позвоночника», под которым понимали дегенеративно-дистрофические изменения в позвоночном двигательном сегменте (с акцентом на патологии диска). Вместе с тем в практике терапевтов и ревматологов достаточно широко распространен термин «спондилоартроз», или «остеоартроз позвоночника», отражающий процесс хронического дегенеративного характера с поражением преимущественно синовиальных суставов позвоночника (фасеточных суставов и крестцово-подвздошного сочленения – КПС). В западной литературе как синоним часто используется термин «остеоартрит», что подчеркивает наличие воспалительного компонента [2–4].
В настоящее время боль в спине принято рассматривать в рамках биопсихосоциальной модели, предложенной G. Waddell (1987), в которой выделяют биологическую (анатомические источники боли), а также психологическую и социальную (отвечают за возникновение и поддержание боли) составляющие.
Согласно современной классификации, боли в спине подразделяются:
- на неспецифические;
- связанные с серьезной патологией (опухолями, травмами, инфекциями, аутоиммунными нарушениями и др.);
- обусловленные компрессионной радикулопатией.
Чаще всего (в 85% случаев) в клинической практике встречается неспецифическая боль, которая диагностируется при исключении серьезной патологии и корешковой симптоматики [5–10]. Однако термин «неспецифическая боль» неоднозначно трактуется и врачами, и пациентами, так как исключает анатомический субстрат боли [11].
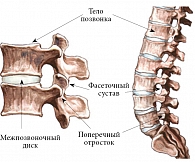
В ряде работ подчеркивается, что группа пациентов с неспецифической болью в спине гетерогенна и больные нуждаются в дифференцированном лечении, поэтому большее практическое значение имеет локализация источника боли в позвоночнике [12–15]. Позвоночник представляет собой сложную структуру, которую анатомически можно разделить на две части. Передняя состоит из цилиндрических тел позвонков, соединенных друг с другом межпозвоночными дисками и удерживающими их связками, задняя часть представляет собой дужки позвонков, которые сочленены со смежными позвонками дугоотростчатыми, или фасеточными, суставами. Стабильность позвоночного столба поддерживается системой связок и мышц (коротких и длинных). Два смежных позвонка с комплексом суставов, связок и мышц называют позвоночным двигательным сегментом (рисунок). Согласно постулатам, предложенным N. Bogduk (1991, 1997), источником («генератором») боли в спине могут быть различные структуры, включая межпозвоночные диски, суставы позвоночника (дугоотростчатые сочленения, КПС), связки и фасции, надкостница тел позвонков, твердая мозговая оболочка, спинномозговые корешки, мышцы [16]. В современных международных рекомендациях отказались от патоморфологического диагноза при боли в спине из-за неспецифичности патоморфологических изменений, отсутствия корреляции с клинической симптоматикой, невозможности в настоящее время проведения этиотропной терапии.
Термин «спондилоартроз» наиболее близок по смыслу к фасеточному синдрому и дисфункции КПС. В исследованиях, основанных на использовании малоинвазивных диагностических процедур, было выявлено, что в 25–42% случаев боли носили дискогенный характер, в 18–45% – фасеточный характер и в 10–30% случаев источником боли было КПС, при этом роль мышечного фактора вообще не упоминается. Дискогенные боли чаще отмечались у пациентов более молодого возраста и мужчин. В старших возрастных группах преобладали фасеточный синдром и патология КПС, которые соответствуют содержанию термина «спондилоартроз». Фасеточный синдром характерен для женщин с повышенным индексом массы тела, в то время как синдром КПС – для женщин с пониженным индексом массы тела [17, 18].
Фасеточный синдром
Определение. Патофизиология
Фасеточные, или дугоотростчатые, суставы (articulationes zygapophysiales) образуются верхним и нижним суставными отростками, имеют типичное строение и состоят из суставного хряща, синовиальной оболочки, синовиальной жидкости и капсулы. Это единственные полностью синовиальные суставы позвоночника, в них могут развиться патологические изменения, аналогичные изменениям в других периферических суставах при остеоартрозе.
Основная функция дугоотростчатых суставов – поддержка и стабилизация позвоночника при всех возможных в нем видах движений, при этом они подвергаются значительным нагрузкам. В норме 75–97% сжимающей нагрузки, приходящейся на поясничный отдел позвоночника, ложится на переднюю опорную площадку, а 3–25% – на задний опорный элемент [19]. Наибольшей перегрузке подвержены позвоночно-двигательные сегменты на уровнях L4-L5, L5-S1.
Снаружи сустав покрыт плотной капсулой, которая обеспечивает механическую защиту. При растяжении капсулы сустава на 20–47% (например, при спондилолистезе) возникают стойкие болевые ощущения [20].
Все структуры сустава, включая хрящ, субхондральные отделы кости, капсулу, синовиальную оболочку и менискоиды, богато иннервированы. Поясничный дугоотростчатый сустав иннервируется медиальными веточками первичной дорзальной ветви (как минимум с двух уровней), что необходимо учитывать при денервации – малоинвазивной процедуре, направленной на устранение боли [21].
Уменьшение высоты диска вследствие дегенеративно-дистрофических изменений приводит к увеличению нагрузки на фасеточные суставы на том же уровне с 3–25 до 47–70% и прогрессированию в них патологических изменений. Часто патологический процесс происходит асимметрично, что проявляется неравномерностью поражения фасеточных суставов [19, 22]. При разгибании нагрузка на дугоотростчатые суставы значительно возрастает и в норме. Нередко патология фасеточных суставов возникает в отсутствие изменений межпозвоночного диска [19, 22].
Остеоартрит (остеоартроз) представляет собой клинический исход патологического процесса в синовиальных суставах, который обусловливает их структурную и функциональную недостаточность. Этот процесс характеризуется повреждением суставного хряща, перестройкой субхондральных отделов кости, синовиальной воспалительной реакцией и разрастанием костной и хрящевой ткани [4, 23]. Воспалительный процесс (синовит) запускает механизм последующей дегенерации хряща. Имеются многочисленные доказательства того, что провоспалительные цитокины играют важную роль в формировании болевого синдрома и дегенерации хряща. В клинических исследованиях и на экспериментальных моделях было обнаружено повышение уровня провоспалительных интерлейкинов (1, 6, фактора некроза опухоли альфа), простагландина Е2, лейкотриена В и нейропептидов как в пораженных суставах, так и в близлежащих ганглиях задних корешков. Это может обусловливать дополнительное нейрогенное воспаление и появление невропатического компонента боли [24–32]. Интерлейкин 1 подавляет синтез хрящевого матрикса, что усугубляет процессы дегенерации хрящевой ткани и приводит к гиперэкспрессии матриксной металлопротеиназы 1, которая усиливает воспалительные и дегенеративные процессы в дугоотростчатых суставах [33]. A. Igarashi и соавт. (2007) установили, что уровень интерлейкина 1-бета в биоптатах хряща фасеточных суставов, полученных при нейрохирургическом вмешательстве, положительно коррелировал с выраженностью боли и снижением качества жизни [34].
Ущемление складок синовиальной оболочки (менискоидов) между суставными поверхностями может привести к субкапсулярным кровоизлияниям, физиологической дисфункции (блок сустава) и возникновению боли.
А. Goode и соавт. (2013) выявили статистически значимую зависимость между радиологическими изменениями (типичными для остеоартроза) в коленных, плечевых и дугоотростчатых суставах позвоночника. В то же время корреляция между изменениями периферических суставов и степенью дегенерации межпозвоночного диска не подтверждена. Межпозвоночный диск – не синовиальный сустав, в нем преобладают дегенеративные процессы, отличающиеся от таковых при поражении периферических синовиальных суставов [2].
Таким образом, в развитии патологии фасеточных суставов имеют значение несколько факторов: микро- и макротравматизация, усиление нагрузки на суставы при дегенерации диска, воспалительное поражение в виде артрита, сходного с поражением других периферических синовиальных суставов. Возможные механизмы возникновения боли включают растяжение капсулы сустава, ущемление складок синовиальной оболочки (менискоидов) между суставными поверхностями, воспаление внутри сустава.
Клиническая картина
Клинически фасеточный синдром характеризуется болью паравертебральной локализации, односторонней или двусторонней, которая может иррадиировать в ногу, чаще до уровня колена. Боль усиливается при значительном разгибании и уменьшается при сгибании, часто возникает после эпизодов длительной неподвижности и уменьшается при движении. Возможна утренняя тугоподвижность [35–38].
Предложена формализованная шкала для оценки возможности участия дугоотростчатых суставов в развитии боли:
- боль в спине, иррадиирующая в ягодицу или бедро (+30 баллов);
- локальная болезненность в проекции фасеточных суставов (+20 баллов);
- воспроизводимость боли при экстензии с ротацией (+30 баллов);
- значимые нейровизуализационные изменения в области фасеточных суставов (+20 баллов);
- боль, иррадиирующая ниже колена (-10 баллов).
У всех пациентов, набравших 60 и более баллов, отмечался выраженный положительный эффект при последующих блокадах фасеточных суставов. По мнению ряда авторов, подобная концепция может быть полезна для диагностики и лечения фасеточного синдрома.
Для фасеточного синдрома не характерны симптомы натяжения и выпадения (двигательные, чувствительные расстройства, изменение рефлексов, тазовые нарушения). Переразгибание позвоночника или сочетание разгибания с ротацией обычно провоцирует боль, исходящую из фасеточных суставов. Имеет значение клиническое исследование подвижности в поясничном отделе и усиление боли при глубокой пальпации в проекции фасеточных суставов – одного из наиболее информативных тестов. Рекомендуется проводить пальпацию в положении сидя (с наличием осевой нагрузки на позвоночник) и лежа на животе (в условиях отсутствия осевой нагрузки), что позволяет исключить влияние мышечного тонуса. Тест Кемпа (сочетание экстензии, ротации и бокового сгибания, приводящее к повышенной нагрузке на фасеточные суставы) не обладает достаточной специфичностью и может быть полезен как дополнительный метод диагностики [39].
Нейровизуализационные признаки
К классическим рентгенологическим признакам остеоартроза фасеточных суставов относятся как дегенеративные, так и пролиферативные изменения, в том числе сужение суставной щели, субартикулярные эрозии, субхондральные кисты, формирование остеофитов, гипертрофия суставных отростков. Рентгенологические критерии оценки указанных проявлений первоначально были разработаны для рентгенографии, а затем адаптированы для компьютерной (КТ) и магнитно-резонансной (МРТ) томографии. КТ превосходит МРТ в диагностике патологии костей, МРТ позволяет лучше визуализировать изменения в мягких тканях. Результаты КТ соответствуют результатам МРТ. Оценка изменений в дугоотростчатых суставах проводится по КТ-критериям, разработанным M. Pathria и соавт. (1987), и сходным МР-критериям, предложенным D. Weishaupt и соавт. (1999). Выделяют четыре степени поражения:
- степень 0, норма. Однородный хрящ и нормальная (2–4 мм) ширина суставной щели;
- степень 1. Легкие дегенеративные изменения: сужение суставной щели (< 2 мм) и/или небольшие остеофиты и/или незначительная гипертрофия суставного отростка;
- степень 2. Умеренные дегенеративные изменения: сужение суставной щели (< 1 мм) и/или умеренные остеофиты и/или субхондральные эрозии;
- степень 3. Тяжелые дегенеративные изменения: сильное сужение суставной щели, крупные остеофиты и субхондральные эрозии/кисты [40, 41].
В дополнение к классическим рентгенологическим признакам остеоартроза фасеточных суставов в последнее время стала применяться МРТ с подавлением сигнала от жира, более чувствительная к содержанию жидкости по сравнению с традиционными методами. Это позволило лучше оценивать изменения в фасеточных суставах и окружающих тканях. Субхондральные изменения костного мозга по типу отека, часто выявляемые при коленном остеоартрозе и ассоциированные с такими клиническими симптомами, как боль и морфологические изменения, отмечаются и в фасеточных суставах. Современные исследования позвоночника с помощью МРТ с подавлением сигнала от жира показали, что субхондральные изменения костного мозга обнаруживаются в суставных отростках поясничных фасеточных суставов у 14–41% пациентов с болью в пояснице.
В пилотных исследованиях была предположена связь между субхондральными изменениями костного мозга фасеточных суставов и наличием и локализацией боли в пояснице. Нейровизуализационные признаки остеоартроза фасеточных суставов могут быть полезны для дифференциальной диагностики фасеточного синдрома со специфическими воспалительными поражениями позвоночника. Дополнительные признаки остеоартроза фасеточных суставов (экссудат в фасеточных суставах, отек межостистой связки и периартикулярный отек) также могут диагностироваться с помощью МРТ с подавлением сигнала от жира, но указанные изменения в настоящее время не включены в шкалы для оценки остеоартроза фасеточных суставов [4].
На основании данных нейровизуализации невозможно определить основной источник боли в спине. В кросс-секционном исследовании в подгруппе участников Фреймингемского проекта оценивали соотношение состояния фасеточных суставов поясничного отдела (на основании КТ-критериев М. Pathria) и болевого синдрома в пояснице (с использованием Скандинавского опросника) у 188 пациентов: 104 мужчин (средний возраст 51,90 года) и 84 женщин (средний возраст 53,61 года). Нейровизуализационные изменения выявлены у 59,6% мужчин и 66,7% женщин. Частота изменений увеличивалась с возрастом, достигнув максимума (89,2%) у пациентов 60–69 лет. Самым частым уровнем поражения был уровень L4-L5, затем L5-S1, L3-L4 и L2-L3 соответственно. Несмотря на то что у пациентов с болью в спине часто обнаруживались изменения фасеточных суставов (достигая в некоторых подгруппах 100%), сходные изменения были выявлены и среди пациентов без боли в спине. Статистически значимой связи развития боли в поясничном отделе и КТ-изменений дугоотростчатых суставов обнаружено не было [3].
A. Maataoui и соавт. (2014) изучили корреляцию между выраженностью морфологических изменений в дугоотростчатых суставах по данным МРТ и функциональным состоянием, которое оценивалось по индексу Освестри (n = 591, средний возраст 47,3 года). В общей сложности было оценено 2364 фасеточных сустава. Авторы пришли к выводу о невозможности установления диагноза только на основании данных нейровизуализации. Они должны быть правильно интерпретированы с учетом клинической симптоматики [42]. По данным Т. Mainka и соавт. (2013), сочетание провокационных пальпаторных тестов (перкуссии, пружинистого давления и ротационного сегментарного теста) и МР-изменений в виде выпота в дугоотростчатых суставах может быть информативно в диагностике фасеточного синдрома [43].
Диагностические блокады
Наибольшую диагностическую ценность (уровень доказательности А) имеет блокада медиальных ветвей, выполненная под рентгенологическим контролем [44, 45]. Перед выполнением блокады оценивают исходный уровень интенсивности боли. Пораженный сустав визуализируют рентгенологически, маркируют кожу в проекции сустава. После локальной анестезии места инъекции вводят иглу под рентгенологическим контролем в направлении соединения верхнего суставного отростка и поперечного отростка, проводят аспирационную пробу для исключения попадания в сосуд, затем вводят 0,2 мл 2%-ного раствора лидокаина. Через 20 минут оценивают интенсивность боли у пациента. Ответ на блокаду коррелирует с результатами последующего лечения. Ложноположительный ответ встречается в среднем в 17–47% случаев, при сомнительном результате возможно проведение пробы с плацебо. Другой вариант – последующая блокада с бупивакаином. Результаты блокады считаются положительными при уменьшении боли на 80% и увеличении объема движения в позвоночнике (при сгибании, разгибании, латерофлексии, ротации).
Крестцово-подвздошное сочленение
Определение. Патофизиология. Факторы риска
Другой частый источник боли в поясничном отделе, поражение которого может быть обусловлено остеоартрозом, – КПС. Это своеобразный сустав: частично типичный синовиальный (диартроз – передние 30–50% сочленения), а частично неподвижный хрящевой синостоз. Объем движений в КПС ограничен, его основная функция – опорная. КПС поддерживает верхнюю часть тела и уменьшает нагрузку при ходьбе. Сустав укреплен связками, ограничивающими его подвижность: передней и задней крестцово-подвздошной, крестцово-остистой, крестцово-бугорной и межостистой. КПС взаимодействует с мышцами и фасциями, в том числе грудопоясничной фасцией, большой ягодичной, грушевидной мышцами и широчайшей мышцей спины [46]. Согласно W. King и соавт. (2015), правильнее говорить не о КПС, а о «крестцово-подвздошном комплексе», который включает собственно сустав и поддерживающие его связки, при этом каждый из элементов может стать источником боли [47].
Иннервация КПС сложна. По данным иммуногистохимических исследований, ноцицепторы расположены во всей суставной капсуле, связках и в меньшей степени – в субхондральной кости. Предполагается, что повреждение любой из этих структур может вызвать боль. Типичный паттерн боли был предметом экспериментальных исследований у бессимптомных добровольцев при растяжении капсулы и раздражении связок. Задняя поверхность сустава лучше изучена и является основным объектом интервенционных методов лечения (блокады, денервация). Она иннервируется в основном из дорзальных ветвей S1-S3 корешков, иногда дополнительно от корешков L5 и S4 [46].
Среди внутрисуставных причин боли чаще остальных отмечаются артрозо-артрит и спондилоартропатии, внесуставных – повреждения связок и мышц, а также энтезопатии.
Термин «дисфункция» подразумевает дегенеративные изменения КПС в отсутствие специфических факторов поражения (опухолей, переломов, септического или аутоиммунного воспаления и т.п.). Повреждения КПС возникают при комбинации неадекватной осевой нагрузки и вращения и характеризуются изменением подвижности в суставе: блокированием сустава или микронестабильностью, что ведет к неадекватным, стрессовым нагрузкам на окружающие ткани (капсулу, связки, мышцы, кости) [48]. В то же время в исследованиях с применением рентгеновской стереофотометрии не выявлено корреляции между развитием болевого синдрома и объемом движения в суставе [49]. Кроме того, КПС может быть зоной отраженной боли при поясничных грыжах диска, заболеваниях органов малого таза (прежде всего при гинекологической патологии).
К боли в КПС предрасполагают следующие факторы:
- возраст (чаще встречается у лиц пожилого возраста и молодых спортсменов);
- асимметрия длины ног;
- аномалии строения, походки и биомеханики, сколиоз;
- длительное напряжение (например, бег трусцой) или травмы;
- беременность;
- предшествующие операции на позвоночнике (особенно спондилодез).
В 40–50% случаев развитие боли связано с конкретным провоцирующим фактором, часто боли в КПС возникают в результате дорожно-транспортных происшествий, падений, после повторяющихся нагрузок и при беременности [50, 51].
Клиническая диагностика
Боль обычно носит односторонний латерализованный характер в проекции КПС. Наиболее специфична для поражения КПС так называемая зона Fortin размером приблизительно 3 × 10 см, которая располагается непосредственно книзу от задней верхней подвздошной ости [52].
Дисфункция КПС часто имитирует корешковые поражения. Клинические наблюдения и артрографические исследования с участием здоровых добровольцев показали, что в 94% случаев болевые ощущения иррадиируют в область ягодиц, в 72% – в нижнепоясничную область, в 50% – по задненаружной поверхности бедра, включая 28% с иррадиацией боли ниже колена и 12% – до стопы. У 14% пациентов боль распространяется в паховую область, у 6% – в верхние отделы поясничной области, у 2% – в живот [52, 53].
Боли усиливаются при вставании из положения сидя, наклонах, длительном сидении или стоянии. В блокированном КПС нарушается подвижность подвздошной кости относительно крестца, что проверяется попеременным надавливанием на крестец и подвздошную кость у пациента, лежащего на животе. Характерна болезненность при пальпации КПС с воспроизведением типичного паттерна боли. Отсутствует опускание задней верхней ости при подъеме ноги в положении стоя на стороне блока КПС. Симптомов выпадения не наблюдается, болевые ощущения усиливаются в трех или более провокационных тестах на сжатие или растяжение этого сустава [48, 54].
Единого мнения по поводу ценности физикального осмотра в диагностике дисфункции КПС нет. Р. Dreyfuss и соавт. (1996) отмечали ненадежность истории заболевания и диагностических тестов при боли в КПС, подтвержденной положительным ответом на блокаду как эталонным стандартом [55]. По мнению других исследователей, использование батареи провокационных тестов может быть информативным для выявления боли в КПС. По результатам слепого исследования оценки валидности клинического тестирования М. Laslett и соавт. (2005), три из шести провокационных тестов характеризовались 94%-ной чувствительностью и 78-ной специфичностью в прогнозировании положительного ответа на однократную диагностическую блокаду КПС [56]. По данным P. Van der Wurff и соавт. (2006), чувствительность и специфичность трех положительных из пяти провокационных тестов составили 85 и 79% соответственно (в качестве диагностического стандарта также использовалась двойная диагностическая блокада) [57]. Считается, что провокационные тесты более надежны, чем тесты измерения объема движений для идентификации боли в КПС [56, 57]. Таким образом, три или более положительных провокационных тестов позволяют говорить о достаточной чувствительности и специфичности результатов в определении пациентов, которые будут иметь положительный ответ на диагностические блокады КПС [58].
Стандартом для установления диагноза остаются блокады с введением малых объемов местных анестетиков. Подтверждением патологии КПС в развитии боли служит ее исчезновение или существенное уменьшение после блокады сустава растворами местных анестетиков под рентгенологическим или ультразвуковым контролем [59]. Блокады без контроля связаны с высокой частотой ложноположительных ответов, а использование контролируемых блокад повышает вероятность ложноотрицательных результатов, но не влияет на результаты последующего лечения.
Инструментальная диагностика
Радиологическое исследование не имеет диагностической значимости и показано только при наличии «красных флажков».
КТ считается золотым стандартом для выявления костной патологии. В ретроспективном исследовании с участием 112 пациентов Н. Elgafy и соавт. (2001) выяснили, что КТ имела чувствительность 57,5% и специфичность 69% (при использовании диагностических блокад в качестве стандарта) [60].
C.W. Slipman и соавт. (1996) установили 100%-ную специфичность, но только 13%-ную чувствительность для радионуклидного исследования (n = 50, сравнение проводилось с диагностическими блокадами анестетиками) [61]. J. Maigne и соавт. (1998) сообщали о 46,1%-ной чувствительности и 89,5%-ной специфичности этого метода (n = 32) [62].
Таким образом, низкие значения чувствительности радионуклидных методов исследования не позволяют рекомендовать их для скрининга причины боли в КПС. Сообщается, что МРТ эффективна в обнаружении спондилоартропатий уже на ранней стадии с чувствительностью, превышающей 90%, но не имеющей пользы для диагностики невоспалительных состояний [63].
Лечение
Общие рекомендации
В настоящее время большинство методов лечения направлено на уменьшение симптомов и функциональных нарушений, обусловленных поясничной болью, без учета механизмов, лежащих в основе анатомических и функциональных изменений в виде дегенерации позвоночника, и их связи с клиническими проявлениями. Доказанное этиопатогенетическое лечение спондилоартроза в настоящее время отсутствует. Эффективность так называемых хондропротекторов не подтверждена [1, 64, 65].
Лечение фасеточного синдрома и синдрома КПС начинают в соответствии с общими принципами ведения неспецифической боли в спине, согласно международным клиническим руководствам. Недавно опубликованы обновленные рекомендации Национального института здравоохранения и усовершенствования медицинского обслуживания Великобритании (National Institute for Health and Care Excellence – NICE, 2016), Американской коллегии врачей общей практики (American College of Physicians – ACP, 2017) и Онтарийский протокол по контролю дорожно-транспортного травматизма (Ontario Protocol for Traffic Injury Management – OPTIMa) (Канада, 2016).
В новых рекомендациях NICE (2016) по лечению люмбалгии и люмбоишиалгии у взрослых пациентов предлагается оценивать риск неблагоприятного исхода для определения последующей тактики лечения уже на ранних стадиях заболевания (например, с помощью опросника Keele STarT Back Screening Tool – SBST). Формирование правильных представлений пациента о заболевании, ранняя активизация, стратегии преодоления способствуют более быстрому и эффективному восстановлению. В группе высокого риска неблагоприятного прогноза следует дополнительно проводить индивидуальные занятия лечебной физкультурой в комбинации с психологическими методиками, мануальной терапией. Проведение нейровизуализации не рекомендуется даже при признаках радикулопатии. Она может быть полезна на этапе специализированной помощи и только в том случае, когда результаты исследования способны изменить тактику лечения. Необходимо исключить специфические причины развития поясничной боли. Следует разъяснить пациенту природу его заболевания, сообщить о благоприятном прогнозе и рекомендовать сохранение повседневной активности. Важно мотивировать пациента как можно раньше возобновить трудовую деятельность. Подтвержден положительный эффект различных программ групповых упражнений (биомеханические, аэробика, релаксационные упражнения или их комбинация) с учетом предпочтений и индивидуальных возможностей. Не показано использование специальных поясов и корсетов, а также ортопедических стелек и обуви. Следует также отказаться от вытяжения, ультразвука, электростимуляции нервов, терапии интерференционными токами. Приоритет имеет комплексный подход, который должен включать занятия лечебной физической культурой и/или мануальную терапию, а также психологическую реабилитацию с применением когнитивно-поведенческой терапии. Последняя имеет особенно важное значение, если существуют психосоциальные аспекты, препятствующие восстановлению (например, ложные убеждения в отношении причины своего заболевания, мешающие придерживаться привычной двигательной активности), а также при неэффективности лечения. Показано назначение пероральных форм нестероидных противовоспалительных средств (НПВП) с учетом возможных осложнений и индивидуальных особенностей пациента (например, возраста), в минимальной эффективной дозировке, на максимально короткий срок и в сочетании с гастропротекторами. При этом следует оценивать клиническую эффективность НПВП, непрерывно контролировать возможное развитие побочных эффектов. Не следует применять парацетамол в монотерапии для лечения поясничной боли. Слабые опиоиды (с парацетамолом или без) можно назначать для купирования острой боли в поясничной области только при противопоказаниях к НПВП, их неэффективности или индивидуальной непереносимости. Наркотические обезболивающие препараты не показаны для лечения хронического болевого синдрома в поясничной области. Применение селективных ингибиторов обратного захвата серотонина, ингибиторов обратного захвата серотонина-норадреналина, трициклических антидепрессантов для лечения боли в поясничной области, а также противосудорожных средств для лечения люмбалгии при отсутствии корешковой симптоматики не рекомендуется. Кроме того, в настоящее время при неспецифической люмбалгии нет убедительных доказательств использования блокад [66].
Обновленные клинические рекомендации ACP (2017) по неинвазивному лечению острой, подострой и хронической поясничной боли несколько отличаются от европейских рекомендаций. При острой боли следует отдавать предпочтение немедикаментозным методам: поверхностному тепловому воздействию, массажу, акупунктуре, мануальной терапии (невысокий уровень доказательности). Среди медикаментозных средств показаны НПВП, миорелаксанты. Лечение хронической поясничной боли также целесообразно начинать с нелекарственных методов: гимнастики, мультидисциплинарной реабилитации, акупунктуры, техники снижения стресса путем осознанной концентрации внимания (умеренный уровень доказательности), тай чи, йоги, упражнений на двигательный контроль, прогрессивной релаксации, биологической обратной связи с электромиографией, низкоэнергетического лазера, поведенческой терапии, когнитивно-поведенческой терапии, мануальной терапии. При недостаточной эффективности немедикаментозных подходов следует перейти к лекарственной терапии: НПВП (в качестве препаратов первой линии), трамадол или дулоксетин (препараты второй линии). Опиоиды назначаются в виде исключения при условии, что потенциальная польза превосходит риски [67].
В соответствии с протоколом OPTIMa (2016), на основании анализа и синтеза 13 клинических руководств, изданных в течение последних лет, наибольшей степенью доказательности обладают следующие рекомендации по неинвазивной терапии поясничной боли:
- всем пациентам с острой или хронической болью в поясничной области следует сообщить о причинах заболевания, благоприятном прогнозе и мерах по уменьшению болевого синдрома в домашних условиях;
- пациенты с острой болью должны быть мотивированы на сохранение повседневной двигательной активности. Применение НПВП и/или спинальных манипуляций обеспечивает улучшение состояния этих пациентов;
- лечение хронической поясничной боли должно включать упражнения, прием НПВП или парацетамола, акупунктуру, мануальную терапию и мультимодальную реабилитацию (в виде комбинации физических и психологических методик лечения).
В целом большинство руководств по лечению неспецифической боли в спине рекомендуют проведение образовательных программ для пациентов, сохранение активности, гимнастику, мануальную терапию и прием НПВП в качестве препаратов первой линии [68].
Применение нестероидных противовоспалительных препаратов
В систематическом Кохрановском обзоре (2016) была подтверждена эффективность НПВП в уменьшении боли и степени нарушений функций при хронической поясничной боли. Различий в уменьшении боли при использовании разных групп НПВП не получено [69]. Возможно применение как селективных, так и неселективных НПВП, которые сравнимы по своей эффективности, при этом селективные ингибиторы циклооксигеназы 2 оказывают меньшее негативное влияние на желудочно-кишечный тракт.
Одним из высокоселективных ингибиторов циклооксигеназы 2 является эторикоксиб (Аркоксиа®). Клинические испытания показали хорошую переносимость препарата. Коксибы – препараты выбора у пациентов, имеющих риск развития язвенной болезни желудка и двенадцатиперстной кишки. При пероральном приеме эторикоксиб оказывает быстрое и мощное обезболивающее действие. В настоящее время для лечения хронической боли доступны дозировки эторикоксиба 30, 60, 90 мг, для лечения острой боли – 120 мг. Обезболивающий эффект наступает уже через 24 минуты после приема препарата и сохраняется в течение 24 часов, что обеспечивает удобство применения (одна таблетка в сутки) [70]. По данным Оксфордской таблицы эффективности анальгетиков, эторикоксиб в дозировке 100–120 мг признан самым эффективным анальгетиком в отношении купирования острой боли. Эффективность анальгетических препаратов оценивалась с помощью эпидемиологического расчетного показателя NNT (среднее число пациентов, которых необходимо пролечить, чтобы достичь определенного благоприятного исхода или предотвратить один неблагоприятный исход), который у эторикоксиба составлял 1,6. Для сравнения: NNT у кеторолака 60 мг в/м – 1,8, у ибупрофена 400 мг – 2,7 и у целекоксиба 200 мг – 3,5 [71].
Назначая НПВП пациентам с болью в спине, обусловленной остеоартрозом суставов позвоночника, следует учитывать тот факт, что, как правило, это люди пожилого возраста, которые имеют сопутствующие заболевания и уже получают другие препараты, например сердечно-сосудистые. В этом случае также оправдан выбор эторикоксиба [72]. Согласно метаанализу 17 исследований, прием эторикоксиба не повышал риск сердечно-сосудистых событий по сравнению с плацебо и напроксеном. По данным метаанализа десяти исследований, частота серьезных осложнений со стороны желудочно-кишечного тракта при приеме эторикоксиба была в два раза меньше по сравнению с традиционными НПВП. Кроме того, эторикоксиб – препарат, который принимается раз в сутки, что обеспечивает более высокую приверженность к терапии и в определенной степени позволяет избежать полипрагмазии.
Эторикоксиб имеет обширную доказательную базу по эффективности при хронической боли в нижней части спины у пациентов со спондилоартрозом. В высоко доказательных рандомизированных контролируемых исследованиях длительностью от четырех до 12 недель показана эффективность эторикоксиба по сравнению с плацебо у пациентов с этой патологией. Хроническая боль эффективно купировалась уже через семь дней терапии, а эффект сохранялся на протяжении трехмесячного курса и приводил к значимому улучшению физического функционирования и качества жизни [73]. По данным другого исследования, эторикоксиб 60 мг/сут не уступал по эффективности диклофенаку 150 мг/сут при боли в нижней части спины, вызванной спондилоартрозом [74].
Эффективность эторикоксиба хорошо изучена при остеоартрозе. Эторикоксиб в дозе 30 и 60 мг/сут и длительностью приема от шести до 12 недель продемонстрировал эффективность, достоверно большую по сравнению с плацебо (уменьшение баллов по Индексу выраженности остеоартроза, разработанному университетами Западного Онтарио и МакМастера (WOMAC) в отношении боли и функционирования) и равноценную эффективности терапевтических доз диклофенака, ибупрофена, напроксена и целекоксиба [75].
В рандомизированном исследовании с участием пациентов с остеоартрозом и хронической болью эторикоксиб в отличие от других НПВП продемонстрировал комплексный двойной механизм действия. Он выражался в подавлении синтеза провоспалительных простагландинов не только на периферии в очаге воспаления/повреждения, но и на уровне центральной нервной системы, предотвращая развитие феномена сенситизации нейронов спинного мозга и блокируя центральные механизмы хронизации боли [76]. Вышеописанный механизм действия эторикоксиба, возможно, объясняет высокую эффективность этого препарата у большинства больных с хронической болью даже в тех случаях, когда другие НПВП при длительном приеме оказываются недостаточно эффективными [77].
Интервенционные методы
Блокады применяются при отсутствии результатов традиционной консервативной терапии, развитии побочных эффектов системного лечения, желании пациента, усилении боли.
Имеются противоречивые данные об использовании интервенционных методов лечения неспецифической боли в спине. Так, в рекомендациях Американского общества боли (American Pain Society) и европейских рекомендациях (COST B13 Guide, NICE) не показано использование блокад и малоинвазивных нейрохирургических вмешательств, включая различные варианты радиочастотной денервации [9, 10, 66, 78]. В то время как Американское общество интервенционных методов лечения боли (American Society of Interventional Pain Physicians) опубликовало несколько систематических обзоров с метаанализом и клинические рекомендации с доказательством эффективности и безопасности этих методов лечения [79]. Как внутри-, так и внесуставное введение стероидов может обеспечить кратковременное облегчение в подгруппе пациентов с активным воспалением, но их длительный эффект остается недоказанным.
В обзоре H. Chambers (2013) подтверждена эффективность блокад фасеточных суставов, массажа и упражнений лежа, при этом эффективность мануальной терапии не определена [80].
Наиболее эффективными методами лечения фасеточного синдрома считаются внутрисуставные блокады, периартикулярные блокады нервов и хирургическая деструкция нервов. Интервенционные методы лечения могут обсуждаться у пациентов с фасеточным синдромом без признаков радикулопатии, у которых боли и нарушение нормальной жизнедеятельности сохраняются свыше трех месяцев и не поддаются лечению стандартными медикаментозными и физиотерапевтическими методами [81].
В систематическом обзоре F.J. Falco и соавт. (2012) из 122 исследований было отобрано 11 рандомизированных и 14 обзорных. На основании анализа этих данных сделан вывод о высокой доказательности эффективности стандартной высокочастотной денервации и блокад нервов фасеточных суставов в долгосрочном и краткосрочном периоде в отношении уменьшения боли и функционального восстановления. Доказательства эффективности интраартикулярного введения глюкокортикостеридов и пульсовой радиочастотной термокоагуляции нервов ограничены [82]. Их эффективность в лечении фасеточного синдрома была показана в рандомизированном контролируемом исследовании, при этом интраартикулярное введение было эффективнее системного применения [83].
У пациентов со значительным, но кратковременным облегчением боли после блокад возможно использование радиочастотной аблации нижнепоясничных дорзальных ветвей и латеральных ветвей, которая может обеспечить облегчение боли продолжительностью до года. Денервация – это малоинвазивное оперативное вмешательство, позволяющее осуществить деструкцию нервных окончаний с целью быстрого уменьшения болевого синдрома. Радиочастотная денервация основана на принципе термокоагуляции. Данный метод зарекомендовал себя как высокоэффективный, имеющий широкий спектр показаний, практически лишенный осложнений. Высокочастотная невротомия проводится в стерильных условиях под рентгенологическим контролем или КТ. Радиочастотная денервация осуществляется через микропрокол с минимальной травматизацией прилегающих и обрабатываемых тканей. Установлена эффективность радиочастотной деструкции фасеточных суставов [84].
В то же время имеются данные о неэффективности блокад в лечении фасеточного синдрома. Так, R. Chou и соавт. в интернет-обзоре (2015), анализируя 13 исследований, не отметили отличий между плацебо и различными вариантами блокад дугоотростчатых суставов [85].
В систематическом обзоре D. Kennedy и соавт. (2015) оценивали эффективность лечения дисфункции КПС методом блокад под рентгенологическим контролем. Проанализировано 50 работ, отобрано два рандомизированных плацебоконтролируемых исследования и одно крупное обсервационное. Сделан вывод об эффективности блокад в лечении синдрома КПС (уровень доказательности В) [86].
В других исследованиях была продемонстрирована эффективность как интра-, так и периартикулярных блокад [45]. В обзоре L. Manchikanti (2013) было показано, что в лечении дисфункции КПС эффективны внутрисуставные и периартикулярные блокады (уровень С), а также радиочастотная деструкция с охлаждаемым электродом (уровень доказательности В) [79].
Имеются единичные работы невысокого качества об эффективности пролотерапии (или пролиферативной терапии). Пролотерапия подразумевает инъекции таких растворов, как декстроза и обогащенная тромбоцитами плазма, вокруг сухожилий или связок, в попытке укрепления соединительной ткани и уменьшения скелетно-мышечной боли. Предполагается, что таким образом инициируется воспалительный процесс, который приведет к повышению кровотока и ускорению восстановления тканей [87].
В голландском научно обоснованном руководстве по применению инвазивных методик лечения боли в спине (2015) отмечено, что блокады с глюкокортикостероидами могут быть рекомендованы в случае неэффективности консервативной терапии дисфункции КПС. Радиочастотная деструкция проводится при неэффективности блокад с глюкокортикостероидами [15]. При неэффективности консервативной терапии и малоинвазивных методов лечения обсуждается возможность операций на КПС с использованием стабилизирующих систем [88, 89].
На базе клиники нервных болезней им. А.Я. Кожевникова проведено исследование с целью определения основного источника боли при неспецифической люмбалгии для последующего лечения с использованием малоинвазивных манипуляций. Наблюдались 82 пациента (35 мужчин и 47 женщин, средний возраст 50,9 ± 2,53 года). Диагностика основного источника боли основывалась на данных нейроортопедического обследования, которое выполняли два независимых эксперта. Клинические тесты подтверждались данными нейровизуализации, результатами диагностических блокад. Для оценки интенсивности болевого синдрома использовали Визуальную аналоговую шкалу, для оценки степени нарушения жизнедеятельности – опросник Освестри. Для выявления сопутствующих тревожных и/или депрессивных расстройств – Госпитальную шкалу тревоги и депрессии. Качество жизни оценивалось по шкале SF-12, невропатический компонент боли – по шкале DN4. Проводилось динамическое наблюдение, повторная оценка перечисленных показателей осуществлялась через три месяца после лечения. В качестве скрининга для определения тактики лечения применялся тест риска хронизации боли. Интенсивность боли до лечения составила 5,95 ± 2,1 балла, индекс Освестри – 39,7 ± 2,80 балла, уровень депрессии – 6,19 ± 0,6 балла, уровень тревожности – 5,8 ± 0,6 балла. Физическая составляющая качества жизни – 44,05 ± 0,95 балла, психологический компонент качества жизни – 46,6 ± 1,75 балла. По данным SBST, 26,7% пациентов имели высокий риск хронизации, 36,3% – средний и 37% – низкий риск. Невропатические боли были выявлены у 25,6% пациентов с неспецифической поясничной болью. Неожиданно высокой оказалась частота синдрома КПС (53%), в том числе в сочетании с патологией тазобедренного сустава (3,6%), синдромом грушевидной мышцы (4,8%). Фасеточный синдром отмечался в 32% случаев и дискогенные боли – в 15%.
Одна группа пациентов (n = 49, средний возраст 44,8 ± 2,7 года) была пролечена консервативно с использованием блокад местными анестетиками и глюкокортикостероидами (Дипроспан) в зависимости от основного источника боли (периартикулярные для фасеточных суставов и КПС или эпидуральные при дискогенной боли). Вторая группа (n = 33, средний возраст 57,6 ± 3,16 года) с фасеточным синдромом и дисфункцией КПС – методом высокочастотной денервации. Группы достоверно отличались по возрасту, степени нарушения трудоспособности (33,04 ± 2,8 и 46,5 ± 2,5 балла соответственно), показателям качества жизни (р < 0,01). При оценке результатов через три месяца отмечалось выраженное достоверное уменьшение болевого синдрома у 95% пациентов, в первой группе в среднем на 60% (р < 0,001), во второй – на 32% (р < 0,001). Показатели степени нетрудоспособности достоверно уменьшились в обеих группах (в первой на 39%, во второй на 29%, р < 0,05). Общий показатель Госпитальной шкалы тревоги и депрессии снизился на 30% в группе, получавшей консервативную терапию, и на 23% в группе радиочастотной денервации (р < 0,05). Определялась отчетливая тенденция к улучшению показателей (как физических, так и психологических) качества жизни. Сделан вывод о том, что дифференцированный подход в оценке основного источника боли при неспецифической люмбалгии и последующее таргетное воздействие с использованием методов интервенционной медицины обеспечивают хороший результат в виде уменьшения болевого синдрома, улучшения жизнедеятельности, психоэмоционального статуса.
A.I. Isaykin, O.S. Davydov, A.V. Kavelina, M.A. Ivanova
I.M. Sechenov First Moscow State Medical University (Sechenovskiy University)
Scientific and Practical Psychoneurological Center named after Z.P. Solovyov
Contact person: Aleksey Ivanovich Isaykin, alexisa68@mail.ru
In the practice of internists and rheumatologists it is being commonly used the term ‘spondylosis’ or ‘steoarthritis of the spine’, reflecting the process of chronic degenerative nature involving primarily the synovial joints of the spine (facet joints and sacroiliac joint). Most neurologists consider these conditions as non-specific back pain. Nowadays biopsychosocial model of back pain is currently accepted, according to which there are biological (anatomical sources of pain), psychological and social components contributing to its emergence and maintenance. The group of patients with nonspecific low back pain is heterogeneous, and such patients require the differentiated treatment. Among the most common sources of back pain are pathologically changed discs, facet joints and sacroiliac joint. Definition of the pain main source is difficult because of the insufficient validity of tests used. Facet joints are the only typical synovial joints of the spine. In the development of pathology a number of factors are of importance: micro- and macrotrauma, increased load on the joints with disc degeneration, inflammatory damage in the form of arthritis, similar to the defeat of the other peripheral synovial joints. Facet syndrome is prevalent in older age groups, more often in women with increased body mass index. The sacroiliac joint is a sort of joint: partly typical synovial one and partly immobile cartilaginous synostosis. Pain in the sacroiliac joint is more common in young athletes and the elderly. Three or more positive provocation tests allow diagnosing pain in the sacroiliac joint with high accuracy. There is no correlation between morphological changes and back pain. Gold standard of diagnostics is diagnostic blockade with local anesthetics. Treatment starts in accordance with the general principles described in the international guidelines for the management of acute and chronic nonspecific back pain. The most preferred is the multi-modal approach. The use of oral non-steroidal anti-inflammatory drugs is recommended, taking into account possible complications and individual patient characteristics (e.g. age), using the minimal effective dose for the shortest duration and in combination with gastro protection. Etoricoxib (Arcoxia) – a highly selective cyclooxygenase-2 inhibitor, an effective and safe drug in the treatment of spondylosis. Intra- and extra-articular introduction of steroids can provide medium-term effect, in the case of insufficient efficacy the radiofrequency destruction is being used. The results of our own research showed the effectiveness of differentiated approach in assessing the main source of pain in unspecific lumbodynia and as well the subsequent targeted exposure using the methods of interventional medicine.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.