Развитие подходов к наблюдению и ведению пациентов с хроническим вирусным гепатитом С, перенесших трансплантацию печени: опыт Республики Саха (Якутия)
- Аннотация
- Статья
- Ссылки
- English
20–49 лет. Регистрируется высокая частота неблагоприятных исходов, таких как цирроз и первичный рак печени.
Цирроз печени вирусной этиологии занимает первое место среди показаний к трансплантации печени, что определяет необходимость разработки алгоритмов посттрансплантационного наблюдения пациентов. Внедрение в практику здравоохранения новых схем безинтерфероновой терапии ХГС позволит оптимизировать подходы к ведению больных после пересадки печени.
20–49 лет. Регистрируется высокая частота неблагоприятных исходов, таких как цирроз и первичный рак печени.
Цирроз печени вирусной этиологии занимает первое место среди показаний к трансплантации печени, что определяет необходимость разработки алгоритмов посттрансплантационного наблюдения пациентов. Внедрение в практику здравоохранения новых схем безинтерфероновой терапии ХГС позволит оптимизировать подходы к ведению больных после пересадки печени.
Вирусный гепатит C – одна из актуальных проблем медицины и здравоохранения, обусловленных его повсеместным распространением и частым развитием хронических форм заболевания.
Последние годы в России наблюдается рост заболеваемости хроническим гепатитом C (ХГС). Так, в 2014 г. соответствующий показатель составил 39,03 на 100 000 населения. В структуре первичной заболеваемости хроническими вирусными гепатитами в России преобладает ХГС (более 79%) [1]. Особого внимания заслуживает тот факт, что половина среди зарегистрированных больных – лица моложе 40 лет [2].
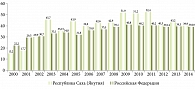
В структуре хронических вирусных гепатитов в Якутии на долю ХГС приходится 58,9%. По данным официальной статистики, в 2014 г. впервые было выявлено 413 больных ХГС. Показатель заболеваемости достиг 39,9 на 100 000 населения (рис. 1). Кроме того, высока частота отдаленных неблагоприятных исходов – цирроза и рака печени: среди наблюдаемой группы лиц с ХГС (n = 746) у 40,5% в течение пяти лет регистрируется цирротическая стадия заболевания.
Трансплантация печени стала распространенным видом помощи пациентам с терминальными стадиями болезней печени [3], что требует усовершенствования подходов к посттрансплантационному ведению и реабилитации данной категории больных.
Целью исследования стало определение на основе клинических данных пациентов с хроническим вирусным гепатитом C, перенесших трансплантацию печени, подходов к оптимизации противовирусной терапии.
Материал и методы исследования
Исследование основано на изучении динамики многолетней заболеваемости вирусным гепатитом C и его исходов среди населения Республики Саха (Якутия) за период с 1996 по 2011 г.
В работе использованы материалы официальной статистики Управления Роспотребнадзора по Республике Саха (Якутия), отделения вирусных гепатитов Якутской городской клинической больницы и Республиканской больницы № 1. Проанализированы исходы трансплантации печени у больных ХГС с 2011 г., выписные справки пациентов, которым подобная операция была проведена в Федеральном медицинском биофизическом центре им. А.И. Бурназяна и Республиканской больнице № 1.
Больным проводили комплекс общеклинических, серологических и молекулярно-биологических исследований для выявления маркеров вирусных гепатитов (анти-HCV, PHK-HCV).
Результаты исследования
В Республике Саха (Якутия) отмечался рост заболеваемости ХГС – с 15,2 в 2000 г. до 52,4 в 2011 г. При этом республиканские показатели превысили федеральные на 28,3% (в России – 40,2 на 100 000 населения) (рис. 1). Динамику заболеваемости оценивали с помощью двустороннего критерия Манна – Уитни на уровне значимости 0,05. Установлено, что заболеваемость ХГС с 2006 г. значимо увеличилась (p = 0,0303).
Под нашим наблюдением с 2008 г. в отделении вирусных гепатитов Якутской городской клинической больницы находилось 2700 пациентов с хроническими формами вирусных гепатитов (1712 – с хроническими гепатитами, 988 – с циррозом печени). В структуре хронических вирусных гепатитов преобладали больные гепатитом B (45%). Пациентов с гепатитом C насчитывалось 26,3%. Доля гепатита D в структуре госпитализированной заболеваемости составляла 23,4%. Возраст большинства наблюдаемых больных (54,3%) – до 29 лет. В 12% случаев диагностирована цирротическая стадия заболевания. У лиц в возрасте 40–49 лет и старше в основном имел место цирроз печени.
Частота развития рака печени при хроническом гепатите C составила 11,2% (у 16 из 143 пациентов). В большинстве своем это были пациенты с HCV-инфекцией в возрасте 60–69 лет (53,8%). У таких больных при гепатите С в 100% случаев выявлялась репликативная активность вируса гепатита С [4, 5].
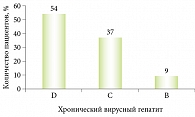
В настоящее время в листе ожидания на трансплантацию печени в Pеспублике Cаха (Якутия) указаны 162 пациента с хроническим вирусным гепатитом B, С и D в стадии субкомпенсированного цирроза печени (рис. 2), со стадией B и С по шкале Чайлда – Пью. HCV-инфекция зарегистрирована у 60 (37%) больных.
При подготовке к операции через отдел оказания специализированной помощи Министерства здравоохранения Республики Саха (Якутия) выписки пациентов отправляются в ведущие российские клиники согласно приказам указанного ведомства № 01-8/4-13 от 14.01.2010 «О порядке формирования и утверждения государственного задания на оказание в 2010 году высокотехнологичной медицинской помощи гражданам Российской Федерации за счет ассигнований государственного бюджета Республики Саха (Якутия)» и № 01-01-08/24 от 31.03.2010 «О мерах по реализации Соглашения ВМП-СУ-34/10 от 23.03.2010 о предоставлении в 2010 году субсидии из федерального бюджета бюджету Республики Саха (Якутия) на софинансирование государственного задания на оказание высокотехнологичной медицинской помощи гражданам Российской Федерации».
По согласованию с консультантами клиник проводятся отбор пациентов на трансплантацию печени и занесение в лист ожидания клиники, где на основании федеральной программы будет оказана высокотехнологичная медицинская помощь – трансплантация печени. В случае трансплантации печени от живого родственного донора проводятся его обследование и подготовка к оперативному лечению. С момента указания в листе ожидания больной-реципиент при пересадке трупной печени находится в городе, в котором запланировано выполнение операции. При поступлении донорского органа пациента вызывают в клинику для оперативного лечения.
Посттрансплантационное наблюдение осуществляется по месту жительства пациента врачом-инфекционистом. Больной получает необходимую терапию (противовирусную и иммуносупрессивную).
За период с 2011 г. трансплантация выполнена 20 больным хроническими вирусными гепатитами с исходом в цирроз печени (100%) и гепатоцеллюлярную карциному (15%). 80% пациентов были прооперированы в Федеральном медицинском биофизическом центре им. А.И. Бурназяна, 20% – в Республиканской больнице № 1. Удельный вес ХГD составил 70% (14), ХГС – 25% (5) и ХГВ – 5% (1). Средний возраст прооперированных – 39,1 года. Лиц мужского пола было 13 (65%), женского – семь (35%), 90% – лица коренной национальности. Всем пациентам проведена родственная трансплантация печени. В условиях значительного дефицита донорских органов родственная пересадка печени является перспективным направлением в трансплантологии.
Средний возраст прооперированных пациентов с гепатитом C – 37,6 ± 8,4 года. Мужчин было трое (60%), женщин – две (40%), лиц коренной национальности – четверо (80%). Средний уровень общего билирубина до операции составлял около 55,26 мкмоль/л, аланинаминотрансферазы (AJIT) – 73,85 Ед/л, аспартатаминотрансферазы (ACT) – 122,1 Ед/л, альбумина – 29,13 г/л. Общий анализ крови: уровень лейкоцитов – 3,6 × 109/л, гемоглобина – 110 г/л, тромбоцитов – 81 × 109/л. Класс по шкале Чайлда – Пью у двух (40%) больных – В, у трех (60%) – С. Несмотря на класс В, из-за наличия гепатоцеллюлярной карциномы этим больным была рекомендована пересадка печени. Средний балл по MELD – 20. У всех пациентов по данным эластометрии отмечался фиброз 4-й степени по шкале METAVIR. У большинства (80%) пациентов была II (A) Rh (+) группа крови.
Всем пациентам проведена родственная трансплантация печени: от дочери матери – два случая, от сына отцу – один и от брата брату – два случая. При этом лица с циррозом печени составили 100%, исход в гепатоцеллюлярную карциному наблюдался в 40% случаев. Послеоперационный период протекал без осложнений. Состояние доноров печени во всех случаях расценивалось как удовлетворительное.
Основная проблема при пересадке печени у больных с хроническими вирусными гепатитами – репликативная активность вирусов, которая может приводить к реинфицированию трансплантанта. Как известно, наличие репликации вируса гепатита C в крови не является противопоказанием к трансплантации печени. Реинфекция трансплантанта вирусом гепатита C после пересадки печени развивается в 100% случаев (возвратная HCV-инфекция). В группе исследуемых пациентов в 100% отмечалась репликация HCV, вирусная нагрузка колебалась от 66 000 до 7 161 000 МЕ/мл, основной генотип в 80% случаев – 1b.
Целью противовирусной терапии в дотрансплантационном периоде является снижение вирусной нагрузки. Возможность проведения противовирусной терапии пациентам до трансплантации печени определяется степенью компенсации функции печени и решается в индивидуальном порядке. Противовирусную терапию получали до пересадки два пациента с ХГС, у обоих курс лечения стандартной двойной терапией пегилированными интерферонами с рибавирином оказался безуспешным. Троим (60%) пациентам лечение не проведено в дотрансплантационном периоде из-за позднего диагностирования болезни и противопоказаний к стандартной терапии к моменту установления клинического диагноза.
Общая летальность составила 5%, смерть наступила у одной больной ХГС с исходом в гепатоцеллюлярную карциному более чем через год после трансплантации печени вследствие прогрессирования гепатоцеллюлярной карциномы. Диагностированы отдаленные метастазы в костной системе.
В послеоперационном периоде у больных ХГС средний уровень AЛT составил 48,3 Ед/л, ACT – 44,6 Ед/л, альбумина – 34 г/л, общего билирубина – 28,7 мкмоль/л. Общий анализ крови: уровень лейкоцитов – 4,0 × 109/л, гемоглобина – 122 г/л, тромбоцитов – 184,0 × 109/л.
Все больные после трансплантации получают иммуносупрессивную и патогенетическую терапию. Комбинированная противовирусная терапия (пегилированный интерферон с рибавирином) назначена одному пациенту с ХГС 3-го генотипа. В настоящее время он находится на 24-й неделе терапии, отмечен ранний вирусологический ответ, но с начала лечения наблюдаются выраженная лейкопения (до 0,93 × 109/л) и анемия (89 г/л), корригируемые постоянным приемом эритропоэтинов и филграстима (30 млн ЕД три раза в неделю). Двум больным с хронической НCV-инфекцией после пересадки печени рекомендована безинтерфероновая схема лечения.
По данным UNOS (United Network for Organ Sharing – организация в США, контролирующая лист ожидания, вопросы забора и распределения органов и ведущей статистику), в 2000 г. около 1/3 трансплантаций печени в мире выполнено по поводу цирроза печени HCV-этиологии. При этом наиболее благоприятные результаты отмечались при исходном отсутствии репликации вируса. В посттрансплантационный период вирусный гепатит C развивается примерно у 90%, однако для развития цирроза печени в трансплантированной печени необходимо достаточно длительное время, в течение которого пациент полностью социально адаптирован и неинвалидизирован [6].
Обсуждение
Полученные данные свидетельствуют об улучшении состояния больных, перенесших трансплантацию печени. Однако известно, что у 23% пациентов в течение трех лет после трансплантации печени развивается цирроз печеночного трансплантанта. Примерно 40% пациентов после трансплантации печени могут стать кандидатами для раннего начала противовирусной терапии (отсутствие цитопении). Комбинированная терапия пегилированными интерферонами с рибавирином позволяет добиться устойчивого вирусологического ответа в 9–39% случаев. При этом более высокие результаты имеют место при 2-м и 3-м генотипах HCV [7].
Поскольку подбор и обследование пациентов для трансплантации печени в ведущих центрах осуществляются на уровне Республики Саха (Якутия), это требует наличия в регионе комплексной и качественной диагностики с мониторингом, преемственности действий специалистов, интеграции работы различных служб (инфекционной, онкологической, хирургической, терапевтической, социально-психологической), доступности и всеобщего охвата медицинской помощью.
Сложности применения стандартной противовирусной терапии у больных в посттрансплантационном периоде и пациентов с циррозом печени ограничивают наши возможности. В настоящее время для этиотропной терапии хронического гепатита C разработаны и готовы к применению полностью пероральные безинтерфероновые схемы лечения, характеризующиеся высокой эффективностью и безопасностью, удобством применения. Многокомпонентную схему с применением препаратов прямого противовирусного действия называют 3D-терапией. Это уникальная комбинация из трех составляющих – омбитасвира, паритапревира/ритонавира, дасабувира с добавлением «усилителя» – рибавирина. Важный момент: это первая и пока единственная тройная комбинация, эффективность и безопасность которой подтверждена с позиции стандарта GCP (Good Clinical Practice – надлежащая клиническая практика) и которая успешно сочетает представителей всех классов существующих прямых противовирусных агентов (direct-acting antiviral, DAA) с разным механизмом действия для получения максимального эффекта [8].
В настоящее время 3D-терапия одобрена для применения у сложной категории больных с ХГС после пересадки печени. Основанием послужило клиническое исследование фазы II CORAL-I [9, 10].
Результаты исследования M12-999 (CORAL-I) у взрослых пациентов (n = 34) с хроническим вирусным гепатитом С 1-го генотипа, ранее не получавших противовирусного лечения и перенесших трансплантацию печени, показали, что после 24 недель пероральной безинтерфероновой терапии устойчивый вирусологический ответ был достигнут у 97,1% пациентов (HCV 1a – 97%, HCV 1b – 100%). Переносимость терапии была хорошей. Зарегистрировано два случая развития серьезных нежелательных явлений: гипотензия и тахикардия, связанные с началом приема тамсулозина (Flomax) после плановой операции, умеренные периферические отеки и боль в конечности у пациента с сахарным диабетом и отеками в анамнезе. В ходе лечения не зафиксировано ни одного случая вирусологического прорыва и отторжения трансплантанта. У одного пациента развился рецидив.
Заключение
Пациентам с хроническим вирусным гепатитом C необходимо назначать противовирусную терапию для снижения риска прогрессирования болезни до и после операции. Поскольку у больных с HCV-инфекцией после пересадки печени при стандартной противовирусной терапии существует риск развития нежелательных явлений, необходимо использовать безинтерфероновые схемы лечения гепатита С.
Эффективность, безопасность 3D-схем, удобство применения при хронической HCV-инфекции предоставляют уникальную возможность проведения эрадикационной терапии у лиц с цирротической стадией болезни, в том числе перенесших трансплантацию печени. Таким образом, можно говорить о конкретных схемах ведения пациентов после пересадки печени при хроническом гепатите C и полном излечении даже при запущенных формах заболевания.
Увеличение охвата диспансеризацией больных острыми и хроническими вирусными гепатитами с внедрением методов ранней диагностики цирроза и рака печени вирусной этиологии, грамотный отбор лиц, нуждающихся в противовирусной терапии, оказание им медицинской помощи, в том числе высокотехнологичной, будут способствовать снижению числа больных первичным раком печени в Pеспублике Cаха (Якутия).
Клинический случай
Рассмотрим пример, демонстрирующий достаточно позднее выявление болезни у пациента с ХГС с формированием первичной гепатоцеллюлярной карциномы.
Больной, 53 года (национальность – якут), наблюдается с диагнозом «хронический вирусный гепатит С, 1b генотип, с исходом в цирроз печени с формированием гепатоцеллюлярной карциномы».
Из анамнеза известно, что впервые диагноз ХГС в цирротической стадии установлен в 2009 г. Тогда же при обследовании обнаружено опухолевое образование 3 × 5 см в 6–7-м сегменте печени. По результатам дополнительных обследований диагностирована гепатоцеллюлярная карцинома 3,5 см в 6–7-м сегменте, после чего был проведен курс трансартериальной химиоэмболизации с последующим назначением противовирусной терапии ХГС пегилированными интерферонами с рибавирином в течение 48 недель. К окончанию курса виремия снизилась до 367 МЕ/мл. Результаты компьютерной томографии через полгода показали рецидив поражения. В правой передней доле выявлено новое поражение. После этого был выполнен курс радиочастотной абляции. До февраля 2013 г. состояние было стабильным, но по результатам магнитно-резонансной томографии обнаружены рецидив поражения в 7–8-м сегменте и новое поражение в 4-м сегменте. Пациенту были проведены три курса радиочастотной абляции и повторная стандартная противовирусная терапия. Состояние пациента ухудшилось, усилились слабость, кожный зуд, в анализах крови гипербилирубинемия до 500 мг/л, снижение уровня альбумина до 26 г/л. Установлен цирроз печени с исходом в гепатоцеллюлярную карциному, класс В по шкале Чайлда – Пью (7 баллов), MELD – 16 баллов, портальная гипертензия, спленомегалия, хроническая печеночная недостаточность.
Из-за увеличения размеров опухоли и ухудшения самочувствия пациенту рекомендована пересадка печени. Вирусная нагрузка до операции составила 3537 МЕ/мл. В октябре 2013 г. в Федеральном медицинском биофизическом центре им. А.И. Бурназяна (Москва) выполнили пересадку печени от живого родственного донора с благоприятным генотипом ИЛ-28 (донором стал близкий родственник больного).
В январе 2014 г. вновь выявлен цитолиз до 2–3 норм, при анализе крови методом полимеразной цепной реакции – высокая виремия HCV – 71 611 091 МЕ/мл. Общий анализ крови: лейкопения – 2,8 × 109/л, анемия – Hb 116 г/л, тромбоцитопения – 156 × 109/л. Пациент жалуется на слабость, повышение артериального давления до 180/90 мм рт. ст., ноющие боли в крупных суставах. Общее состояние относительно удовлетворительное. Кожные покровы смуглые с землистым оттенком, видимые слизистые чистые, умеренная пальмарная эритема. Периферические лимфоузлы не пальпируются. Дыхание проводится по всем легочным полям, хрипов нет. Сердечные тоны приглушены, ритмичные. Живот мягкий, безболезненный. Печень по краю реберной дуги. Стул регулярный.
Заключительный диагноз: хронический вирусный гепатит С, 1b генотип, IL-28 CC/ТТ, с исходом в цирроз печени, F4, с высокой вирусной нагрузкой (71 611 091 МЕ/мл). Состояние после ортотопической трансплантации печени от живого родственного донора (2013) по поводу гепатоцеллюлярной карциномы. Состояние после курсов радиочастотной абляции (2009, 2013), двух курсов противовирусной терапии пегилированными интерферонами и рибавирином (2010, 2012), с последующим рецидивом HCV. Желчнокаменная болезнь. Хронический панкреатит. Киста правой почки. Гемангиома печени.
С учетом высокой вирусной нагрузки, выраженной лейкопении, тромбоцитопении, резистентности к стандартной противовирусной терапии препаратами интерферона, состояния после трансплантации печени, приема иммуносупрессантов рекомендована этиотропная терапия хронической HCV-инфекции с применением безинтерфероновых схем лечения.
В настоящее время пациенту начата противовирусная 3D-терапия HCV-инфекции. В первые две недели лечения отмечались значительные колебания уровня циклоспорина, что потребовало мониторинга колебаний и подбора доз иммуносупрессантов (Сандиммуна). В целом переносимость терапии удовлетворительная.
S.S. Sleptsova, A.G. Rakhmanova
North-Eastern Federal University named after M.K. Ammosov (Yakutsk)
Center for Prevention and Control of AIDS and Infectious Diseases (St. Petersburg)
Contact person: Snezhana Spiridonovna Sleptsova, sssleptsova@yandex.ru
In Republic of Sakha (Yakutia) there is an unfavorable epidemiological situation regarding chronic hepatitis C (CHC). CHC morbidity was mainly documented in working-age population aged 20–49. High incidence of unfavorable outcomes such as cirrhosis and primary liver cancer was recorded.
Liver cirrhosis of viral etiologies holds the first place among indications for liver transplantation that determines a need to develop algorithms for post-transplantation observation of such patients. By applying novel non-interferon containing regimens into public healthcare will allow to optimize approaches for management of patients underwent liver transplantation.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.