Результаты «Российского мультицентрового проспективного регистрового исследования с целью оценки поэтапной интенсификации инсулинотерапии у пациентов с сахарным диабетом 2 типа» (OPPORTUNITY)
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Данные собирались в рамках неинтервенционного многоцентрового проспективного шестимесячного регистрового исследования в условиях реальной клинической практики с участием пациентов с сахарным диабетом (СД) 2 типа, у которых терапия базальным инсулином была интенсифицирована по меньшей мере одной прандиальной инъекцией инсулина глулизин за одну – четыре недели до включения в исследование. Исследование было проведено на территории Российской Федерации в 65 центрах. Первичным параметром являлась доля участников исследования, достигших индивидуальных целевых уровней 2ч-ППГ после основного приема пищи, которым врачом был назначен режим «базал-плюс» (рБП) или «базал-болюс» (рББ) инсулинотерапии. В рамках исследования никаких гипотез не тестировалось.
Результаты. 212/657 (32,3%) пациентов популяции исследования были мужчины, средняя продолжительность СД 2 типа составила 9,9 ± 6,2 года. Включено в исследование 657 пациентов, первичный параметр оценен у 631 участника. Период лечения составил в среднем (СО) – 185,46 (9,35) дня. Пациенты в группах рБП и рББ были сопоставимы по демографическим и антропометрическим данным. Исходный уровень гликированного гемоглобина (HbA1c) составил 9,1 ± 1,2%, глюкозы плазмы натощак (ГПН) – 9,0 ± 1,7 ммоль/л и ППГ – 11,1 ± 2,0 ммоль/л. Данные 631 пациента, которые закончили исследование, согласно критериям исследования, показали, что через шесть месяцев 83,5% всех пациентов достигли целевых уровней ППГ (86,9 и 82,2% на рБП и рББ соответственно). Оба режима продемонстрировали сходную эффективность в течение шести месяцев наблюдения. Не было зарегистрировано значимой разницы между группами через три и шесть месяцев после начала лечения. 25 пациентов поменяли режим терапии с БП на ББ в ходе наблюдения. Среднее количество (± СО) эпизодов гипогликемии на одного участника в месяц составило 0,5 ± 0,4, медиана 0,4 в группе рБП и 1,0 ± 0,9, медиана 0,7 в группе рББ (p = 0,036). В данном исследовании были зарегистрированы шесть нежелательных явлений у четырех (0,6%) пациентов. Два из них классифицированы как не являющиеся серьезными, четыре – как являющиеся серьезными.
Выводы. Результаты данного исследования показали, что рБП является эффективной альтернативой рББ у пациентов с СД 2 типа, которым показана интенсификация инсулинотерапии. Результаты свидетельствуют об эффективности рБП в снижении HbA1c, ГПН и ППГ, сопоставимой с эффективностью рББ, в сочетании с меньшим риском гипогликемии, что, по всей видимости, связано с меньшими дозами инсулина при использовании рБП.
Материал и методы. Данные собирались в рамках неинтервенционного многоцентрового проспективного шестимесячного регистрового исследования в условиях реальной клинической практики с участием пациентов с сахарным диабетом (СД) 2 типа, у которых терапия базальным инсулином была интенсифицирована по меньшей мере одной прандиальной инъекцией инсулина глулизин за одну – четыре недели до включения в исследование. Исследование было проведено на территории Российской Федерации в 65 центрах. Первичным параметром являлась доля участников исследования, достигших индивидуальных целевых уровней 2ч-ППГ после основного приема пищи, которым врачом был назначен режим «базал-плюс» (рБП) или «базал-болюс» (рББ) инсулинотерапии. В рамках исследования никаких гипотез не тестировалось.
Результаты. 212/657 (32,3%) пациентов популяции исследования были мужчины, средняя продолжительность СД 2 типа составила 9,9 ± 6,2 года. Включено в исследование 657 пациентов, первичный параметр оценен у 631 участника. Период лечения составил в среднем (СО) – 185,46 (9,35) дня. Пациенты в группах рБП и рББ были сопоставимы по демографическим и антропометрическим данным. Исходный уровень гликированного гемоглобина (HbA1c) составил 9,1 ± 1,2%, глюкозы плазмы натощак (ГПН) – 9,0 ± 1,7 ммоль/л и ППГ – 11,1 ± 2,0 ммоль/л. Данные 631 пациента, которые закончили исследование, согласно критериям исследования, показали, что через шесть месяцев 83,5% всех пациентов достигли целевых уровней ППГ (86,9 и 82,2% на рБП и рББ соответственно). Оба режима продемонстрировали сходную эффективность в течение шести месяцев наблюдения. Не было зарегистрировано значимой разницы между группами через три и шесть месяцев после начала лечения. 25 пациентов поменяли режим терапии с БП на ББ в ходе наблюдения. Среднее количество (± СО) эпизодов гипогликемии на одного участника в месяц составило 0,5 ± 0,4, медиана 0,4 в группе рБП и 1,0 ± 0,9, медиана 0,7 в группе рББ (p = 0,036). В данном исследовании были зарегистрированы шесть нежелательных явлений у четырех (0,6%) пациентов. Два из них классифицированы как не являющиеся серьезными, четыре – как являющиеся серьезными.
Выводы. Результаты данного исследования показали, что рБП является эффективной альтернативой рББ у пациентов с СД 2 типа, которым показана интенсификация инсулинотерапии. Результаты свидетельствуют об эффективности рБП в снижении HbA1c, ГПН и ППГ, сопоставимой с эффективностью рББ, в сочетании с меньшим риском гипогликемии, что, по всей видимости, связано с меньшими дозами инсулина при использовании рБП.


Введение
Пациенты с неконтролируемым сахарным диабетом (СД) 2 типа имеют значительно более высокий риск развития и прогрессирования микро- и макрососудистых осложнений. Последние ассоциируются с инвалидизацией и повышенной смертностью. В совокупности это обусловливает увеличение расходов здравоохранения [1]. Однако в проспективном исследовании СД в Великобритании (UKPDS) у пациентов с впервые диагностированным СД 2 типа интенсивная терапия по сравнению с традиционной привела к значительному сокращению микро- и макрососудистых осложнений [2, 3].
Прогрессирующий характер СД 2 типа и неспособность базального инсулина корректировать постпрандиальную гликемию (ППГ) в конечном счете приведут к необходимости интенсификации терапии, обычно с помощью прандиального инсулина. Применение инсулина короткого действия (компонента интенсивной инсулинотерапии) с каждым приемом пищи может снизить ППГ до показателей, близких к нормальным. Современные алгоритмы интенсификации инсулинотерапии предполагают разные варианты ее режимов, но в последние годы большое внимание уделяется режиму «базал-плюс» [4–6].
Лечение комбинацией ранней инъекции базального инсулина и одной инъекции прандиального инсулина у пациентов с СД 2 типа, неконтролируемым на фоне инсулина гларгин или пероральных сахароснижающих препаратов (ПССП), оценивалось в исследовании OPAL [7]. Больные были рандомизированы для получения одной прандиальной инъекции инсулина глулизин в дополнение к ранее применяемой схеме терапии. Согласно результатам исследования, средние значения гликированного гемоглобина (HbA1c) значимо улучшились относительно исходных вне зависимости от того, был ли прием пищи завтраком или основным. При этом в двух группах лечения регистрировалась низкая или сопоставимая частота гипогликемий.
Результаты исследования OSIRIS подтвердили, что у пациентов с СД 2 типа добавление одной инъекции инсулина глулизин к инсулину гларгин так же эффективно и безопасно, как использование только базально-болюсного режима [6].
Большая часть клинических исследований режима «базал-плюс» (рБП) инсулинотерапии, в которых была продемонстрирована эффективность данного метода, включала пациентов с целевым уровнем глюкозы плазмы натощак (ГПН), что достигалось титрацией дозы инсулина гларгин. Установлено, что рБП может применяться для пошаговой интенсификации инсулинотерапии у пациентов с СД 2 типа, не достигших оптимального контроля над заболеванием, несмотря на правильную титрацию базального инсулина и использование ПСCП. Главный принцип такого лечения заключается в добавлении к ранее назначенной схеме лечения (например, «базальный инсулин + метформин») одной инъекции прандиального инсулина, приуроченной к основному приему пищи. Необходимо отметить, что у большинства лиц в течение дня можно выделить один главный прием пищи, после которого отмечается наиболее выраженный пик гипергликемии [8, 9]. Несомненно, в такой ситуации оптимальным было бы назначение аналогов инсулина ультракороткого действия, которые максимально имитируют физиологический процесс секреции инсулина в ответ на прием пищи [10].
Режим «базал-плюс» был недавно включен в российские национальные рекомендации для лечения больных СД 2 типа. Однако неясно, как врачи будут отбирать пациентов для такого режима инсулинотерапии.
На основании вышеупомянутых фактов было запланировано наблюдательное исследование для получения данных реальной клинической практики относительно эффективности и безопасности поэтапной интенсификации инсулинотерапии в режиме «базал-плюс» и режиме «базал-болюс» (рББ) у российских пациентов. Данные этого исследования позволили бы оценить преимущества и сделать осознанный выбор того или иного режима терапии.
Основная цель исследования – определить долю пациентов, достигших индивидуальных целевых уровней глюкозы через два часа и более после основного приема пищи на фоне использования рБП или рББ.
Материал и методы
Данные собирались и анализировались в рамках исследования № APIDRL07323 «Российское мультицентровое проспективное регистровое исследование с целью оценки поэтапной интенсификации инсулинотерапии у пациентов с сахарным диабетом 2 типа». Сокращенное название исследования – OPPORTUNITY. Протокол исследования и информационный листок пациента с формой информированного согласия (ФИС) утверждены на заседании междисциплинарного этического комитета (протокол № 20 от 25.12.2017). Исследование проводилось на территории России в 65 центрах с 28 декабря 2017 г. (дата включения первого пациента) до 29 декабря 2018 г. (дата завершения участия последнего пациента) в соответствии с обычной клинической практикой. При выборе центров учитывали врачебный опыт и количество принимаемых пациентов. Из сформированного пула врачей были отобраны исследователи для участия в программе.
OPPORTUNITY – неинтервенционное многоцентровое проспективное шестимесячное исследование в условиях реальной клинической практики с участием пациентов с СД 2 типа, у которых терапия базальным инсулином была интенсифицирована по меньшей мере одной прандиальной инъекцией инсулина глулизин за одну – четыре недели до включения в исследование.
Исследование состояло из двух периодов: периода набора пациентов (с 28 декабря 2017 г. по 29 июня 2018 г.) и периода наблюдения (в течение шести месяцев). Оно предполагало три визита: первый – скрининг, второй – приблизительно через три месяца после включения в исследование, третий – примерно через шесть месяцев. Данные собирались при помощи индивидуальной регистрационной карты.
Набор пациентов осуществлялся из расчета десять на центр (в каждом центре три пациента на рБП и семь – на рББ).
В исследование включали пациентов обоего пола, 18 лет и старше, подписавших ФИС.
Критерии исключения: беременность или период лактации, нежелание или невозможность правильно применять рБП (одна инъекция прандиального инсулина в день) или рББ (более одной инъекции прандиального инсулина в день), на момент включения в исследование прием агонистов рецепторов глюкагоноподобного пептида 1.
Оценивали две группы пациентов: первая – находящиеся на рБП, вторая – на рББ.
Через три и шесть месяцев в обеих группах определяли постпрандиальную гликемию через два часа и более после основного приема пищи (2ч-ППГ), уровень HbA1c, ГПН, частоту эпизодов гипогликемии, массу тела, дозы и режим инсулина глулизин и базального инсулина, качество жизни по опроснику SF-36, нежелательные явления.
Для описания популяции исследования, оценки взаимосвязи с эпизодами гипогликемии и выбора режима использования препарата также анализировали демографические (возраст, пол) и антропометрические (рост, вес) данные, данные анамнеза, физикального обследования (артериальное давление (АД), частота сердечных сокращений), наличие терапии сопутствующих заболеваний (вид, доза и дата назначения до включения в исследование), время основного приема пищи. Основной прием пищи определялся врачом после интервьюирования пациента.
Гипогликемией считали уровень глюкозы в крови ≤ 3,9 ммоль/л, в том числе в ночное время (с 00.00 до 06.00).
Выбор индивидуальных целевых значений HbA1c, ГПН, ППГ осуществлялся лечащим врачом согласно последним российским алгоритмам лечения СД 2 типа [10].
Дозы антидиабетических препаратов по усмотрению исследователя могли быть снижены при развитии гипогликемических состояний. Вид и доза препарата для терапии сопутствующего заболевания также определялись лечащим врачом.
Инсулин глулизин назначался в рамках стандартной клинической практики в соответствии с одобренным показанием. Врач принимал независимое решение об интенсификации лечения базальным инсулином минимум одной инъекцией инсулина глулизин. Согласно инструкции по применению препарата Апидра СолоСтар [11], дозу инсулина следовало корректировать в индивидуальном порядке и титровать согласно ППГ в плазме капиллярной крови. Врач также должен был обучить пациента алгоритму самостоятельной титрации дозы прандиального инсулина.
Для оценки первичного параметра в исследование необходимо было включить 660 пациентов, учитывая, что примерно 50% (с отклонением ± 4% при 95%-ном доверительном интервале (ДИ)) достигнут индивидуальных целевых значений ППГ и данные примерно 10% пациентов могут отсутствовать. Так, в группу рБП планировали включить 198 пациентов, в группу рББ – 462.
Для анализа данных применяли методы описательной статистики. Чтобы ограничить риск ложноположительных результатов за счет возможной высокой вариабельности и разнообразия изучаемых данных, измеряемые показатели и статистические гипотезы предварительно не определялись. Для непрерывных переменных определены средние значения, стандартное отклонение (СО), 95% ДИ, медиана, минимальное (мин.) и максимальное (макс.) значения. Для дискретных переменных рассчитывали показатели частоты, процентное содержание и 95% ДИ (точный ДИ для бинарных переменных с использованием метода Клоппера – Пирсона, ДИ для полиномиальных переменных с использованием метода Сисона и Глаца). Выбор статистического критерия оценки различий зависел от вида распределения данных (критерий Шапиро – Уилка) и выполнения условия равенства дисперсий. Анализ статистической значимости различий был проведен с использованием методов параметрической статистики (ANOVA), t-критерия Стьюдента, критерия Вилкоксона – Манна – Уитни. Сравнение признаков в динамике проводилось при помощи парного t-критерия Стьюдента или критерия Вилкоксона. Сравнительный анализ качественных переменных проводился с помощью хи-квадрата и точного двустороннего критерия Фишера. Принимая во внимание дизайн исследования и определение неинтервенционного исследования, пропущенные данные для первичного анализа не заменялись.
Результаты
Информированное согласие подписали 663 пациента. Шестеро были исключены из-за несоответствия критериям включения.
Оставшиеся 657 участников были названы популяцией с назначенным лечением (intent to treat – ITT). У 25 лечение было изменено с рБП на рББ уже в ходе наблюдения, в связи с чем их данные анализировались отдельно. В анализ включены 632 больных. Исследование завершил 631 пациент. Один участник исследования прекратил лечение досрочно. В связи с этим популяция по протоколу (per-protocol – РР) включала 631 больного.
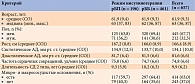
Из 657 пациентов было 212 (32,3%) мужчин. Средний возраст участников составил 61,9 ± 9,3 года. Средняя продолжительность СД 2 типа – 9,9 ± 6,2 года. На момент включения в исследование 414/657 (63%) участников имели микро- или макрососудистые осложнения (табл. 1). Статистических различий по демографическим и антропометрическим параметрам в группах рБП и рББ не было выявлено. На первом визите 196/657 (29,8%) пациентам назначен рБП, 461/657 (70,2%) – рББ. Сразу после первого визита четырем пациентам режим инсулинотерапии был изменен с ББ на БП из-за отсутствия терапевтического влияния. Данные этих пациентов анализировали в группе рБП.
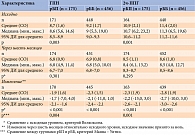
Среднее время (СО, медиана) нахождения на рБП составило 186,32 (9,92, 185) дня, на рББ – 185,13 (9,11, 184) дня, р = 0,13. Анализ первичного параметра показал, что через три месяца 283/631 (44,8%) участника достигли целевых значений 2ч-ППГ: в группе рБП таковых было 92/175 (52,6%), в группе рББ – 191/456 (41,9%). Разница между группами была статистически достоверной (р = 0,016). Через шесть месяцев доля участников, достигших индивидуальных целевых значений 2ч-ППГ, увеличилась до 527/631 (83,5%), включая 152/196 (86,9%) в группе рБП и 375/456 (82,2%) в группе рББ (р = 0,161).
Анализ уровня HbA1c показал, что через шесть месяцев терапии средние значения показателя в группах рБП и рББ снизились до 7,3 ± 0,7% (95% ДИ 7,2–7,4) и 7,4 ± 0,8% (95% ДИ 7,3–7,5). К третьему визиту изменение относительно исходного уровня было статистически значимым (p < 0,001) в обеих группах – -1,5 ± 1,0 и -1,8 ± 1,1% соответственно. Через три месяца 41 (23,6%) пациент на рБП достиг индивидуальных целевых значений HbA1c, установленных врачом, и 67 (14,8%) больных на рББ (р = 0,01), через шесть месяцев – 121 (69,5%) и 300 (65,8%) соответственно (р = 0,371). Субанализ данных показал, что без эпизодов гипогликемии в группе рБП таковых было 38 (21,8%), в группе рББ – 38 (21,8%) (р = 0,013), к окончанию наблюдения 114 (65,5%) против 284 (62,3%) пациентов (р = 0,451).
Через шесть месяцев средний уровень ГПН снизился до 6,8 ± 0,9 ммоль/л в группе рБП и до 6,9 ± 0,8 ммоль/л в группе рББ. Различия между группами оказались статистически незначимыми. Однако изменение относительно исходного уровня в каждой группе носило статистически значимый характер (p < 0,001 для каждой группы). Аналогичная динамика была получена при анализе 2ч-ППГ (табл. 2).
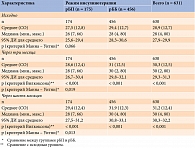
Анализ терапии показал, что средняя стартовая доза инсулина глулизин в группе рБП была значительно ниже, чем в группе рББ, – 7,8 ± 4,5 против 19,8 ± 8,1 ЕД, p < 0,001. Через три месяца средняя суточная доза увеличилась до 9,9 ± 5,3 ЕД в группе рБП и до 25,4 ± 8,2 ЕД в группе рББ (p < 0,001). Изменения относительно исходного уровня были статистически значимыми в обеих группах (p < 0,001). Через шесть месяцев лечения средние суточные дозы глулизина в группах рБП и рББ составили 11,4 ± 6,2 и 28,4 ± 8,9 ЕД соответственно. Изменения относительно исходного уровня в обеих группах, равно как и между группами, были статистически значимыми (p < 0,001). Суточные дозы базального инсулина представлены в табл. 3.
Проведение прандиальных инъекций в утренние часы рекомендовано 46/175 (26,3%) в группе рБП и 433/456 (95%) в группе рББ (p < 0,001), в дневные – 80/175 (45,7%) и 442/456 (96,9%) (p < 0,001), вечером – 81/175 (46,3%) и 453/456 (99,3%).
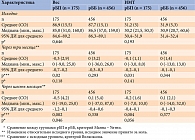
Согласно результатам исследования, на исходном уровне 413/632 (65,3%) участников получали сопутствующее лечение пероральными сахароснижающими препаратами. ПССП в группе рБП принимали 138/175 (78,9%) пациентов, в группе рББ – 275/457 (60,2%) (p < 0,001) (табл. 4).
Анализ частоты гипогликемий за время наблюдения показал, что как минимум один эпизод был задокументирован в течение шести месяцев после первого визита у 58/632 (9,2%) участников: на рБП у 16 (9,1%), на рББ у 42 (9,2%) (р = 0,985). Среднее количество (± СО) эпизодов гипогликемии на одного участника в месяц составило 0,5 ± 0,4, медиана 0,4 в группе рБП и 1,0 ± 0,9, медиана 0,7 в группе рББ (p = 0,036).
Для оценки клинических факторов, связанных с частотой гипогликемии, использовали регрессионный анализ. Согласно его результатам, при уровне значимости, равном 5%, лечение бигуанидами и сульфонилмочевиной значимо коррелировало с вероятностью возникновения таковой. Повышение исходного уровня ГПН на 1 ммоль/л ассоциировалось со снижением вероятности гипогликемии в 1,7 раза при прочих равных условиях. Аналогичная связь между исходным уровнем ГПН и гипогликемией наблюдалась по результатам тобит-регрессии: дополнительный ммоль/л исходного уровня ГПН обусловливал снижение общего количества эпизодов гипогликемии на 2,8, а количества эпизодов в месяц на 0,5.
Анализ качества жизни показал, что группы статистически не отличались по компонентам здоровья: психическое и физическое. Таковое достоверно (р < 0,001) улучшилось с момента участия в исследовании, без значимых различий между группами. Проанализирована связь между качеством жизни и количеством прандиальных инъекций в течение шести месяцев. Для этого использовали регрессионный анализ методом наименьших квадратов изменения каждого суммарного показателя восьми шкал опросника (физическое функционирование, ролевое функционирование, обусловленное физическим состоянием, общее состояние здоровья, жизненная активность, социальное функционирование, ролевое функционирование, обусловленное эмоциональным состоянием, психическое здоровье) и компонентов здоровья (общее физическое здоровье и общее психическое здоровье) в зависимости от количества прандиальных инъекций в сутки и времени (визита). Среднеквадратические ошибки были кластеризованы индивидуально (по идентификационному номеру участника). При уровне значимости, равном 5%, только показатели интенсивности боли в теле и общего физического здоровья были связаны с количеством прандиальных инъекций в сутки. Каждая дополнительная инъекция ассоциировалась с повышением изменения показателя интенсивности боли относительно исходного на 2,0 пункта и общего физического здоровья на 0,7 пункта в среднем (табл. 5).
В ходе исследования отмечено статистическое достоверное уменьшение веса в группе рБП. Индекс массы тела (ИМТ) также достоверно снижался более быстро в группе рБП. К концу наблюдения разница показателей между группами не достигла статистических различий (р = 0,056) (табл. 6).
Обсуждение результатов
Целью данного неинтервенционного исследования была оценка эффективности и безопасности инсулина глулизин, который добавляли к уже получаемой терапии базальным инсулином пациентам с недостаточно контролируемым сахарным диабетом 2 типа.
Основным параметром, по которому оценивали эффективность рБП, была выбрана доля пациентов, достигших индивидуальной целевой ППГ через два часа и более после основного приема пищи. Через шесть месяцев 83,5% пациентов достигли целевых уровней постпрандиальной глюкозы (86,9 и 82,2% на рБП и рББ соответственно). Оба режима инсулинотерапии в течение шести месяцев наблюдения продемонстрировали аналогичную эффективность. При этом пациенты в группе рББ имели более высокие показатели HbA1c, ГПН и ППГ, что могло быть обусловлено более интенсивным лечением. В ходе наблюдения 25 пациентов перешли с рБП на рББ. Среди них достигли целевых значений ГПН к шестому месяцу 72%, что ниже, чем в группе пациентов, которые остались на рБП.
Улучшение гликемического контроля (HbA1c и ГПН) было сопоставимо между группами рБП и рББ, несмотря на небольшие статистически значимые различия показателей к шестому месяцу, что может быть обусловлено исходными различиями между включенными в исследование пациентами. Уровень HbA1c снизился с 8,8 ± 1,0 до 7,3 ± 0,7% в группе рБП и с 9,2 ± 1,2 до 7,4 ± 0,8% в группе рББ. В целом HbA1c уменьшился на 1,5 ± 1,0 и 1,8 ± 1,1% соответственно. Различий между двумя режимами терапии выявлено не было. Пациентов, которые достигли целевых значений, установленных лечащим врачом, в группе рБП насчитывалось 69,5%, в группе рББ – 65,8% (различия статистически незначимы). Важно подчеркнуть, что большинство больных в обеих группах достигли целевых уровней HbA1c к шестому месяцу без эпизодов гипогликемии (65,5% в группе рБП и 62,3% в группе рББ). В данном исследовании зарегистрировано более выраженное снижение HbA1c по сравнению с исследованием OPAL [6]. В последнем данный показатель уменьшился с 7,32 ± 0,70 до 6,99 ± 0,83%, то есть примерно на 0,3%. В исследовании OPAL в подгруппе пациентов с исходным уровнем HbA1c > 7,0% целевого значения (7,0% и менее) достигли только 44,1% участников. Следует отметить, что в исследование OPAL в отличие от российского исследования не включали пациентов с уровнем HbA1c > 9,0%.
Средняя ППГ через шесть месяцев составила 8,5 ± 1,1 и 8,6 ± 1,0 ммоль/л для групп рБП и рББ соответственно (p = 0,293). Изменение значений ППГ (относительно исходного) через шесть месяцев от начала лечения в группе рББ было статистически более значимым, чем в группе рБП (2,8 ± 1,9 против 2,3 ± 1,9 ммоль/л, p = 0,001). Уровень ГПН у пациентов снизился с 8,7 ± 1,6 до 6,8 ± 0,9 ммоль/л в группе рБП и с 9,2 ± 1,7 до 6,9 ± 0,8 ммоль/л в группе рББ. Изменение ГПН от исходного уровня к шестому месяцу было статистически более значимым у пациентов на рББ. Достоверные различия изменений ППГ и ГПН между группами, по-видимому, связаны с более высокими исходными уровнями данных показателей и соответственно выбором рББ.
Результаты наблюдения показали, что рБП является эффективной альтернативой рББ для пациентов, которым требуется интенсификация инсулинотерапии. Кроме того, оценка риска гипогликемии позволяет сделать вывод, что рБП ассоциирован с меньшим риском таковой. Частота эпизодов гипогликемии на фоне рБП оказалась ниже, чем на фоне рББ (0,5 ± 0,4 против 1,0 ± 0,9 случая в месяц, p = 0,036). Сравнивая полученные нами результаты с данными исследования OPAL, в котором частота гипогликемических событий составила 2,72 ± 6,11 пациенто-лет в группе завтрака и 3,69 ± 10,96 пациенто-лет в группе основного приема пищи, можно констатировать их соответствие. Одна из возможных причин более низкой частоты гипогликемии в группе рБП – более низкие дозы инсулина глулизин. Так, к шестому месяцу суточная доза инсулина глулизин составила 11,4 ± 6,2 ЕД в группе рБП и 28,4 ± 8,9 ЕД в группе рББ (p < 0,001). Указанные дозы сопоставимы с дозами инсулина глулизин, которые были задокументированы в исследовании OPAL (11 и 12 ЕД/сут к моменту достижения конечной точки). Дозы базального инсулина к шестому месяцу лечения также были ниже в группе рБП, чем в группе рББ (0,34 ± 0,15 против 0,37 ± 0,14 ЕД/кг соответственно, p = 0,048).
Известно, что количество инъекций может влиять на приверженность пациентов лечению и степень удовлетворенности таковым [12]. Низкая приверженность лечению обусловливает недостаточный гликемический контроль и может являться причиной развития осложнений. В исследовании продемонстрировано, что в группе рББ более 90% пациентов получали инъекцию утром, днем и вечером. Это значит, что почти всем пациентам этой группы приходилось делать инъекции три раза в сутки для достижения целевых уровней глюкозы в крови. С этой точки зрения режим «базал-плюс», при котором пациенты получают только одну прандиальную инъекцию в сутки, может иметь важные преимущества.
Одной из целей настоящего исследования был анализ переменных качества жизни. Вместе с тем, несмотря на преимущества рБП в отношении количества инъекций, наше исследование не продемонстрировало различий в показателях качества жизни. Наблюдательные исследования имеют ограничения на получаемые результаты, что связано с неполнотой данных и невысокой стандартизацией показателей (как пример, измерения в разных лабораториях). В данном исследовании были зарегистрированы только шесть нежелательных явлений у четырех пациентов. Два из них были классифицированы как несерьезные, четыре – как серьезные. Три нежелательных реакции из четырех зафиксированы у одного и того же пациента, ни одна из них не была расценена как связанная с исследуемым препаратом. Таким образом, исследование не выявило никаких сигналов в отношении профиля безопасности оцениваемых препаратов и режимов терапии.
Вывод
Результаты исследования соответствуют ранее опубликованным данным и свидетельствуют о том, что режим «базал-плюс» является эффективной альтернативой режиму «базал-болюс» у пациентов с СД 2 типа, которым показана интенсификация инсулинотерапии. Режим «базал-плюс» продемонстрировал эффективность в отношении снижения HbA1c, ГПН и ППГ при меньшем риске гипогликемии, что, скорее всего, связано с использованием меньших доз инсулина.
Данные получены на популяции с СД с неадекватным гликемическим контролем. Эта популяция считается более тяжелой, чем популяция исследования OPAL. Кроме того, они получены из реальной клинической практики. Поэтому эти данные могут быть полезны эндокринологам и другим специалистам при выборе подходов к интенсификации инсулинотерапии с учетом показателей эффективности, безопасности и потребностей пациента.
Благодарность
Автор выражает благодарность участникам, персоналу исследования, ООО «Лиганд ресерч» и исследователям за участие в программе.
Редакционная поддержка и помощь в написании статьи была предоставлена ООО «Лиганд ресерч» при финансовой поддержке компании «Санофи». Компания «Санофи» выступила спонсором исследования.
Сведения о конфликте интересов
Автор статьи входил в состав экспертного совета и получал гонорары за консультационные услуги от компаний «Эли Лилли», «Санофи», «Такеда», «Сервье», «АстраЗенека», «Берингер Ингельхайм», а также гранты/поддержку исследований от компании «Санофи».
A.M. Mkrtumyan, MD, PhD, Prof.
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinic Scientific Center
Contact person: Ashot M. Mkrtumyan, vagrashot@mail.ru
Summary: the aim of the study: to determine the proportion of patients who achieved individual target levels of postprandial glycemia ≥ 2 hours after the main meal (2h-PPG), who were assigned the basal-plus or basal-bolus regimen by doctor.
Material and methods. Data was collected as part of a non-intervention, multicenter, prospective 6-month register study in real clinical practice involving patients with type 2 diabetes mellitus (T2DM) in whom basal insulin therapy was intensified by at least one prandial injection of insulin glulisine in 1–4 weeks before inclusion in the study. The study was conducted on the territory of the Russian Federation in 65 centers.
The primary objective was the proportion of study participants who reached individual 2h-PPG target levels after the main meal, who were assigned a basal-plus (BP) or basal-bolus (BB) insulin therapy regimen. No hypotheses were tested in the study.
Results. 212/657 (32.3%) patients of the study population were men, the average duration of type 2 diabetes was 9.9 ± 6.2 years. 657 patients were included in the study, the primary parameter was evaluated in 631 study participants. The treatment period averaged (SD) – 185.46 (9.35) days.
Patients in the BP and BB groups were comparable in demographic and anthropometric data. The initial level of glycated hemoglobin (HbA1c) was 9.1 ± 1.2%, fasting glucose (FPG) – 9.0 ± 1.7 mmol /L and PPG – 11.1 ± 2.0 mmol /L. The data of 631 patients who completed the study according to the research criteria showed that after 6 months, 83.5% of all patients reached the target levels of PPG (86.9 and 82.2% in the BP and BB regimes, respectively). Both regimens showed similar efficacy over 6 months of follow-up. There was no significant difference between the groups 3 and 6 months after the start of treatment. 25 patients changed the treatment regimen from BP to BB during follow-up. The average number (± SD) of hypoglycemia episodes per participant per month was 0.5 ± 0.4, median 0.4 in the BP group and 1.0 ± 0.9, median 0.7 in the BB group (p = 0.036). In this study, 6 adverse events were recorded in 4 (0.6%) patients. Two of them were classified as non-serious and four as being serious.
Conclusions. The results of this study showed that BP regimen is an effective alternative to BB treatment in patients with T2DM who are shown to have intensified insulin therapy. The results indicate the effectiveness of BP in reducing HbA1c, FPG and PPG comparable with BB in combination with a lower risk of hypoglycemia, which is likely to be associated with lower doses of insulin when using the BP regimen.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.