Снижение медикаментозной нагрузки при аллергическом рините
- Аннотация
- Статья
- Ссылки
- English


Введение
Организм контактирует с внешней средой, антигенами/аллергенами, микроорганизмами, вирусами и поллютантами через слизистые оболочки. Их поверхность огромна (около 300–400 м2). Слизистые оболочки покрывают все полые органы (респираторный тракт, носоглотка, слуховые проходы, внутренняя поверхность век), взаимодействующие с внешней средой, и служат барьером, защищающим организм от повреждающего воздействия агентов, вызывающих развитие инфекционных и неинфекционных процессов, в том числе аллергические заболевания. Здоровые слизистые оболочки надежно защищают организм от агрессивного влияния. Поверхность поврежденной слизистой оболочки обычно заселяется микроорганизмами, вследствие чего защитные функции организма снижаются [1–5]. Барьерная функция слизистых оболочек реализуется и поддерживается за счет комплекса неспецифических факторов (перистальтические движения, движение ресничек эпителия, отделение слизи, выделение ферментов), а также вовлечения специфических и неспецифических иммунных реакций, в частности местного, или мукозального, иммунитета.
Понятие местного (мукозального, лат. mucosa – слизистая оболочка) иммунитета было сформулировано в 1930-х гг. А.М. Безредкой, доказавшим важную роль системы иммунитета, связанную со слизистыми оболочками. Защитную функцию выполняют неспецифические и специфические иммунные механизмы. Иммунная система слизистой оболочки полости носа, равно как и системный иммунитет, обеспечивает защиту за счет врожденного (неспецифического) и приобретенного (адаптивного) иммунитета [6].
К распространенным причинам возникновения дефектов защитной системы слизистой оболочки полости носа относятся инфекционные (например, респираторные инфекции) и неинфекционные поражения. Из неинфекционных заболеваний часто встречается аллергический ринит (АР).
Актуальность профилактики АР обусловлена его широким распространением во взрослой популяции и ростом заболеваемости в детском возрасте. Кроме того, АР считается предвестником развития такого грозного заболевания, как бронхиальная астма (БА), которая нередко приводит к инвалидизации пациентов. Доказано, что лечение АР – профилактическая мера по предупреждению возникновения аллергической БА.
Клинические проявления АР возникают при контакте слизистой оболочки с причинно-значимым аллергеном. При этом аллергическая реакция развивается непосредственно в слизистой оболочке полости носа и околоносовых пазух и проявляется ринореей, приступами чихания, зудом в носу и затруднением носового дыхания.
Слизистая оболочка полости носа характеризуется многочисленными рефлекторными связями с другими органами и системами организма, что обусловливает негативное воздействие на них интраназальных патологических процессов. В научной литературе описаны рино-пульмонологический, рино-кардиальный, рино-церебральный и рино-васкулярный этиопатогенетические рефлексы. На фоне воспаления слизистой оболочки полости носа нарушается носовое дыхание, в нижние отделы дыхательных путей проникает большое количество поллютантов и усиливается их воздействие на респираторный эпителий. Из сказанного следует, что аллергические процессы в полости носа являются фактором риска развития ряда осложнений.
Аллергический ринит: распространенность, классификация, основные принципы терапии
По данным ARIA-2016, распространенность АР в мире среди детей достигает 2–25%, среди взрослых – 40%. Частота встречаемости подтвержденного АР у взрослых в Европе варьируется от 17 до 28,5% [7]. В России в течение последних 20 лет заболеваемость АР возросла в 4–6 раз и в зависимости от региона колеблется в пределах от 12,7 до 24% всего населения [8].
По данным ФГБУ «Центральный научно-исследовательский институт организации и информатизации здравоохранения» Минздрава России, в 2016 г. зарегистрирован 304 691 пациент с АР (207,9 на 100 тыс. населения) [9].
Аллергический ринит существенно снижает работоспособность, нарушает сон и качество жизни пациентов, а в ряде случаев становится изнуряющим заболеванием.
Аллергическое воспаление в слизистой оболочке полости носа, возникшее после контакта с аллергеном, может сохраняться длительное время после воздействия последнего, согласно концепции «минимального персистирующего воспаления», и приводить к назальной гиперреактивности. Вместе с тем симптомы АР носят обратимый характер и купируются после прекращения экспозиции аллергенов или в результате лечения.
В международных согласительных документах по АР (EAACI/WAO, ARIA-2008, 2010) предусмотрена классификация АР, которая в настоящее время считается предпочтительной. АР подразделяют:
- по характеру течения: интермиттирующий (симптомы беспокоят менее четырех дней в неделю или менее четырех недель в году), персистирующий (симптомы беспокоят более четырех дней в неделю и более четырех недель в году);
- тяжести течения: легкая степень (у пациента имеются лишь незначительные клинические проявления болезни, не нарушающие дневную активность и сон), средняя (симптомы нарушают сон пациента, препятствуют работе, учебе, занятиям спортом, качество жизни существенно ухудшается), тяжелая (симптомы настолько выражены, что пациент в отсутствие лечения не может нормально работать, учиться, заниматься спортом или проводить досуг и спать ночью);
- стадии течения (стадия обострения и стадия ремиссии) [10].
Оптимальная терапия АР, профилактика утяжеления его течения, присоединения БА, возникновения осложнений (синуситы, средний отит и др.) невозможны без своевременной верификации диагноза. Необходимо выявить причинно-значимый аллерген (аллергены), определить характер течения (интермиттирующий или персистирующий) заболевания, его стадию, степень тяжести. Традиционно для диагностики используют кожное тестирование, лабораторные методы диагностики, позволяющие выявлять специфические иммуноглобулины (Ig) класса E, в отдельных случаях – провокационные тесты. Иногда (невозможность проведения кожного тестирования, наличие сопутствующих заболеваний, реакции анафилаксии в анамнезе, полисенсибилизация) для верификации диагноза применяют молекулярную аллергодиагностику.
Первоочередная мера при АР – предотвращение или сокращение контакта с аллергенами и триггерами. Пациентам с АР назначают фармакотерапию, специфическую иммунотерапию аллергенами, проводят с ними обучение.
Для достижения контроля используется четырехступенчатая терапия. Каждая ступень предусматривает схемы фармакологической терапии в зависимости от выраженности симптомов АР [11]. Как и при БА, принцип ступенчатого подхода при АР заключается в увеличении объема терапии/переходе на ступень вверх (step-up) в отсутствие контроля симптомов АР и снижении объема терапии/переходе на ступень вниз (step-down) при достижении и поддержании контроля.
В настоящее время для контроля симптомов АР применяются пероральные и топические (интраназальные) антигистаминные препараты (АГП), антагонисты лейкотриеновых рецепторов, интраназальные глюкокортикостероиды (ИнГКС) и комбинированные препараты ИнГКС и интраназального АГП.
Самым действенным способом лечения АР, но в большинстве случаев неосуществимым является исключение контакта с причинно-значимыми аллергенами, раздражителями, микроорганизмами. В качестве альтернативы рассматривают меры, непосредственно защищающие слизистую оболочку полости носа и предотвращающие контакт с аллергенами.
Последние годы в силу высокой безопасности и достаточной клинической эффективности широкое распространение получили барьерные методы лечения АР. Они характеризуются способностью предупреждать или снижать проницаемость слизистых оболочек для аллергенов, препятствовать трансбарьерной сенсибилизации и развитию/обострению аллергической реакции на действие аллергена.
Ранее предпринимались попытки использовать в качестве барьерных различные средства: белый вазелин [12, 13], мазь на липидной основе [14, 15], микроэмульсию [16, 17], липосомную рецептуру [18], гель с морской водой [19]. Однако в отличие от запатентованной формулы и устройства микрокристаллической гидроксипропилметилцеллюлозы (ГПМЦ) (препарат Назаваль®) многие из перечисленных средств оказались неэффективными в защите слизистой оболочки полости носа. По мнению ряда ведущих авторов ARIA, рассмотревших дополнительные терапевтические варианты лечения АР, микродисперсный порошок ГПМЦ можно считать дополнительным способом барьерной защиты слизистой оболочки полости носа и усиления эффекта лекарственных препаратов в снижении выраженности симптомов АР.
Назаваль®: характеристика и механизм действия
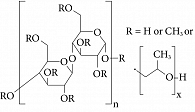
Эфиры ГПМЦ относятся к обширному семейству водорастворимых полимеров, которые связывают и удерживают воду, хорошо сгущаются и образуют пленку при нанесении на кожу или поверхность слизистой оболочки [20]. Основой ГПМЦ служит безводное глюкозное кольцо, с которым с помощью эфирных связей соединены гидроксипропильные и метильные остатки (рис. 1).
Назаваль® представляет собой микродисперсный порошок ГПМЦ в спрее-дозаторе. Механизм его действия заключается в защите слизистой оболочки полости носа от проникновения в организм аэроаллергенов (пыльцы растений, бытовых аллергенов, эпидермальных аллергенов животных и птиц) и других аэрополлютантов, попадающих в полость носа при вдыхании воздуха. Микродисперсный порошок ГПМЦ из спрея-дозатора попадает на слизистую оболочку носовых ходов, связывается со слизью и образует прозрачный гелеобразный слой, выстилающий носовую полость и служащий естественным барьером на пути проникновения аэроаллергенов и поллютантов в организм, препятствуя развитию аллергической реакции (рис. 2).
Впоследствии гель выводится благодаря работе мукоцилиарного аппарата. Целлюлозная добавка, в том числе порошок целлюлозы, безопасна, разрешена в странах Евросоюза (Е 460) и широко применяется в пищевой, кондитерской и медицинской промышленности, в качестве носителя, стабилизатора регулятора влаги, наполнителя или разделителя, причем для большинства продуктов питания без ограничения количества.
Микродисперсный порошок ГПМЦ характеризуется умеренным бактерицидным действием, однако не является лекарственным препаратом, а представляет собой защитное изделие медицинского назначения высокого 1-го класса безопасности, пригоден для длительного использования.
Назаваль® состоит только из натуральных компонентов, лишен системного действия, поэтому может использоваться в любом возрасте, у особых категорий больных, а также у работников, профессиональная деятельность которых требует высокой концентрации внимания. Назаваль® не вызывает сонливости, не влияет на аппетит, отличается быстрым началом действия (облегчение симптомов наступает в течение от десяти минут до трех часов), имеет уникальную систему дозирования, размещенную внутри флакона. Система позволяет впрыскивать точно отмеренную дозу микродисперсного порошка ГПМЦ, обеспечивая его равномерное распределение в полости носа. Рекомендованная доза – по одному впрыскиванию в каждый носовой ход три-четыре раза в день. Гелеобразная пленка, образуемая микродисперсным порошком ГПМЦ, легко удаляется при высмаркивании, поэтому после каждого очищения полости носа требуется повторное применение Назаваля [21].
Накоплен огромный многолетний опыт применения Назаваля при АР и получены убедительные данные его безопасности и клинической эффективности. В системный обзор 2017 г. вошли 26 клинических исследований, в которых оценивали характеристики Назаваля как барьерного средства для слизистой оболочки полости носа при АР, его способность предотвращать или задерживать диффузию аллергена, возможность превентивного использования после провокации аллергеном и эффективность как в монорежиме, так и в комбинации с лекарственными средствами [22]. Согласно данным системного обзора, средний размер микрочастиц ГПМЦ 118 мкм (от 5 до 500 мкм) позволяет проникать им только в носоглотку, не достигая трахеи, бронхов, бронхиол и альвеол. Гелеобразная защитная пленка, образуемая Назавалем на слизистой оболочке полости носа, играет важную роль в элиминации аллергенов.
В исследовании B. Diethart и соавт. диффузия аллергена клеща домашней пыли (Der р1) через гелеобразную пленку значимо снижалась во все временные точки (15, 30, 45, 60, 180 и 360 минут). Через 15 минут в основной группе только 0,76% базального количества аллергена диффундировало через пленку, через 360 минут – 14%, тогда как в контрольной группе (агарный гель) диффузия аллергена была 100%-ной [23].
Важным фактором, влияющим на депонирование ГПМЦ, являются гигроскопические свойства порошка, позволяющие ему абсорбировать влагу из воздуха. Гигроскопичность – природная способность материала поглощать влагу из окружающей среды. Как следствие, увеличивается размер частицы за счет агрегации, вызванной локальным растворением и вторичной кристаллизацией.
Микродисперсные порошки ГПМЦ являются полидисперсными. Это означает, что они содержат молекулы, способные к полимеризации и набору веса, что объясняет их способность к облегчению симптомов АР. При этом значение имеет не количество частиц, а их масса.
Исследователи проанализировали гигроскопичность и массу частиц интраназальной целлюлозы, применяемой для лечения пациентов с сезонным АР. Показано, что после 24 месяцев хранения размер частиц увеличивается на 14%. Частицы абсорбируют влагу из воздуха, находящегося в носовой полости, и увеличиваются в диаметре, занимая большое пространство в дыхательных путях. Таким образом, степень поглощения частиц и эффективность возрастают с увеличением их размера [24].
В одном из первых исследований, проведенных в Англии весной 2003 г., с участием 102 взрослых больных сезонным АР продемонстрирована эффективность Назаваля у 77% пациентов [25].
После этого пилотного исследования были проведены двойные слепые плацебоконтролируемые рандомизированные исследования, результаты которых показали, что регулярное использование Назаваля во время пыльцевого сезона приводит к уменьшению количества принимаемых лекарственных средств. Сказанное означает, что микродисперсный порошок ГПМЦ снижает потребность в лекарственных препаратах в период обострения сезонных проявлений АР.
В открытом наблюдательном исследовании J.B. Minov и соавт. оценивали эффективность и безопасность Назаваля в качестве дополнительного лечения у 74 пациентов со средней степенью тяжести сезонного АР [26]. Пациенты принимали пероральный цетиризин в комбинации с Назавалем или без него. Период наблюдения длился десять дней. Согласно результатам исследования, пациентов, принимавших цетиризин с Назавалем и получивших оценку полного контроля, было значительно больше, чем пациентов, получавших только цетиризин. Низкая частота неблагоприятных эффектов зарегистрирована в обеих группах.
В двойном слепом плацебоконтролируемом исследовании две сравнимые группы пациентов с АР принимали Назаваль® или плацебо, а также другие препараты [27]. В исследование были включены 97 взрослых пациентов с симптомами АР в сезон пыления злаковых трав. Значимых различий в отношении симптомов АР в сравниваемых группах не выявлено. Вместе с тем установлена существенная разница в объеме фармакотерапии в группах. Чаще использовались АГП. В основной группе их принимали 29% пациентов, в группе плацебо – 33%. Значимых различий между группами не зафиксировано. Но при анализе применения АГП в целом (количество больных, использовавших АГП независимо от того, применялись они в монорежиме или в комбинации с другими препаратами) таких пациентов в группе активного лечения насчитывалось 34%, в группе плацебо – 48% (p < 0,05). Вторыми по частоте использования были ИнГКС. С учетом всех дней с умеренным и выше умеренного уровнем содержания пыльцы травы в воздухе назальные спреи использовали 10% пациентов основной группы и 14% пациентов группы плацебо (p < 0,05). 57% пациентов основной группы принимали только инертный порошок целлюлозы и не использовали другие фармакологические препараты. В группе плацебо таковых насчитывалось 44%. Результаты исследования показали, что применение инертного порошка целлюлозы сокращает применение фармакологических лекарственных препаратов для контроля симптомов АР, что особенно важно в определенных популяциях больных (дети, пожилые люди, беременные и кормящие женщины).
Клинический случай
Пациентка 26 лет. Жалобы на заложенность носа в дневные часы, обильные водянистые выделения из носа, приступы чихания, зуд в носоглотке, периодически слезотечение и зуд век. Симптомы возникали ежегодно в апреле – мае, но их выраженность была разной интенсивности. Известно, что отец пациентки много лет страдал БА, имел сенсибилизацию к клещам домашней пыли.
В 14-летнем возрасте у пациентки впервые после употребления орехов появились зуд в ротоглотке, отек губ, заложенность носа. Позже при употреблении черешни возникли зуд и жжение в полости рта. В 18 лет пациентка переехала из Краснодарского края в Москву. Через год в весенний период впервые наблюдались ринорея, зуд в носоглотке, а в сухую ветреную погоду – приступы чихания, зуд век и слезотечение. Самостоятельно принимала противовирусные препараты, сосудосуживающие капли, эпизодически АГП. В 2015 г. в весенний период симптомы повторились с большей интенсивностью, и пациентка впервые обратилась к аллергологу-иммунологу.
При специфическом аллергологическом обследовании (кожные скарификационные тесты), проведенном вне сезона палинации, выявлена сенсибилизация к пыльце березы, ольхи, орешника, дуба. В клиническом анализе крови – эозинофилия 10%. Рентгенография околоносовых пазух – без патологии. Диагностированы сезонный АР средней степени тяжести, аллергический конъюнктивит, сенсибилизация к пыльце деревьев, перекрестная пищевая аллергия к косточковым, орехам с клиникой орального аллергического синдрома и АР. Рекомендованы ИнГКС и АГП второго поколения.
В 2016 г. начат курс аллергенспецифической иммунотерапии водно-солевыми аллергенами из пыльцы березы, ольхи, орешника. Однако курс завершить не удалось из-за сложностей с регулярным посещением аллергологического кабинета.
В следующем пыльцевом сезоне у пациентки сохранялись проявления ринита и конъюнктивита. Весной 2018 г. она получала АГП второго поколения, ИнГКС с клиническим эффектом: заложенность носа, ринорея и чихание уменьшились.
В апреле 2019 г. пациентка вновь обратилась к аллергологу с жалобами на чихание, ринорею, заложенность носа, зуд век, слезотечение. На момент осмотра пациентка была беременна, предположительный срок гестации – 12 недель. В клиническом анализе крови – эозинофилия 8%. ЛОР-врачом диагностирован АР. Другой патологии не выявлено. Рекомендована консультация акушера-гинеколога для оценки течения беременности и состояния плода. Заключение гинеколога: течение беременности без отклонения от нормы, срок – 12–13 недель.
Пациентке рекомендовано проведение элиминационных мероприятий: снижение продолжительности пребывания на улице в солнечную, ветреную погоду, ношение одежды с длинными рукавами, смена одежды по возвращении домой, в ясную солнечную погоду (особенно по утрам) – ношение солнцезащитных очков. Необходимо чаще проводить влажную уборку, проветривание (лучше вечером), использовать воздухоочиститель, на окна, форточки, фрамуги натянуть специальные сетки (марлю). Из пищевого рациона предписано исключить орехи, яблоки, косточковые (вишню, черешню, сливу и т.п.), морковь. Необходимо проводить носовое орошение спреями Аквамарис или Аквалор утром и вечером, а также после прогулки. Назначен спрей Назаваль® по одному впрыскиванию в каждый носовой ход три-четыре раза в день (через каждые пять-шесть часов) как минимум за 15 минут до выхода на улицу. Однако Назаваль® можно применять чаще (например, повторно после каждого очищения носовой полости для возобновления защитного слоя). Пациентке разъяснили природу ее заболевания, принципы терапии, ожидаемые результаты, возможные риски и представили методику применения препарата Назаваль® [28]:
- шаг 1: при необходимости перед применениемпри провести гигиеническую очистку полости носа или высморкаться;
- шаг 2: аккуратно встряхнуть флакон. При первом использовании сделать один-два пробных впрыска в воздух;
- шаг 3: зажать пальцем один носовой ход, сделать впрыск порошка на вдохе в противоположный носовой ход, нажав на стенки флакона. Такую же процедуру повторить с другой стороны (рис. 3).
Кроме того, больной назначили цетиризин 10 мг/сут ситуационно при нарастании клинической симптоматики.
Как известно, причины возникновения назальных симптомов у беременных различны. Но только развитие тяжелых симптомов заставляет обратиться к врачу. Чаще пациентки не используют лекарственные средства вообще или применяют сосудосуживающие препараты по собственному усмотрению, полагая, что эндоназальное применение не навредит плоду. Задача врача – выяснить причину появления симптоматики и наметить тактику ведения. Эндокринные сдвиги во время беременности могут повлиять на степень тяжести АР и степень назальной обструкции. В ряде случаев АР создает предпосылки для развития гормонального ринита беременных [29]. Как правило, у беременных АР протекает в тяжелой форме и характеризуется практически постоянной ринореей, заложенностью носа, бессонницей, частыми эпизодами чихания, слезотечением, гиперемией склер, зудом в носу и глаз, век, светобоязнью, снижением обоняния, головной болью [30]. Вызванные постоянным затруднением носового дыхания нарушения сна, концентрации внимания, утомляемость, головная боль существенно снижают качество жизни, сказываются на течении сопутствующих заболеваний и повышают степень риска осложнений беременности и нарушений развития плода. Любая фармакотерапия во время беременности имеет особенности и определенные сложности. Четких методических рекомендаций по лечению АР у беременных не существует.
В 15 европейских странах с 2011 по 2012 г. изучали профиль безопасности лекарственных средств, которые применялись во время беременности. Из 587 использовавшихся препаратов 69% классифицированы как безопасные, 28% – связанные с риском. 3% лекарственных средств не вошли ни в одну из классификаций. Показано, что до 80% женщин в период гестации используют хотя бы один препарат [31].
Основное правило применения лекарственных средств при беременности – соблюдение оптимального соотношения его пользы и риска развития побочного действия на плод. Применение лекарственных средств во время беременности способно приводить к неблагоприятным исходам беременности и неонатальным последствиям: нарушению внутриутробного развития, врожденным дефектам, недоношенности, отдаленным последствиям, потере плода.
Консультирование беременных при назначении лекарственных средств часто осложняется отсутствием данных об их безопасности. Обычно информация в инструкциях к препарату неполная и касается исследований на животных [32].
Следует отметить, что абсолютное большинство лекарственных средств проникают через плаценту и потенциально могут вызвать фармакологические эффекты у плода. Вместе с тем количество препарата, проникающего через плаценту, зависит от терапевтической дозы, кратности введения и способа применения. Медикаментозное лечение беременных проводят с учетом потенциальной опасности назначаемых препаратов для матери и будущего ребенка. Препараты назначают, когда ожидаемая польза превышает потенциальный риск.
АГП используются для лечения АР любой степени тяжести. Взаимодействуя с Н1-рецепторами гистамина, АГП стабилизируют их пассивную конформацию и препятствуют воздействию на них гистамина. Результаты большого количества наблюдений по использованию АГП у беременных в первом триместре не показали связи с развитием врожденных пороков [33, 34]. Метаанализ применения АГП более чем 200 000 беременными продемонстрировал отсутствие тератогенного риска препаратов в организме [34]. Лоратадин и цетиризин признаны безопасными для беременных.
При ведении беременной врач должен обсудить с ней назначение всех лечебных мероприятий, ответить на все ее вопросы и развеять опасения, связанные с риском развития серьезных врожденных пороков на фоне применения лекарственных средств [35].
Заключение
Врач, под наблюдением которого находится беременная, должен учитывать следующее:
- ни одно лекарственное средство, даже для местного применения, не может считаться абсолютно безопасным для плода;
- потенциальная польза от применения препарата должна превышать потенциальный вред, который может быть нанесен и беременной, и плоду.
Назначая лечение беременной с АР, необходимо:
- установить или уточнить диагноз;
- проанализировать тяжесть состояния;
- выяснить, имелись ли симптомы болезни до наступления беременности;
- уточнить схему ранее проводимой терапии и ее эффективность;
- получить сведения о течении беременности и состоянии плода;
- уточнить течение аллергического заболевания во время предыдущих беременностей.
Лечение должно быть обоснованным, адекватным, основанным на современных достижениях науки, сведениях о безопасности и проводиться под контролем врача. Только в этом случае можно достичь максимального контроля симптомов болезни, снизить негативное влияние заболевания на течение беременности и развитие плода. Хороший контроль заболевания позволяет беременной благополучно выносить и родить здорового ребенка.
Микродисперсный порошок гидроксипропилметилцеллюлозы обеспечивает защиту слизистой оболочки полости носа беременной от повреждающих агентов, в том числе аллергенов, и уменьшает симптомы ринита.
Существует солидная доказательная база эффективности и безопасности Назаваля. Его защитные барьерные свойства продемонстрированы в ряде клинических исследований. Назаваль® характеризуется благоприятным профилем безопасности, он нетоксичен, и его доза в зависимости от нагрузки причинно-значимого аллергена может быть увеличена.
Спрей Назаваль® может применяться у женщин в период беременности и лактации, поскольку его безопасность относится к наивысшему классу по классификации средств медицинского назначения.
O.V. Sebekina, PhD, Ye.V. Peredkova, PhD, N.M. Nenasheva, MD, PhD, Prof.
Russian Medical Academy of Continuing Professional Education
Contact person: Oksana V. Sebekina, sebekin1@mail.ru
There are currently many pharmacological preparations of both local and systemic effects for the control of the symptoms of allergic rhinitis (AR). Most drugs have certain side effects that limit their use in pregnant women, children, and elderly patients. In this situation the most appropriate solution is the creation of a mechanical barrier to allergens from entering the nasal mucosa, which can prevent or alleviate the symptoms of the disease. Our article describes the clinical case of treatment of AR in the patient during pregnancy with the use of microdispersed hydroxypropyl methylcellulose powder (HPMC). HPMC microdispersed powder (Nazaval®) is a safe measure of an additional barrier protection of the nasal mucosa and an improvement of the effect of drugs to control the symptoms of AR.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.