Сахарный диабет 2 типа: выбор сахароснижающего препарата
- Аннотация
- Статья
- Ссылки
- English

В настоящее время около 200 млн жителей планеты страдают сахарным диабетом (СД). Согласно прогнозу экспертов Всемирной организации здравоохранения, число больных СД к 2015 г. превысит 300 млн человек. С учетом преждевременной инвалидизации пациентов и высокой смертности вследствие сосудистых осложнений эффективное лечение гипергликемии является чрезвычайно важной задачей. Частоту этих нежелательных явлений можно значительно снизить за счет достижения уровня гликемии, близкого к норме [1–3].
Медикаментозное снижение гипергликемии достигается на фоне приема препаратов, влияющих на основные патогенетические звенья этого нарушения. В развитии СД 2 типа особая роль принадлежит двум механизмам – прогрессирующему нарушению функции бета-клеток поджелудочной железы и выраженности инсулинорезистентности. При манифестации СД 2 типа секреция инсулина в среднем снижается на 50%, чувствительность тканей к нему – на 70% [4]. В целях предотвращения дальнейшей потери инсулиносекреторного потенциала бета-клеток поджелудочной железы именно этот период заболевания наиболее значим. Заболевание носит прогрессирующий характер, и вследствие снижения количества активно функционирующих бета-клеток достижение клинического эффекта со временем становится более затруднительным. К тому же традиционные пероральные сахароснижающие препараты не способны восстановить функцию бета-клеток [3, 5, 6].
Согласно существующей концепции сниженного эффекта инкретинов при СД 2 типа именно инкретины ответственны за 50–70% постпрандиальной секреции инсулина [6–8]. Речь идет о гормонах желудочно-кишечного тракта, стимулирующих секрецию инсулина и подавляющих секрецию глюкагона в ответ на прием пищи, таких как глюкагоноподобный пептид 1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ГИП). Инсулинотропный эффект инкретинов проявляется только при повышенной концентрации глюкозы в крови. Считается, что пептиды активируют накопление запасов инсулина в бета-клетках, стимулируя биосинтез инсулина, что обусловлено активацией транскрипции гена проинсулина и инсулина с последующим повышением биосинтеза и стабильности матричной рибонуклеиновой кислоты (мРНК) [8, 9]. У больных СД 2 типа эффективность эндогенных инкретинов снижается, что может быть связано с нарушением процессов секреции ГПП-1, ускоренным метаболизмом ГПП-1 и ГИП или нечувствительностью клеточных рецепторов к инкретинам [5, 7].
С учетом последних данных о патофизиологии данного состояния, влиянии различных терапевтических стратегий на темпы прогрессирования заболевания, развитие осложнений и исходы у больных СД созданы принципиально новые сахароснижающие препараты [10, 11]. Кроме того, пересматриваются устоявшиеся взгляды на подходы к ведению пациентов с СД. Современные требования к сахароснижающей терапии предполагают не только эффективный и безопасный контроль гликемии, но также низкий риск развития гипогликемии и прибавки массы тела, отсутствие негативного влияния на сердечно-сосудистые исходы [1, 12–14]. Лечение должно быть направлено как на достижение контроля гликемии, так и на предупреждение прогрессирования СД 2 типа за счет снижения инсулинорезистентности и улучшения функции бета-клеток [5]. Клиническое значение имеют пути метаболизма и выведения сахароснижаюших средств. Дело в том, что вследствие патологии почек и печени у ряда больных СД 2 типа применение некоторых препаратов может быть ограничено [15–17].
Инкретин-направленная терапия
Сегодня особая роль в оказании помощи больным СД 2 типа принадлежит инкретин-направленной терапии. Ее создание и внедрение в клиническую практику стало поворотным моментом в лечении заболевания [10, 18, 19]. У врачей появилась возможность обеспечивать контроль уровня гликемии, близкого к физиологическому, без риска гипогликемии (выработка инсулина и подавление секреции глюкагона исключительно в ответ на гипергликемию) [3, 13, 20]. К лекарственным средствам, действие которых основано на эффектах инкретинов, относятся ингибиторы дипептидилпептидазы 4 (иДПП-4), без которых лечение СД 2 типа представить невозможно. Ингибирование фермента ДПП-4 позволяет решить ряд проблем, связанных с использованием аналогов ГПП-1. В частности, это касается режима введения (инъекции) и такого нежелательного явления, как тошнота [9–11].
Уникальный механизм действия позволяет применять препараты группы иДПП-4 как в виде монотерапии, так и в сочетании с традиционными средствами [18, 11, 21]. Они назначаются независимо от приема пищи, в целом отличаются хорошей переносимостью, в рамках монотерапии снижают HbA1с на 0,5–1,06%, характеризуются низким риском развития гипогликемических состояний и потенциально протективным эффектом в отношении бета-клеток [5, 10, 13]. Эти препараты оказывают нейтральный эффект в отношении массы тела, что немаловажно, поскольку ее контроль при СД 2 типа – второй после HbA1с по значимости параметр [6, 12, 22]. Ингибиторы ДПП-4 имеют преимущество перед другими сахароснижающими средствами [7] и рассматриваются в качестве препаратов второй линии при неэффективности терапии метформином. Однако их применение на ранних стадиях заболевания при наличии противопоказаний и/или непереносимости метформина приносит ощутимую пользу. Нельзя не отметить высокий сердечно-сосудистый потенциал иДПП-4. Препараты обеспечивают эффективный гликемический контроль и обладают благоприятным сердечно-сосудистым профилем [9, 10, 12, 13].
Клинические возможности линаглиптина
Одним из последних иДПП-4 в арсенале эндокринологов появился линаглиптин (Тражента). Его молекула имеет ксантиновую структуру, благодаря чему препарат активно связывается с ферментом ДПП-4 (связь обратимая), что вызывает устойчивое повышение концентрации инкретинов и длительное сохранение их активности [23, 24]. Особые фармакологические свойства молекулы линаглиптина отличают его от других представителей иДПП-4 и обусловливают хороший клинический эффект у пациентов с СД 2 типа, в том числе у особых (определенных) категорий пациентов, у которых использование других сахароснижающих препаратов может быть ограничено [7, 16, 17]. Линаглиптин можно применять у большинства больных СД 2 типа с осложнениями и сопутствующими заболеваниями. Линаглиптин характеризуется высоким профилем безопасности, минимальным выведением через почки – лишь 5% перорально принятого препарата экскретируется этим путем. Кроме того, данное лекарственное средство не подвергается метаболизму в печени, что обусловливает низкий риск лекарственных взаимодействий с препаратами, метаболизируемыми в печени [23, 24].
Благодаря однократному приему линаглиптина в дозе 5 мг независимо от приема пищи повышается приверженность пациентов терапии. Коррекции дозы препарата при наличии нарушений функции почек и печени не требуется [16, 17, 23].
За время, прошедшее с момента появления в клинической практике линаглиптина, накоплена мощная доказательная база, свидетельствующая о сахароснижающей эффективности и благоприятном профиле безопасности препарата при применении в разных режимах (монотерапии, двойной и тройной комбинированной терапии), в том числе в комбинации с базальным инсулином [19, 21, 22, 25]. Причем максимальный терапевтический эффект наблюдался у пациентов с высокими исходными значениями HbA1с [26].
В последних рекомендациях метформин рассматривается как средство первой линии в лечении СД 2 типа [12, 27]. В клинической практике на этапе инициации сахароснижающей терапии нередки ситуации, когда терапия метформином не показана вследствие непереносимости или наличия противопоказаний к применению. Рассмотрим варианты дальнейшего лечения в таких случаях.
Интересные данные были получены в двойном слепом плацебоконтролируемом клиническом исследовании, включавшем пациентов с СД 2 типа и непереносимостью метформина из-за побочных эффектов со стороны желудочно-кишечного тракта или противопоказаний к терапии метформином вследствие нарушения функции почек [18]. Больные СД 2 типа были рандомизированы на две группы. Первая группа (n = 151) получала линаглиптин 5 мг, вторая (n = 76) – в течение 18 недель плацебо с заменой на глимепирид до 4 мг и продолжением терапии еще 34 недели. Изменение уровня HbA1с с поправкой на плацебо составило -0,6% после 18 недель (95%-ный доверительный интервал (ДИ) -0,88... -0,32, p < 0,0001) и сохранялось на протяжении 34 недель последующей двойной слепой фазы. При этом уровень HbA1с снижался до аналогичного уровня у пациентов, получавших плацебо и переведенных на глимепирид. Частота нежелательных явлений была аналогичной между группами в первые 18 недель и на протяжении всего исследования. Однако в группе линаглиптина регистрировалось меньше случаев гипогликемии (2,2 по сравнению с 7,8%) и не отмечалось увеличения массы тела по сравнению с глимепиридом (динамика относительно исходного веса -0,2 и +1,3 кг соответственно). Как известно, эффективному лечению СД 2 типа препятствует и то обстоятельство, что большинство пациентов с СД 2 типа имеют избыточную массу. С возрастом она, как правило, увеличивается, особенно при применении препаратов сульфонилмочевины (ПСМ) [3].
Если терапия метформином неэффективна…
В связи с прогрессирующим характером СД 2 типа достигать необходимого терапевтического эффекта на монотерапии со временем становится сложнее. Поэтому многие пациенты нуждаются в комбинированной сахароснижающей терапии. В схему лечения может быть введен ПСМ, но его прием часто ассоциируется с увеличением массы тела и риска гипогликемии [3, 9, 12]. В данном случае альтернативой может стать комбинированная терапия метформином и иДПП-4, клиническая значимость которой подтверждена в ходе исследований [7, 22, 26].
Возрастающий интерес к комбинации метформина и иДПП-4 вполне понятен. При такой терапии происходит одновременное воздействие на различные патофизиологические звенья заболевания, что гарантирует высокий сахароснижающий потенциал – уменьшение НbА1с может достигать 1,7% [10, 11]. В этом случае механизм действия иДПП-4 дополняет основные фармакологические эффекты метформина – снижение эндогенной продукции глюкозы печенью и улучшение чувствительности тканей к инсулину. Такая комбинация характеризуется низким риском развития гипогликемий [20, 28]. Напомним, что применение метформина не способствует высвобождению инсулина. В свою очередь иДПП-4 обладают глюкозозависимым сахароснижающим эффектом, то есть оказывают влияние только при повышенном уровне гликемии.
При выборе сахароснижающей терапии у больных СД 2 типа предпочтение следует отдавать препаратам, на фоне приема которых масса тела не увеличивается (у большинства пациентов она повышена изначально). К сахароснижающим препаратам, потенциально увеличивающим массу тела, относятся производные ПСМ, тиазолидиндионы, инсулин. Метформин и иДПП-4 нейтральны в отношении влияния на массу тела. В этом преимущество данных препаратов и их комбинации [5, 12, 21].
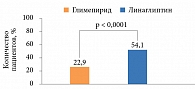
Многие врачи рассматривают иДПП-4 в качестве альтернативы ПСМ в тех случаях, когда достичь компенсации заболевания метформином у больных не удается. Линаглиптин эффективен и хорошо переносится в составе комбинированной терапии [22, 26]. Одним из весомых аргументов в пользу такого выбора служат результаты клинического исследования (104 недели), посвященного оценке долгосрочной эффективности и безопасности линаглиптина по сравнению с глимепиридом в качестве второй линии терапии [25]. Больные СД 2 типа с недостаточным контролем гликемии, несмотря на терапию метформином, были рандомизированы на две группы. Первая группа (n = 777) получала линаглиптин 5 мг, вторая (n = 775) – глимепирид до 4 мг в течение двух лет. По выраженности сахароснижающего эффекта относительно исходного уровня HbA1с добавление линаглиптина к метформину не уступало комбинации метформина и глимепирида. При этом отмечалось значительно меньше случаев гипогликемии на фоне терапии линаглиптином по сравнению с глимепиридом, несмотря на одинаковую степень снижения значений HbA1с в обеих группах. По окончании исследования линаглиптин демонстрировал преимущество перед глимепиридом в ходе длительной терапии, о чем свидетельствовал процент пациентов, достигших HbA1с < 7%, без гипогликемии и увеличения массы тела. Существенно больше пациентов, получавших линаглиптин, достигло HbA1с < 7% без гипогликемии и увеличения массы тела по сравнению с пациентами из группы глимепирида – 54,1 и 22,9% соответственно (отношение рисков (ОР) 3,86 [95% ДИ 2,63–5,68], p < 0,0001) (рис. 1). Безусловно, сопутствующие терапии ПСМ гипогликемии и повышение массы тела у пациентов с СД 2 типа приводят к дальнейшему увеличению сердечно-сосудистого риска, который и без того высок у такой категории пациентов [1, 3]. В то же время полученные данные свидетельствуют о хорошем профиле сердечно-сосудистой безопасности при долгосрочном применении линаглиптина (рис. 2) [7, 25, 29].
Линаглиптин может эффективно использоваться в комбинированной терапии как с метформином, ПСМ, так и с инсулином [14, 21, 22]. Добавление линаглиптина к базальному инсулину позволяет значительно улучшить гликемический контроль независимо от вида базального инсулина, возраста пациентов, степени нарушения функции почек. При этом эффективный контроль гликемии на фоне терапии линаглиптином не сопровождается увеличением частоты развития гипогликемии [19].
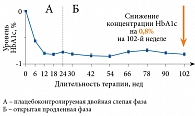
Значительный интерес представляют результаты долгосрочных клинических исследований линаглиптина (n = 2121), в которых терапия препаратом и наблюдение за пациентами продолжались до двух лет [29] (рис. 3).
Было проанализировано четыре режима использования линаглиптина: монотерапия, терапия в комбинации с метформином, терапия в комбинации с метформином и ПСМ и терапия первой линии в комбинации с пиоглитазоном в течение 24 недель с последующим расширением исследования до 102 недель и теми же режимами терапии линаглиптином (n = 1532). Пациентам, ранее получавшим плацебо, был добавлен линаглиптин.
В когорте пациентов, продолжавших терапию линаглиптином в течение двух лет, отмечалось стойкое сохранение достигнутых на 24-й неделе уровней контроля гликемии со снижением уровня HbA1с на 0,8% (коэффициент устойчивости за 78 недель терапии – 0,14%, p < 0,0001). Целевых значений HbA1с от < 7,0% на 78-й неделе терапии достигли 42,3% пациентов, в группе изначально получавших линаглиптин в монотерапии или в комбинации с другими пероральными сахароснижающими препаратами, и 46,1% пациентов, в группе получавших плацебо в предыдущих исследованиях, которым в фазе расширенного исследования вместо плацебо была назначена монотерапия линаглиптином.
При выборе сахароснижающего средства не следует забывать о сердечно-сосудистой безопасности [1, 2, 13]. Результаты широкомасштабных исследований продемонстрировали, что гипогликемия является независимым фактором сердечно-сосудистого риска [20, 30]. Длительное время гипогликемия при СД 2 типа расценивалась как неизбежное состояние. В то же время линаглиптин, как и другие иДПП-4, характеризуется крайне низким риском развития гипогликемических состояний [7, 11, 18]. У врачей, наконец, появилась возможность достигать и поддерживать уровень HbA1с, близкий к норме, при низком риске развития гипогликемий. Повышение такого риска отмечалось только при комбинированной терапии линаглиптином и ПСМ. В связи с этим в инструкцию по применению препарата было внесено соответствующее предупреждение [14, 21, 23].
С позиций сердечно-сосудистой безопасности следует отметить, что применение линаглиптина не отражалось на параметрах интервала QT на электрокардиограмме, удлинение которого ассоциируется с сердечными аритмиями [31]. Причем даже двадцатикратно увеличенная доза линаглиптина не приводила к увеличению интервала QT.
Принимая во внимание высокий сердечно-сосудистый риск у больных СД 2 типа, уместно остановиться на данных объединенного анализа восьми проспективных клинических исследований III фазы c участием 5239 пациентов с СД 2 типа (линаглиптин принимали 3319 больных, препарат сравнения – 1920 пациентов) [32]. Первичной конечной точкой исследования были сердечно-сосудистая смерть или время до сердечно-сосудистой смерти, инсульта, инфаркта миокарда и госпитализации по поводу нестабильной стенокардии. Согласно результатам исследования применение линаглиптина не ассоциируется с повышением сердечно-сосудистого риска у пациентов с СД 2 типа. ОР для первичной конечной точки продемонстрировало более низкий риск развития сердечно-сосудистых событий на фоне приема линаглиптина по сравнению с другими препаратами (ОР 0,34 [95% ДИ 0,16–0,70]).
Полученные результаты очень важны для определения эффективной стратегии сахароснижающей терапии, направленной на улучшение отдаленного прогноза у больных СД 2 типа.
Особые требования предъявляются к долгосрочной сердечно-сосудистой безопасности сахароснижающих средств [1, 2, 13]. Наиболее широко сердечно-сосудистая безопасность линаглиптина будет изучена в исследованиях Саrmelina (плацебоконтролируемом исследовании, посвященном сердечно-сосудистой безопасности и почечным исходам на фоне терапии линаглиптином) и Carolina (прямом сравнении линаглиптина и глимепирида в отношении сердечно-сосудистых исходов). Окончательные результаты этих исследований ожидаются к 2017–2018 гг.
Применение линаглиптина в особых клинических случаях
СД 2 типа нередко сочетается с хронической болезнью почек (ХБП), патологией печени, что требует не только эффективной, но и безопасной сахароснижающей терапии [15, 17, 33].
Диабетическая нефропатия представляет собой одно из наиболее серьезных и инвалидизирующих последствий СД 2 типа. Со временем примерно у трети больных СД 2 типа может развиться ХБП [34]. Нарушение почечной функции накладывает серьезные ограничения на выбор сахароснижающего средства [3, 16, 35]. Кроме того, ХБП вносит лепту в повышение риска гипогликемий вследствие сниженного клиренса креатинина и приема некоторых сахароснижающих средств, а также нарушения ренального глюконеогенеза и требует от сахароснижающей терапии минимизации подобных рисков [35]. Напомним, что 95% перорально принятого линаглиптина экскретируется желчью через пищеварительный тракт, поэтому нарушение функции почек не оказывает существенного влияния на фармакокинетику такого иДПП-4 [16, 23].
Длительное использование линаглиптина безопасно при любом нарушении функции почек. Более того, в отличие от других иДПП-4 коррекции дозы линаглиптина не требуется [7, 16, 23].
В двойном слепом плацебоконтролируемом исследовании [35] изучали эффективность и безопасность линаглиптина у 133 пациентов с тяжелой почечной недостаточностью (скорость клубочковой фильтрации (СКФ) ≤ 30 мл/мин/1,73 м²). Линаглиптин добавляли к уже применявшейся сахароснижающей терапии (инсулин или любая комбинация с инсулином; ПСМ или глиниды в качестве монотерапии; пиоглитазон или любые другие препараты, за исключением иДПП-4) при неадекватно контролируемой гипергликемии (исходный уровень HbA1с – 7,0–10,0%).
Применение линаглиптина 5 мг привело к клинически значимому снижению уровня HbA1с на 0,8% после 12 недель терапии, которое сохранялось до 52-й недели (изменение -0,72% по сравнению с исходным значением). В группе плацебо к этому сроку снижение уровня HbA1с составило 0,01%. Терапия линаглиптином хорошо переносилась пациентами: частота любых и серьезных нежелательных явлений была сходной в группах линаглиптина и плацебо. Функция почек в целом оставалась стабильной на протяжении всего периода исследования. Кроме того, не отмечалось разницы в частоте тяжелой гипогликемии по сравнению с группой плацебо. Таким образом, линаглиптин продемонстрировал эффективность и высокий профиль безопасности у больных СД 2 типа с тяжелой почечной недостаточностью.
Среди сопутствующих нарушений у больных СД 2 типа нередко встречается патология печени, в структуре которой неалкогольная жировая болезнь печени занимает первое место (70%) [17]. Кроме того, СД 2 типа выявляется у 30% пациентов с циррозом печени [15]. Это объясняет высокие требования к безопасности сахароснижающей терапии у больных с нарушениями функции печени. Однако выбор препаратов в данной клинической ситуации не так широк.
В клиническом исследовании у пациентов с СД 2 типа и нарушениями функции печени разной степени тяжести, включая острый цирроз с портальной гипертензией, линаглиптин не вызывал дальнейшего ухудшения функции печени, частота побочных эффектов не возрастала, гипогликемические реакции не выявлялись [17]. Линаглиптин – практически единственный иДПП-4, который можно без ограничений применять у пациентов со сниженной функцией печени. Даже при тяжелом нарушении функции печени коррекции дозы линаглиптина не требуется [23].
Среди пациентов с СД 2 типа немало лиц старших возрастных групп. Приоритет в такой клинической ситуации следует отдавать сахароснижающим препаратам с минимальным риском гипогликемий [2, 20, 34]. Кроме того, необходим тщательный контроль функции почек, поскольку у больных СД 2 типа пожилого возраста может наблюдаться нормальная концентрация креатинина в крови на фоне низкой СКФ [30]. В этой связи при длительном применении более безопасны сахароснижающие средства с минимальным выведением через почки, метаболиты которых выводятся преимущественно с желчью и через кишечник.
Об эффективности и о хорошем профиле безопасности линаглиптина при лечении больных СД 2 типа пожилого возраста свидетельствуют результаты семи плацебоконтролируемых клинических исследований III фазы. В исследованиях принимали участие пациенты в возрасте ≥ 65 лет (n = 1331), длительность исследований составляла 24–52 недели [36]. Профиль безопасности препарата оценивали исходя из частоты и тяжести нежелательных явлений с акцентом на гипогликемии. Первичной конечной точкой эффективности было изменение значений HbA1с.
В общей сложности 841 пациент принимал линаглиптин 5 мг один раз в день, 490 пациентов – плацебо. Средний возраст участников исследований составил 71,0 ± 4,6 года, среднее исходное значение HbA1с – 8,0 ± 0,8%; 63,5% пациентов получали терапию двумя или более сахароснижающими препаратами.
Общее количество нежелательных явлений, связанных с приемом препарата, было сравнимо в группах линаглиптина и плацебо – 18,1 и 19,8% соответственно. Гипогликемия отмечалась у 21,4% пациентов из группы линаглиптина и у 25,7% – из группы плацебо. При этом эпизодов тяжелой гипогликемии в группе линаглиптина было меньше, чем в группе плацебо, – 1 и 1,8% соответственно. На 24-й неделе терапии плацебоскорректированное значение HbA1с на фоне терапии линаглиптином составило -0,62 ± 0,06% (95% ДИ -0,73... -0,51).
Результаты демонстрируют, что терапия линаглиптином в данной возрастной группе эффективна, хорошо переносится, способствует достижению индивидуальных гликемических целей и главное – позволяет контролировать гипогликемические риски у пожилых пациентов с СД 2 типа.
Заключение
Линаглиптин является иДПП-4 с доказанной эффективностью и высоким профилем безопасности. Препарат можно назначать широкому кругу пациентов с СД 2 типа. Сочетание хорошей переносимости, удобного режима приема и дозирования, низкого риска гипогликемий, нейтрального влияния на массу тела, отсутствие негативного воздействия на риск развития сердечно-сосудистых заболеваний и ограничений по применению при патологии печени и почек делают линаглиптин препаратом выбора.
Ye.V. Biryukova
Moscow State University of Medicine and Dentistry named after A.I. Evdokimov, Department of Endocrinology and Diabetology
Contact person: Yelena Valeryevna Biryukova, lena@obsudim.ru
Rapid increase of spread of type 2 diabetes mellitus represents one of the global problems for health care worldwide. Successful treatment of the disease may be expected only based on thorough understanding of its pathogenesis. Due to this, it is considered important to reach level of glycemia close to normal range. However, this task is complicated by development of renal and hepatic pathologies in some patients with type 2 diabetes mellitus resulting in restricted use of blood glucose lowering drugs. Moreover, effective treatment is hindered by the fact that majority of patients with type 2 diabetes mellitus are overweight and this situation deteriorates with age. Here, the most effective therapeutic approaches used in these cases are discussed.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.