Практика сахароснижающей терапии: выбор оптимального препарата из группы ингибиторов дипептидилпептидазы 4
- Аннотация
- Статья
- Ссылки
- English
В статье представлены результаты клинических исследований эффективности и безопасности иДПП-4. Особый акцент сделан на выборе оптимального препарата из группы иДПП-4.
Вывод на фармацевтический рынок нового российского препарата из группы иДПП-4 позволит обеспечить пациентов с сахарным диабетом 2 типа современным, эффективным и доступным лечением.
В статье представлены результаты клинических исследований эффективности и безопасности иДПП-4. Особый акцент сделан на выборе оптимального препарата из группы иДПП-4.
Вывод на фармацевтический рынок нового российского препарата из группы иДПП-4 позволит обеспечить пациентов с сахарным диабетом 2 типа современным, эффективным и доступным лечением.






Эпидемия сахарного диабета (СД) 2 типа – глобальная медико-социальная проблема. Именно поэтому на сегодняшний день так актуальны вопросы эффективного и доступного лечения данного заболевания [1].
Согласно результатам исследования NATION, количество больных СД в России составляет 5,4% населения [2].
Актуальность проблемы обусловлена не только эпидемическими темпами роста заболеваемости СД, но и его хроническими осложнениями, ведущими к инвалидизации, снижению качества жизни и преждевременной смерти [3–5].
Благодаря крупномасштабным клиническим исследованиям стало понятно, что основой улучшения прогноза и профилактики развития хронических осложнений является оптимальная сахароснижающая терапия с достижением целевых метаболических показателей начиная с дебюта СД 2 типа и сохранением их в течение всей жизни пациента [6–8].
За последние годы возможности эффективного лечения СД 2 типа существенно расширились, что обусловлено непрерывным развитием диабетологии, углублением представлений о патофизиологии заболевания, разработкой новых сахароснижающих препаратов.
Благодаря исследованиям, в том числе сердечно-сосудистой безопасности сахароснижающих препаратов, выстроилась четкая доказательная база о воздействии различных терапевтических стратегий на развитие и темпы прогрессирования осложнений СД 2 типа, на их исходы, что отражено в современных клинических рекомендациях [9–11].
Индивидуальный подход к каждому пациенту является приоритетным при выборе тактики лечения. Наличие сердечно-сосудистых факторов риска, макрососудистых заболеваний, хронической сердечной недостаточности (ХСН), хронической болезни почек (ХБП), ожирения, риска гипогликемий вносит свой вклад в схему терапии заболевания [10].
Лечение СД 2 типа начинается с изменения образа жизни и приема одного или нескольких сахароснижающих препаратов. Сложный патогенетический механизм развития СД 2 типа – веское основание для фармакотерапии, влияющей на различные нарушения. Это обеспечит лучший сахароснижающий потенциал и поддержание гликемического контроля по мере прогрессирования заболевания [10–12].
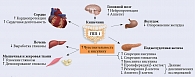
В настоящее время в распоряжении клиницистов достаточно широкий арсенал сахароснижающих препаратов с различной эффективностью и переносимостью (рис. 1).
Одна из перспективных опций – препараты с инкретиновой активностью [12–14].
Роль инкретиновой системы в гомеостазе глюкозы
Для метаболизма глюкозы особое значение имеет энтероинсулярная ось. Ее основными компонентами являются гормоны инкретинового ряда, такие как глюкагоноподобный пептид 1 (ГПП-1) и глюкозозависимый инсулинотропный полипептид (ГИП), которые синтезируются в энтероэндокринных клетках желудочно-кишечного тракта в ответ на поступление пищевых нутриентов [15, 16].
У лиц без нарушений углеводного обмена эффектом инкретинов обусловлено порядка 70% прандиальной секреции инсулина. Эти пептиды глюкозозависимым механизмом стимулируют секрецию инсулина и одновременно подавляют секрецию глюкагона, обеспечивая быструю инсулинопосредованную утилизацию глюкозы в постпрандиальный период. Инсулинотропные эффекты ГПП-1 и ГИП дополняют друг друга, что опосредуется сложными нейрогуморальными механизмами [15, 16]. Особый интерес представляет потенциальная способность ГПП-1 подавлять апоптоз, стимулировать неогенез и пролиферацию β-клеток поджелудочной железы. Это не исключает воздействия на снижение β-клеточной массы, которое характеризует прогрессирующее течение СД 2 типа и требует интенсификации сахароснижающей терапии [16, 17]. У ГИП также установлен антиапоптотический эффект в отношении β-клеток, что включает активацию CREB, транскрипционного фактора, способного связывать CRE-последовательности ДНК и регулировать экспрессию генов, и протеинкиназы B [18].
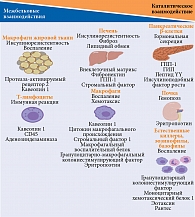
Инкретины, особенно ГПП-1 (рис. 2), воздействуют на многие патофизиологические нарушения, присущие СД 2 типа, такие как дисфункция β-клеток, гиперсекреция глюкагона, сниженный инкретиновый эффект, ускоренное опорожнение желудка, избыточная масса тела [14, 15].
Метаболизм ГПП-1 и ГИП отличает короткий период полужизни из-за быстрой деградации под воздействием дипептидилпептидазы 4 (ДПП-4), после чего они теряют способность стимулировать секрецию инсулина [12, 13].
Препараты с инкретиновой активностью
Агонисты рецепторов ГПП-1 (арГПП-1) не имеют пероральных форм и требуют обязательного подкожного введения. Подобного недостатка лишены ингибиторы ДПП-4 (иДПП-4), или глиптины.
Дипептидилпептидаза 4 является основной точкой приложения иДПП-4.
Ингибирование каталитической активности фермента замедляет деградацию эндогенных ГПП-1 и ГИП, за счет чего продлевается их биологическая активность. Так, период полужизни ГПП-1 увеличивается до 5 минут. В результате пролонгируется взаимодействие ГПП-1 и ГИП с собственными рецепторами. Соответственно усиливаются описанные выше эффекты, а главное, нормализуется и поддерживается постпрандиальная секреция инсулина, снижается выработка глюкозы печенью за счет снижения секреции глюкагона [13, 19, 20].
Дипептидилпептидаза 4 относится к семейству серин-пептидаз, которое также включает ДПП-8, ДПП-9 и ДПП-2, белок активации фибробластов α (FAP-α). Высокая селективность иДПП-4 в отношении ДПП-4 рассматривается с точки зрения безопасности и минимизации риска побочных эффектов лечения [19–21].
Молекула ДПП-4 существует в мембраносвязанной и растворимой формах, последняя циркулирует в плазме крови и образуется из мембраносвязанной формы. Сахароснижающий эффект иДПП-4 обусловлен воздействием на растворимую форму фермента. Мембраносвязанная форма ДПП-4 экспрессируется на поверхности многих клеток (эндотелия, почек, легких, дыхательных путей, Т-лимфоцитов, гладких мышц и др.). Поэтому воздействие на эту форму ДПП-4 обеспечивает плейотропные эффекты [22–24].
За последние годы представление о роли ДПП-4 существенно расширилось. Установлено, что к ее субстратам относятся и другие регуляторные пептиды, цитокины, хемокины, в частности мозговой натрий-уретический пептид (BNP), нейропептид Y (NPY), стромальный клеточный фактор 1α (SDF-1α), вовлеченные во многие физиологические процессы в организме (рис. 3) [20, 22, 23]. На сегодняшний день ДПП-4 рассматривается в качестве адипокина, локального маркера метавоспаления и инсулинорезистентности, который может быть одним из связующих звеньев между накоплением массы жировой ткани и ассоциированных с ожирением заболеваний. Ингибирование ДПП может предотвращать воспаление жировой ткани [25].
Ингибиторы ДПП-4 воздействуют на неадекватную секрецию инсулина β-клетками поджелудочной железы, при этом данный механизм зависит от уровня глюкозы, что обеспечивает высокую степень безопасности в отношении гипогликемий [19, 20, 23].
Действие иДПП-4 направлено и в отношении α-клеток. Дефект α-клеток устраняется за счет уменьшения гиперглюкагонемии, что опосредовано повышением секреции инсулина и соматостатина. Однако не исключается и прямое воздействие ГПП-1 через собственные рецепторы [26, 27]. Описанный эффект также является глюкозозависимым [28].
Среди преимуществ иДПП-4 указывается потенциальный протективный эффект в отношении β-клеток поджелудочной железы, что важно для сохранения их инсулиносекреторного потенциала и длительного контроля гликемии [20, 23, 29].
Широко обсуждается возможность воздействия глиптинов на негликемические механизмы развития осложнений СД, то есть их кардиопротективные, нейропротективные и противовоспалительные свойства [20, 23]. В частности, в эксперименте обнаружено, что повышение концентрации SDF-1α, который участвует в регенерации сосудов, неоангиогенезе, способствует привлечению клеток-предшественниц и стволовых клеток к очагам повреждения миокарда, сосудов и последующей регенерации [23, 24]. Подобное влияние со временем может реализоваться в различных метаболических эффектах, в целом улучшающих прогноз СД 2 типа [20, 23, 30].
Клинические возможности и место ингибиторов дипептидилпептидазы 4 в современных рекомендациях
В российских алгоритмах специализированной медицинской помощи допускается использование иДПП-4 на всех этапах лечения СД 2 типа как в виде монотерапии (при наличии непереносимости или противопоказаний для применения метформина), так и в составе комбинированной терапии (в том числе с инсулином) в зависимости от уровня гликированного гемоглобина (HbA1c) [10]. Кроме того, при выборе оптимальной индивидуальной схемы сахароснижающей терапии необходимо ориентироваться на доминирующую клиническую проблему пациента (указание на высокий риск атеросклеротических сердечно-сосудистых заболеваний (АССЗ), наличие АССЗ, ХСН, ХБП, ожирения, риска гипогликемий), наличие противопоказаний для назначения тех или иных сахароснижающих препаратов.
Ингибиторы ДПП-4 отличают удобство применения – перорально независимо от приема пищи, умеренная эффективность – снижение уровня HbA1c на 0,5–1,0% и хорошая переносимость, сопоставимая с переносимостью плацебо, в том числе у пациентов с нарушенной функцией почек и находящихся на гемодиализе [20, 26, 31]. Преимуществом этой группы препаратов является нейтральный эффект в отношении массы тела, поскольку ее контроль при СД 2 типа – второй по важности параметр после HbA1с.
Профиль безопасности глиптинов сопоставим с таковым плацебо [32]. Так, применение иДПП-4 не сопровождается развитием нежелательных явлений, обычно ассоциирующихся с другими сахароснижающими препаратами, а именно: увеличение массы тела (тиазолидиндионы (ТЗД), производные сульфонилмочевины (ПСМ), меглитиниды, инсулин), развитие гипогликемии (ПСМ, меглитиниды, инсулин), воздействие на желудочно-кишечный тракт (метформин, арГПП-1), развитие урогенитальных инфекций (ингибиторы натрий-глюкозного котранспортера 2 (иНГЛТ-2)) [26, 31].
В России зарегистрировано несколько иДПП-4: алоглиптин, вилдаглиптин, гемиглиптин, гозоглиптин, линаглиптин, саксаглиптин, ситаглиптин, эвоглиптин [10, 33–40]. Поэтому перед врачами нередко встает вопрос выбора оптимального препарата внутри группы с целью обеспечения пациентов с СД 2 современным, эффективным и доступным лечением.
Несмотря на единый механизм действия и большое количество класс-специфических эффектов, иДПП-4 различаются по химико-фармакологическим свойствам, что оказывает непосредственное влияние на особенности их применения (табл. 1) [26, 31, 32]. Для достижения наилучшего эффекта терапии необходимо сопоставлять преимущества и недостатки не всей группы иДПП-4, а отдельно взятого ее представителя в конкретной клинической ситуации.
Основными характеристиками иДПП-4 можно считать биодоступность, селективность в отношении ДПП-4, период полувыведения, особенности метаболизма, экскреции, ограничения по применению у пациентов с нарушением функции почек и печени, потенциал лекарственных взаимодействий (табл. 2).
Большинство иДПП-4 обладают высокой биодоступностью при приеме внутрь независимо от приема пищи. Наибольшей биодоступностью характеризуются алоглиптин, гозоглиптин и ситаглиптин [26, 32–39].
Алоглиптин и ситаглиптин практически не подвергаются метаболизму [33, 39], а линаглиптин вообще не метаболизируется в организме. Поэтому данные препараты преимущественно выводятся в неизмененном виде [37]. Около половины гемиглиптина подвергается метаболизму в печени, в основном с участием цитохрома P450 3A4/5 (CYP3A4/5) [35, 41]. Остальные иДПП-4 подвергаются более интенсивному метаболизму в печени [42, 43]. Гозоглиптин и эвоглиптин метаболизируются в печени с участием CYP3A4 и образованием неактивных метаболитов [36, 40]. Метаболизм саксаглиптина в основном опосредован CYP3A4/5, что требует внимания при одновременном приеме с ингибиторами CYP3A4 (итраконазолом, кетоконазолом, циметидином, кларитромицином, ингибиторами ВИЧ-протеазы). Во избежание развития нежелательных эффектов дозу саксаглиптина следует ограничить до 2,5 мг/сут [38, 42].
Ингибиторы ДПП-4 существенно различаются по периоду полувыведения, который важен для поддержания эффекта в течение суток. С учетом периода полувыведения алоглиптин, гемиглиптин, гозоглиптин, линаглиптин, ситаглиптин и эвоглиптин рекомендовано принимать один раз в день. Существенно меньший период полувыведения у саксаглиптина и вилдаглиптина, которые связываются с ДПП-4 прочной ковалентной связью, что обеспечивает продолжительное ингибирование ДПП-4, выходящее за ожидаемый интервал времени [42]. Для поддержания стабильного эффекта саксаглиптин можно принимать один раз в день, вилдаглиптин необходимо принимать два раза в день [37, 38].
Преимущественный путь выведения линаглиптина – через желудочно-кишечный тракт (экскретируется с желчью). Приблизительно 5% препарата выводится почками [36]. Эвоглиптин выводится почками и печенью практически в равном соотношении – 46,1 и 42,8% соответственно [39]. Другие рассматриваемые иДПП-4 преимущественно выводятся почками посредством фильтрации и канальцевой секреции [22, 44]. В частности, приблизительно 87% ситаглиптина выводится с мочой, 79% – в виде активного препарата.
Большинство иДПП-4 являются высокоселективными в отношении ДПП-4 (алоглиптин, ситаглиптин, гемиглиптин, гозоглиптин и эвоглиптин). К умеренно селективным (селективность в отношении ДПП-4 и одной из гомологичных дипептидаз менее 100) относятся вилдаглиптин, линаглиптин и саксаглиптин [21–23]. Несмотря на различие в селективности иДПП-4 in vitro, до настоящего времени не получено данных о возникновении у пациентов нежелательных эффектов, связанных с неселективным ингибированием дипептидаз [43, 44].
Применение при нарушении функции почек, печени, в пожилом возрасте
Ингибиторы ДПП-4 можно назначать лицам со сниженной расчетной скоростью клубочковой фильтрации (рСКФ), включая находящихся на диализе, с сокращением дозы в зависимости от стадии ХБП (табл. 3) [10, 40, 43], что отражено в инструкции по применению соответствующего препарата [33–40]. Необходимо отметить, что доза линаглиптина не снижается, так как препарат экскретируется преимущественно с желчью.
Пациентам с тяжелым нарушением функции почек, включая лиц с хронической почечной недостаточностью, находящихся на гемодиализе, в связи с ограниченным опытом применения алоглиптин и гозоглиптин не рекомендуются [33, 36].
Большинство иДПП-4, за исключением алоглиптина, вилдаглиптина и гозоглиптина, могут назначаться при нарушении функции печени разной степени тяжести без дополнительных ограничений и мониторинга печеночной функции. Алоглиптин и гозоглиптин противопоказаны при тяжелом нарушении функции печени [33, 36].
При лечении лиц с СД 2 типа пожилого возраста перед клиницистами встает вопрос выбора не только эффективного, но и наиболее безопасного в отношении риска развития гипогликемий препарата. Ингибиторы ДПП-4 могут применяться в данной популяции, так как ассоциируются с низким риском гипогликемий [10, 33, 36].
Эффективность и безопасность
Эффективность и безопасность иДПП-4 как в монотерапии, так и в комбинации с другими сахароснижающими препаратами доказаны в рандомизированных контролируемых клинических исследованиях, метаанализах и подтверждены в условиях реальной клинической практики [21, 44–49]. Согласно данным A. Maloney и соавт., проанализировавших 229 рандомизированных клинических исследований с участием 121 914 пациентов, монотерапия иДПП-4 обеспечивала снижение уровня HbA1с в пределах 0,5–1,0% при низком риске гипогликемий, уступая по сахароснижающему эффекту метформину, ТЗД, иНГЛТ-2 и арГПП-1 [47]. При применении иДПП-4 по сравнению с использованием ПСМ снижение уровня HbA1c в краткосрочных исследованиях было менее выраженным, хотя в исследованиях продолжительностью 52 недель и более сахароснижающий эффект этих препаратов был схожим [21, 44, 50].
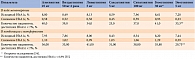
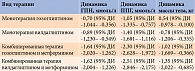
В крупном метаанализе сравнительной эффективности таких иДПП-4, как алоглиптин, линаглиптин, саксаглиптин, ситаглиптин и вилдаглиптин, P. Craddy и соавт. было продемонстрировано сопоставимое снижение уровня HbA1c (монотерапия – на 0,45–0,59%, комбинация с метформином – на 1,02–1,10%) при аналогичном риске развития гипогликемий (табл. 4) [45, 51, 52]. Однако необходимо с осторожностью интерпретировать результаты сравнения приведенных исследований в связи с различиями в их дизайне, выборках и методологии.
Сочетание различных иДПП-4 с метформином по эффективности оказалось сопоставимым.
В целом показаны эквивалентные эффекты иДПП-4 по ключевым показателям эффективности и безопасности (среднее изменение HbA1c по сравнению с исходным уровнем, доля пациентов, достигших уровня HbA1c < 7%, среднее изменение массы тела по сравнению с исходным уровнем и число пациентов с гипогликемиями):
- между алоглиптином, линаглиптином, саксаглиптином, ситаглиптином, вилдаглиптином, применяемыми в качестве монотерапии или двойной терапии (комбинация с метформином или ПСМ);
- алоглиптином, линаглиптином, ситаглиптином и вилдаглиптином в качестве двойной терапии (комбинация с пиоглитазоном);
- ситаглиптином и вилдаглиптином в качестве двойной терапии (комбинация с инсулином) / линаглиптином, ситаглиптином и вилдаглиптином в качестве тройной терапии (комбинация с метформином или ПСМ);
- гозоглиптином и вилдаглиптином, применяемыми в виде монотерапии или в комбинации с метформином.
С целью уменьшения риска развития гипогликемий при одновременном применении иДПП-4 с препаратами, потенциально увеличивающими риск гипогликемий, рекомендуется снижение дозы ПСМ и инсулина.
В ходе долгосрочных клинических исследований, в том числе в отношении сердечно-сосудистой безопасности, а также в клинической практике не выявлено серьезных нежелательных явлений и непредвиденных рисков применения иДПП-4 [9, 10, 45–48].
В настоящее время завершены многоцентровые международные исследования по оценке сердечно-сосудистых эффектов иДПП-4 (CARMELINA, CAROLINA, EXAMINE, SAVOR-TIMI, TECOS), которые в целом доказали сердечно-сосудистую безопасность линаглиптина, алоглиптина, саксаглиптина и ситаглиптина. Однако на фоне применения саксаглиптина отмечался более высокий риск госпитализаций по поводу сердечной недостаточности [9, 48]. Данные в отношении сердечно-сосудистой безопасности вилдаглиптина доступны благодаря проведению ретроспективного анализа результатов ряда исследований [48].
Гозоглиптин
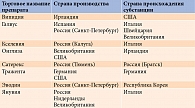
Ингибиторы ДПП-4 являются активно развивающимся классом сахароснижающих препаратов. В 2016 г. российская компания «Сатерекс» зарегистрировала гозоглиптин (Сатерекс®), включенный в перечень жизненно необходимых и важнейших лекарственных препаратов. Благодаря эффективным современным технологиям полный цикл производства гозоглиптина организован в России, включая производство необходимой субстанции, что является значимым для инновационного развития российской фармакологии в области диабетологии (табл. 5) [53, 54]. К преимуществам гозоглиптина также следует отнести доступность лечения СД 2 типа [54].
Гозоглиптин – высокоселективный нековалентный иДПП-4, по химической структуре – дифторпирролидин.
Избирательность гозоглиптина в отношении ДПП-4 превосходит его действие в отношении других родственных ферментов, включая ДПП-2, ДПП-8 и ДПП-9 (см. табл. 2) [55].
Данный препарат выводится из организма преимущественно почками. Так, после приема около 77% дозы экскретируется почками, причем 48,5% – в неизмененном виде, 10,5% – через кишечник, при этом значительная доля приходится на метаболиты гозоглиптина [36, 55].
Гозоглиптин отличает длительный период полувыведения (около 20 часов), что обеспечивает стойкое ингибирование ДПП-4 при приеме один раз в сутки.
В исследованиях in vitro с использованием микросомальных ферментов печени человека отмечались низкие константы связывания и ингибирования гозоглиптином CYP1A2, CYP2C9, CYP2C19, CYP2D6 и CYP3A4. Гозоглиптин обладает низким потенциалом лекарственного взаимодействия. Поскольку гозоглиптин не является субстратом микросомальных ферментов печени, а также не ингибирует и не индуцирует эти ферменты, взаимодействие его с лекарственными средствами, которые являются субстратами, ингибиторами или индукторами микросомальных печеночных ферментов, маловероятно [36, 53].
Эффективность и безопасность гозоглиптина были подтверждены результатами клинических исследований, проведенных в России. Установлены хорошая эффективность, переносимость и безопасность препарата. Примечательно, что по эффективности и безопасности гозоглиптин сравним с зарегистрированными ранее на территории РФ зарубежными препаратами из группы иДПП-4.
Для клинической практики особый интерес могут представлять результаты многоцентрового (27 российских клинических центров) открытого рандомизированного сравнительного исследования, посвященного оценке эффективности и безопасности гозоглиптина и вилдаглиптина в качестве монотерапии и в комбинации с метформином у пациентов с СД 2 типа, ранее не получавших лекарственной терапии [51]. Необходимо отметить, что вилдаглиптин является наиболее изученным и широко применяемым иДПП-4.
Продолжительность клинического исследования составила 36 недель.
Из 299 пациентов с впервые выявленным СД 2 типа, включенных в исследование, 149 были рандомизированы в группу гозоглиптина, 150 – в группу вилдаглиптина.
Исследование предусматривало два этапа – монотерапия иДПП-4 и их комбинация с метформином.
Через 12 недель монотерапии уровень НbА1с достоверно снизился на 0,93% в группе гозоглиптина и на 1,03% в группе вилдаглиптина. После назначения комбинированной терапии снижение уровня НbА1с продолжилось и составило -1,29% в группе гозоглиптина и метформина и -1,35% в группе вилдаглиптина и метформина по сравнению с исходными значениями (рис. 4). Разница в снижении НbА1с между группами на обоих этапах составила ≤ 0,1% (верхняя граница доверительного интервала (ДИ) < 0,4%), что позволило сделать вывод о сопоставимой эффективности гозоглиптина и вилдаглиптина в моно- и комбинированной терапии. Целевого уровня НbА1с ≤ 7% по окончании 36-недельного периода достигли 56,4% пациентов в группе гозоглиптина и 55,4% в группе вилдаглиптина (статистически значимые различия между терапевтическими группами не обнаружены, p = 0,74).
Таким образом, вилдаглиптин и гозоглиптин продемонстрировали значимое снижение HbA1c. По эффективности они оказались эквивалентными.
Кроме того, отмечено сопоставимое снижение глюкозы плазмы натощак (ГПН), постпрандиальной гликемии (ППГ) на этапе монотерапии. По выраженности эффекта в отношении ГПН, ППГ комбинация гозолиптина и метформина не уступала комбинации вилдаглиптина и метформина (табл. 6).
Помимо достижения гликемического контроля лечение должно быть направлено на предупреждение прогрессирования СД 2 типа за счет коррекции других нарушений, в частности избыточного веса. В группах гозоглиптина и вилдаглиптина наблюдалось сопоставимое снижение массы тела на всех этапах исследования (см. табл. 6).
В обеих группах фармакотерапии отмечена низкая частота возникновения гипогликемий. Случаев тяжелой гипогликемии не наблюдалось.
Гозоглиптин и вилдаглиптин характеризовались сопоставимыми профилями безопасности и переносимости.
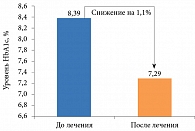
В наблюдательном российском исследовании ОНИКС препарат Сатерекс® назначали пациентам с СД 2 типа, не достигшим целевых показателей на фоне терапии метформином [49]. К шестому месяцу в целом улучшился гликемический контроль: ГПН снизилась на 1,63 ммоль/л, ППГ – на 2,68 ммоль/л, HbA1c – на 1,1% (рис. 5).
Результаты российского исследования ОНИКС подтвердили высокую эффективность гозоглиптина у пациентов с СД 2 типа, ранее получавших монотерапию метформином (рис. 6).
Преимуществами гозоглиптина являются удобство применения, сахароснижающая эффективность, нейтральное влияние на массу тела, низкая частота гипогликемий, хороший профиль безопасности и переносимости и невысокая стоимость по сравнению с другими иДПП-4.
Гозоглиптин можно применять при ХБП С1–3а. Однако он не рекомендуется пациентам с выраженным нарушением функции печени (аланинаминотрансфераза или аспартатаминотрансфераза выше верхней границы нормы более чем в 2,5 раза) в связи с ограниченным опытом применения в данной популяции.
В отсутствие данных о безопасности применение гозоглиптина во время беременности противопоказано.
У пожилых пациентов не требуется коррекции дозы гозоглиптина [36].
Заключение
Диабетология – постоянно развивающаяся область медицины, что дает возможность решить главные задачи лечения СД 2 типа – достижение и поддержание безопасного долгосрочного гликемического контроля, снижение риска прогрессирования осложнений.
Ингибиторы ДПП-4 – относительно новая группа сахароснижающих препаратов, на которую возлагаются определенные надежды.
Гозоглиптин является высокоэффективным и безопасным иДПП-4, что подтверждают результаты клинических исследований и данные клинической практики. Более широкое использование гозоглиптина на разных этапах терапии СД 2 типа позволит снизить затраты на лечение заболевания и его осложнений.
Ye.V. Biryukova, MD, PhD, Prof., M.V. Shinkin
A.S. Loginov Moscow Clinical Scientific and Practical Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Yelena V. Biryukova, lena@obsudim.ru
Effective treatment of type 2 diabetes mellitus is an important task of modern medicine. Recently, the possibilities of hypoglycemic therapy have significantly expanded, due to the continuous development of diabetology, the deepening of ideas about the pathophysiology of the disease. In particular, the importance of the incretin system in glucose homeostasis and incretin-directed therapy is discussed. Drugs with incretin activity include dipeptidyl peptidase 4 inhibitors (iDPP-4). Several DPP-4 inhibitors have been registered in the Russian Federation: alogliptin, vildagliptin, hemigliptin, gozogliptin, linagliptin, saxagliptin, sitagliptin, evogliptin.
The article presents the results of clinical studies of the efficacy and safety of iDPP-4. Special emphasis is placed on choosing the optimal drug from the iDPP-4 group.
The introduction of a new Russian drug from the iDPP-4 group to the pharmaceutical market will provide patients with type 2 diabetes with modern, effective and affordable treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.