Дулаглутид: клинические преимущества и вклад в терапию сахарного диабета 2 типа
- Аннотация
- Статья
- Ссылки
- English
Известно, что у пациентов с СД 2 типа высок риск развития сердечно-сосудистых заболеваний. Для предупреждения атеросклеротических сосудистых осложнений должен осуществляться контроль не только гликемии, но и других факторов риска. В частности, при СД 2 типа снижен эффект эндогенных инкретинов. Установлено, что глюкагоноподобный пептид 1 (ГПП-1) – один из сильнейших стимуляторов секреции инсулина. Кроме того, он обладает защитными и модулирующими сердечно-сосудистыми эффектами.
Дулаглутид является агонистом рецепторов ГПП-1, сахароснижающее действие которого реализуется через инкретиновую систему. Препараты данной группы влияют на многие патогенетические механизмы СД 2 типа и обладают высоким профилем безопасности. Очевидным преимуществом дулаглутида является удобство применения – один раз в неделю.
Эффективность и безопасность дулаглутида как в виде монотерапии, так и в комбинации с другими сахароснижающими препаратами на разных этапах терапии подтверждены в серии рандомизированных клинических исследований фазы III AWARD. В этих исследованиях приняло участие в общей сложности 6000 пациентов с СД 2 типа.
Доказательная база в отношении эффективности и безопасности дулаглутида постоянно расширяется. Особый интерес могут представлять результаты исследования REWIND в отношении сердечно-сосудистой безопасности препарата.
Известно, что у пациентов с СД 2 типа высок риск развития сердечно-сосудистых заболеваний. Для предупреждения атеросклеротических сосудистых осложнений должен осуществляться контроль не только гликемии, но и других факторов риска. В частности, при СД 2 типа снижен эффект эндогенных инкретинов. Установлено, что глюкагоноподобный пептид 1 (ГПП-1) – один из сильнейших стимуляторов секреции инсулина. Кроме того, он обладает защитными и модулирующими сердечно-сосудистыми эффектами.
Дулаглутид является агонистом рецепторов ГПП-1, сахароснижающее действие которого реализуется через инкретиновую систему. Препараты данной группы влияют на многие патогенетические механизмы СД 2 типа и обладают высоким профилем безопасности. Очевидным преимуществом дулаглутида является удобство применения – один раз в неделю.
Эффективность и безопасность дулаглутида как в виде монотерапии, так и в комбинации с другими сахароснижающими препаратами на разных этапах терапии подтверждены в серии рандомизированных клинических исследований фазы III AWARD. В этих исследованиях приняло участие в общей сложности 6000 пациентов с СД 2 типа.
Доказательная база в отношении эффективности и безопасности дулаглутида постоянно расширяется. Особый интерес могут представлять результаты исследования REWIND в отношении сердечно-сосудистой безопасности препарата.


Распространенность сахарного диабета (СД) неуклонно возрастает, заметно опережая распространенность других неинфекционных заболеваний [1]. Согласно данным Международной федерации диабета, в 2019 г. в мире насчитывалось 463 млн пациентов с СД, при этом большая доля случаев приходилась на СД 2 типа [2]. Кроме того, отмечено существенное увеличение заболеваемости лиц среднего трудоспособного возраста.
Самыми опасными последствиями глобальной эпидемии СД 2 типа, приводящими к ранней инвалидизации и преждевременной смерти, в том числе в трудоспособном возрасте, являются системные сосудистые осложнения. Важно напомнить, что у пациентов с СД 2 типа без сердечно-сосудистых заболеваний (ССЗ) риск развития серьезных сердечно-сосудистых событий и смерти такой же, как у лиц без СД, но с установленными атеросклеротическими сердечно-сосудистыми заболеваниями (АССЗ) [1, 3].
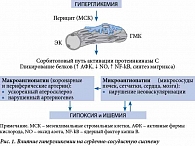
Значимым повреждающим фактором в отношении сердечно-сосудистой системы признана хроническая гипергликемия, которая запускает каскад патологических изменений (рис. 1) [4]. Достижение гликемического контроля предотвращает или значительно снижает риск развития и прогрессирования сосудистых осложнений [5]. Вместе с тем СД 2 типа ассоциируется с такими сопутствующими метаболическими нарушениями, как ожирение, атерогенная дислипидемия, артериальная гипертензия, неалкогольная жировая болезнь печени, каждое из которых представляет самостоятельный фактор высокого риска ухудшения сердечно-сосудистого прогноза [6, 7]. Именно поэтому для предупреждения развития атеросклеротических сосудистых осложнений у больных СД 2 типа должен осуществляться контроль не только гликемии, но и других факторов.
Вопреки ранее распространенному мнению, АССЗ не наносят «внезапный удар». На возможность их развития указывает наличие факторов риска. Они же позволяют отследить прогрессирование патологии, если она уже имеется [8].
В соответствии с обновленными рекомендациями Европейского кардиологического общества и Европейского общества по изучению сахарного диабета (2019 г.) все больные СД даже в отсутствие дополнительных факторов риска относятся к категории высокого и очень высокого сердечно-сосудистого риска, что определяет необходимость проведения агрессивных превентивных мер [9].
Столь бурный рост численности пациентов с СД 2 отчасти связан с высокой распространенностью в современной популяции ожирения. Избыточная масса тела у лиц с СД 2 типа способствует прогрессированию нарушений углеводного обмена и ухудшению прогноза, поэтому коррекция избыточной массы тела/ожирения должна быть составной частью лечения [10, 11]. Липотоксичность усугубляет метаболические нарушения, генерирует системную воспалительную реакцию, ухудшает чувствительность тканей к инсулину, способствует апоптозу бета-клеток, сосудистым нарушениям, включая эндотелиальную дисфункцию [12–14]. Снижение массы тела, напротив, улучшает чувствительность к инсулину клеток печени и скелетных мышц, а также способствует уменьшению накопления жира в поджелудочной железе [15].
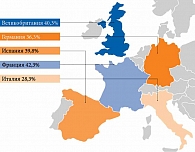
Свой вклад в увеличение числа различных сосудистых осложнений и смертности вносят неудовлетворительный контроль гликемии, неадекватный и неэффективный режим лечения. Так, серьезную проблему фармакотерапии представляют гипогликемические состояния, страх развития которых служит дополнительным препятствием в достижении метаболического контроля. Следует признать, что многие пациенты с СД не достигают целевого уровня гликированного гемоглобина (HbA1c). Согласно результатам исследования PANORAMA (кросс-секционный анализ данных о гликемическом контроле 5817 пациентов с СД 2 типа), в Европе большая доля больных СД 2 типа имеет уровень HbA1c ≥ 7% (рис. 2) [16]. Одной из причин этого является низкая приверженность лечению. Однако диабетология как наука непрерывно развивается. За последние годы значительно изменилось представление о патофизиологии СД, накоплена большая доказательная база о влиянии разных терапевтических стратегий на развитие осложнений и исходы. Благодаря этому существенно расширились возможности лечения патологии и профилактики развития ее осложнений [17–19].
Следует также принимать во внимание прогрессирующий характер течения СД 2 типа. Со временем добиться клинического эффекта становится все труднее из-за снижения количества активно функционирующих бета-клеток. Необходимо отметить, что традиционные пероральные сахароснижающие препараты не могут остановить нарастающую потерю массы бета-клеток и восстановить их функцию, а инновационные – назначаются с опозданием, после того как масса или функция бета-клеток значительно снизилась [19, 20].
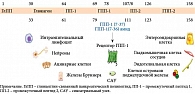
Высокого сахароснижающего потенциала и поддержания эффективного контроля гликемии по мере прогрессирования заболевания можно добиться только при одновременном воздействии на разные патогенетические механизмы СД 2 типа (рис. 3) [21]. Помимо нормализации гликемии терапия должна способствовать коррекции ожирения, дислипидемии, артериальной гипертензии, что в совокупности позволит снизить риск поражения сердечно-сосудистой системы.
Физиологические эффекты ГПП-1 – основа действия агонистов рецепторов ГПП-1
К настоящему времени четко сформулирована концепция снижения эффекта инкретинов при СД 2 типа.
Инкретины – глюкагоноподобный пептид 1 (ГПП-1), глюкозависимый инсулинотропный полипептид (ГИП) – ответственны за 50–70% постпрандиальной секреции инсулина [22]. Среди пептидов, которые вырабатываются в желудочно-кишечном тракте, наибольшее значение придается ГПП-1, который глюкозозависимым образом стимулирует секрецию инсулина и подавляет секрецию глюкагона в ответ на прием пищи. У здоровых лиц ГПП-1 является одним из сильнейших стимуляторов секреции инсулина. После пероральной нагрузки глюкозой его концентрация в плазме крови повышается в два-три раза, достигая максимума через 40–90 минут, затем медленно снижается к исходным значениям через 150 минут [23]. Нативный ГПП-1 имеет очень короткий период полувыведения (менее 2 минут) ввиду деградации под воздействием дипептидилпептидазы 4 (ДПП-4) [22].
ГПП-1 оказывает как краткосрочные, так и долгосрочные плейотропные эффекты на органы-мишени путем взаимодействия с рецепторами, связанными с G-белком (рис. 4) [18, 23, 24]. В частности, он участвует во многих важных физиологических процессах в поджелудочной железе и других органах и системах, в которых представлены инкретиновые рецепторы. Речь идет о сердечно-сосудистой системе, легких, желудочно-кишечном тракте, костной ткани, эндотелиальных клетках (ЭК), гладкомышечных клетках (ГМК), макрофагах и моноцитах, нейронах и глиальных клетках и др.
Считается, что ГПП-1 активирует накопление запасов инсулина в бета-клетках, стимулируя биосинтез инсулина, что обусловлено активацией транскрипции гена проинсулина и инсулина с последующим повышением биосинтеза и стабильности мРНК. Он также стимулирует пролиферацию и подавляет апоптоз бета-клеток [22, 24]. ГПП-1 является мощным ингибитором секреции глюкагона. Эффекты ГПП-1 на функцию альфа-клеток поджелудочной железы опосредованны. Это достигается за счет увеличения секреции инсулина и соматостатина, что может подавлять секрецию глюкагона путем паракринных взаимодействий. В то же время не исключается прямое воздействие ГПП-1, через собственные рецепторы, на секреторную функцию aльфа-клеток [25]. Снижение концентрации глюкагона на фоне повышения уровня инсулина способствует уменьшению продукции глюкозы печенью, что и приводит к снижению гликемии [25, 26].
ГПП-1 контролирует скорость опорожнения желудка. Он связывается со специфическими рецепторами в головном мозге и таким образом стимулирует парасимпатические нервы. Замедление опорожнения желудка под его воздействием считается перспективным в плане снижения экскурсии глюкозы в постпрандиальный период [22, 23].
Кроме того, ГПП-1 является одним из немногочисленных анорексигенных гормонов, действие которого аналогично действию aльфа-меланоцитостимулирующего гормона, пептида YY3-36 и антагониста таких орексигенных гормонов, как грелин, нейропептид Y. Проникая через гематоэнцефалический барьер и воздействуя на гипоталамические ядра, ГПП-1 способствует быстрому наступлению чувства насыщения, уменьшению количества потребляемой пищи и, как следствие, снижению массы тела [18, 22, 24].
ГПП-1 обладает защитными и модулирующими сердечно-сосудистыми эффектами, часть которых опосредуется влиянием на сосудистую стенку, что имеет огромное значение для улучшения прогноза у пациентов с СД 2 типа, получающих инкретиннаправленную терапию (табл. 1). В частности, в экспериментальных работах показано, что при нокауте гена рецептора ГПП-1 у мышей снижалась сократимость левого желудочка. Введение ГПП-1 ограничивало зону инфаркта миокарда. Отмечены также вазодилатирующий эффект ГПП-1, его способность ингибировать стимулированный конечными продуктами гликирования апоптоз эндотелиоцитов, уменьшать количество молекул сосудистой адгезии [27–29].
Как было указано ранее, у больных СД 2 типа эффективность эндогенных инкретинов снижается, что может быть обусловлено нарушением секреции ГПП-1, ускоренным метаболизмом ГПП-1 и ГИП или нечувствительностью рецепторов клеток к инкретинам. Наиболее значимо при СД 2 типа нарушается секреция ГПП-1 [30–33].
В настоящее время синтезировано несколько молекул – аналогов нативного ГПП-1 (эксенатид, лираглутид, ликсисенатид, дулаглутид, албиглутид, семаглутид).
В целом агонисты рецепторов ГПП-1 представляют собой класс сахароснижающих препаратов, воздействующих на многие патогенетические механизмы СД 2 типа и обладающих высоким профилем безопасности [23, 34, 35].
К преимуществам препаратов данного класса помимо высокой сахароснижающей активности следует отнести низкий риск развития гипогликемических состояний, снижение массы тела, артериального давления, а также потенциальный протективный эффект в отношении бета-клеток. В российских алгоритмах оказания медицинской помощи больным СД допускается использование агонистов рецепторов ГПП-1 на всех этапах лечения как в виде монотерапии, так и в виде комбинированной терапии, включая комбинацию с инсулином (в зависимости от исходного уровня HbA1c) [35].
Несмотря на высокую клиническую эффективность агонистов рецепторов ГПП-1, в реальной практике существуют проблемы, связанные с их использованием. Речь, в частности, идет об инъекционном введении. Необходимость ежедневных инъекций снижает приверженность пациентов терапии, обусловливает пропуск инъекций, как следствие, ухудшаются результаты лечения [36]. Важным шагом в повышении приверженности терапии стало создание пролонгированных форм агонистов рецепторов ГПП-1.
Дулаглутид: фармакокинетические и фармакодинамические свойства
В России дулаглутид (Трулисити) является первым зарегистрированным агонистом рецепторов ГПП-1 для лечения пациентов с СД 2 типа (2016 г.). Препарат применяется один раз в неделю независимо от приема пищи.
Молекула дулаглутида состоит из двух идентичных цепей [37], связанных дисульфидными связями. Каждая из цепей включает аналог человеческого ГПП-1, который практически на 90% гомологичен человеческому ГПП-1. Аналог ГПП-1 с помощью небольшой полипептидной цепи (аминокислотный линкер) ковалентно связан с фрагментом тяжелой цепи (Fc) модифицированного человеческого иммуноглобулина G4 (IgG4) [38]. Особенности строения молекулы обеспечивают стабильность дулаглутида в растворенной форме. Период полувыведения составляет 4,7 дня, благодаря чему препарат можно вводить подкожно один раз в неделю [39]. Пролонгированное действие дулаглутида также обусловлено особенностями молекулярной структуры. В результате замены аланина на глицин в восьмой позиции достигнута устойчивость к воздействию ДПП-4. За счет ковалентного соединения двух молекул аналога ГПП-1 с тяжелой цепью человеческого Fc-IgG4 молекула дулаглутида имеет больший размер, что замедляет абсорбцию и снижает почечный клиренс [38]. Улучшение связывания дулаглутида с рецепторами было достигнуто оптимизированным аминокислотным линкером, что повысило активность препарата. Улучшение растворимости обеспечено за счет замены в 22-й позиции глицина на глутаминовую кислоту, а также за счет соединения с Fc-фрагментом IgG4. Молекула дулаглутида обладает низкой иммуногенностью, что достигнуто с помощью аминокислотных замещений и модификации Fc-области IgG4 [37].
Равновесная концентрация в плазме наблюдается после двух – четырех недель введения дулаглутида в дозе 1,5 мг/нед. Концентрации дулаглутида после однократного подкожного введения в дозе 1,5 мг в область живота, бедра или плеча сопоставимы [39].
Исследование фармакодинамики дулаглутида показало, что у пациентов с СД 2 типа восстанавливалась первая фаза секреции инсулина и улучшалась вторая фаза секреции инсулина в ответ на внутривенное болюсное введение глюкозы [40].
Дозы и способ применения
В России доступны две дозы Трулисити. Доза 0,75 мг/нед рекомендована для монотерапии. В составе комбинированной терапии независимо от возраста пациентов с СД 2 типа Трулисити применяют в дозе 1,5 мг/нед [39].
Ранее было отмечено, что значимой проблемой на пути к улучшению результатов лечения СД 2 типа является недостаточная приверженность. На эту ключевую составляющую эффективного лечения влияет большое количество факторов, а именно: сложность схемы применения препаратов, кратность приема, способ введения. Очевидным преимуществом дулаглутида является уменьшение кратности применения – один раз в неделю в виде подкожной инъекции, что, несомненно, проще, чем ежедневные процедуры. Кроме того, дулаглутид выпускается в готовой к применению шприц-ручке. Она проста в использовании, имеет предварительно прикрепленную и скрытую от глаз пациента иглу. При ее использовании не требуется проводить дополнительные манипуляции с иглой и ресуспензировать препарат. Болезненность при инъекции минимальная. Шприц-ручка оснащена сигнальной системой для подтверждения введения дозы препарата.
Согласно результатам исследования, проведенного G. Matfin и соавт., 99% пациентов с СД 2 типа, которые впервые получали инъекционные препараты, имели высокую приверженность лечению при применении данной шприц-ручки. Более 96% больных отметили, что устройство для введения дулаглутида было простым в использовании [41]. В исследовании предпочтений большее число пациентов выбрали дулаглутид, а не лираглутид [42].
Клиническая эффективность и безопасность
Доказательная база эффективности и безопасности дулаглутида собрана в серии рандомизированных клинических исследований фазы III AWARD. В них препарат оценивался как в виде монотерапии, так и в составе комбинации с другими сахароснижающими препаратами на разных этапах лечения. В общей сложности в исследованиях приняли участие порядка 6000 пациентов с СД 2 типа, 51% из них мужчины. 3136 больных получали дулаглутид. Средний возраст участников составил 56 лет. В возрасте 75 лет и старше было 2% пациентов. Средняя продолжительность СД 2 типа – восемь лет.
В исследованиях сравнивали терапию дулаглутидом с плацебо, метформином (МЕТ), ситаглиптином, эксенатидом (применяли два раза в день), лираглутидом и инсулином гларгин.
Продолжительность терапии составляла от 26 до 104 недель.
В качестве основного критерия эффективности во всех исследованиях выбрано изменение исходного уровня HbA1c в первичной временной точке (26 или 52 недели). Кроме того, оценивались изменение HbA1c от исходного уровня в финальной временной точке, доля пациентов, достигших целевых показателей HbA1c, изменение глюкозы плазмы натощак, динамика постпрандиальной гликемии, массы тела и других метаболических показателей [42, 43].
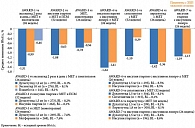
Для дулаглутида в дозе 1,5 мг среднее изменение НbА1с от исходного значения составило от -0,78% (AWARD-3) до -1,64% (AWARD-4) [43]. В исследованиях AWARD 1–5 дулаглутид продемонстрировал дозозависимую, достоверно большую эффективность по сравнению с метформином, ситаглиптином, эксенатидом, инсулином гларгин (в том числе в комбинации с прандиальным инсулином) и плацебо (рис. 5) [44–50].
Следует отметить устойчивый сахароснижающий эффект дулаглутида. В исследовании AWARD-5 статистически значимо большая эффективность дулаглутида по сравнению с эффективностью ситаглиптина сохранялась на протяжении 104 недель [49]. В исследовании AWARD-6 по сахароснижающему эффекту дулаглутид не уступал агонисту рецепторов ГПП-1 лираглутиду в дозе 1,8 мг. Средняя разница значений HbA1c между группами – -0,06% (-1,42 и -1,36% в группе дулаглутида и лираглутида соответственно (p < 0,0001)). Оба препарата применяли с метформином [45].
Достоверно больший процент пациентов достиг целевого уровня HbA1c по сравнению с больными, получавшими активные препараты сравнения. Таковых в группе дулаглутида было от 53% (AWARD-2) до 78% (AWARD-1) [43]. При сравнении дулаглутида с лираглутидом различий в данном показателе не зафиксировано – 68% пациентов в обеих группах. Аналогичная тенденция наблюдалась в отношении достижения уровня HbA1c ≤ 6,5% [45].
Снижение частоты гипогликемических эпизодов является ключевым в управлении СД 2 типа. По распространенности и частоте гипогликемий применение дулаглутида 1,5 мг/нед было сопоставимо с терапией метформином, ситаглиптином, лираглутидом, но более безопасным, чем использование базального инсулина в составе разных схем лечения [43]. Частота задокументированных случаев симптоматической гипогликемии при применении дулаглутида в дозе 1,5 или 0,75 мг и инсулина гларгин составила 1,67, 1,67 и 3,02 эпизода/пациент/год соответственно [46]. В исследовании AWARD-6 получены данные о том, что частота задокументированной симптоматической гипогликемии при применении дулаглутида составила 0,12 эпизода/пациент/год, лираглутида – 0,29 эпизода/пациент/год [45]. Случаев тяжелой гипогликемии при применении дулаглутида не наблюдалось [43].
Применение дулаглутида в дозе 1,5 мг сопровождалось достоверным и стойким снижением массы тела – до 3 кг, в том числе в течение самого длительного периода наблюдения (104 недели) [43]. В большинстве исследований снижение массы тела на фоне дулаглутида было большим по сравнению с ситаглиптином и инсулином гларгин либо сопоставимым с препаратами сравнения [44, 46–50]. При сравнении дулаглутида с лираглутидом установлено, что в первом случае масса тела уменьшилась на 2,90 кг, во втором – на 3,61 кг [45].
Распространенность нежелательных явлений, зарегистрированных в исследованиях AWARD, в группах дулаглутида была сопоставима с таковой в группах эксенатида, метформина, ситаглиптина и лираглутида. Наиболее частыми были реакции со стороны желудочно-кишечного тракта (тошнота, рвота), которые как правило носили временный характер [43].
Персонализированный подход к выбору сахароснижающих препаратов
За последнее время принципы лечения пациентов с СД 2 типа претерпели существенные изменения, поводом для этого послужили результаты ряда крупных рандомизированных клинических исследований (EMPA-REG, DECLARE-TIMI 58, LEADER, SUSTAIN-6, EXSCEL и др.).
В последних алгоритмах Российской ассоциации эндокринологов подчеркнуто, что индивидуальный подход к каждому пациенту является приоритетным при выборе тактики лечения [36].
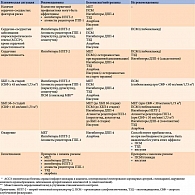
Для клиницистов важно учитывать, что в определенных клинических ситуациях (наличие АССЗ и их факторов риска, хронической сердечной недостаточности, хронической болезни почек (ХБП), ожирения, риска гипогликемий) некоторые классы сахароснижающих препаратов имеют доказанные преимущества (табл. 2).
Предпочтение следует отдавать сахароснижающим препаратам, эффективность и безопасность которых доказаны в крупных исследованиях в разных клинических ситуациях.
В клинических исследованиях, посвященных оценке сердечно-сосудистой безопасности агонистов рецепторов ГПП-1, были продемонстрированы впечатляющие результаты в отношении улучшения сердечно-сосудистого прогноза, преимущественно у пациентов с установленными АССЗ, что, по-видимому, обусловлено способностью препятствовать прогрессированию атеросклеротических изменений сосудов. Данные исследования охватывали как пациентов с предыдущим опытом ССЗ (ELIXA, Harmony Outcomes), так и больных, у которых распространенность сердечно-сосудистой патологии варьировалась от 73 до 83% в зависимости от исследования (LEADER, SUSTAIN-6, EXSCEL). Медиана наблюдения составляла 1,6–3,8 года [34].
Исследование REWIND
Улучшение прогноза в отношении сердечно-сосудистых осложнений на фоне приема сахароснижающих препаратов крайне важно для разных популяций пациентов с СД 2 типа, как с сердечно-сосудистыми факторами риска, так и с верифицированными ССЗ. Поэтому особого внимания заслуживает крупномасштабное исследование REWIND, в котором дулаглутид назначали в дополнение к стандартной терапии СД 2 типа [51]. Медиана длительности наблюдения составила 5,4 года. Важно подчеркнуть, что это самое длительное в истории агонистов рецепторов ГПП-1 клиническое исследование [34].
Результаты данного исследования стали основанием рекомендовать включение агонистов рецепторов ГПП-1 в состав терапии у пациентов с СД 2 типа и сердечно-сосудистыми факторами риска с целью получения дополнительных преимуществ в отношении жизненного прогноза.
Первичная конечная точка исследования включала нефатальный инфаркт миокарда, нефатальный инсульт и смерть от сердечно-сосудистых или неизвестных причин (3Р-МАСЕ).
Всего в исследование был включен 9901 пациент с СД 2 типа (46,3% женщины) из 371 клиники 24 стран мира. Отличительная черта исследования REWIND – участие широкой популяции пациентов.
Средний возраст больных – 66,2 ± 6,5 года. Средняя продолжительность СД 2 типа на момент включения в исследование – около десяти лет. Исходный уровень HbA1c составлял 7,3%.
У 70% больных были отмечены факторы риска развития АССЗ. У каждого третьего участника АССЗ подтверждены.
Более трети пациентов на момент включения в исследование имели альбуминурию, менее 10% – макроальбуминурию.
Результаты исследования REWIND свидетельствуют, что пациенты с СД 2 типа, получавшие дулаглутид, имели лучший отдаленный прогноз по сравнению с не получавшими такого лечения. Дулаглутид в отличие от плацебо на 12% снижал частоту достижения первичной комбинированной конечной точки. На фоне терапии дулаглутидом частота 3Р-МАСЕ составила 2,4 на 100 пациенто-лет, плацебо – 2,7 на 100 пациенто-лет. Отношение шансов (ОШ) 0,88 при 95%-ном доверительном интервале (ДИ) 0,79–0,99 (p = 0,026). Общее снижение частоты больших сердечно-сосудистых исходов наблюдалось преимущественно за счет нефатального инсульта (ОШ 0,76 (95% ДИ 061–0,95); p = 0,017). При этом эффект дулаглутида в отношении профилактики сердечно-сосудистого риска отмечался после медианного периода наблюдения 5,4 года. Смертность от всех причин между группами достоверно не различалась – 10,8% в группе дулаглутида и 12,0% в группе плацебо (ОШ 0,90 (95% ДИ 0,80–1,01); p = 0,067). Подгрупповой анализ показал, что эффект дулаглутида был одинаковым независимо от того, были у пациентов установленные АССЗ или имели место только факторы риска их развития [51].
На фоне применения дулаглутида также продемонстрировано улучшение прогноза в отношении микрососудистых осложнений. Так, в группе дулаглутида по сравнению с группой плацебо их частота составила 3,8 против 4,3 на 100 пациенто-лет соответственно, что дало снижение риска на 13%. Подобная разница обусловлена меньшим количеством композитных почечных исходов, отражающих меньшее ухудшение ренальных функций в группе дулаглутида, – 3,5 и 4,1 на 100 пациенто-лет соответственно (ОШ 0,85 (95% ДИ 0,77–0,93)).
Согласно полученным данным, применение дулаглутида положительно влияло на функцию почек. При этом эффект был наиболее выраженным в отношении развития макроальбуминурии.
Частота ретинопатии за время наблюдения не изменилась.
Побочные эффекты отмечались преимущественно со стороны желудочно-кишечного тракта.
В целом профиль безопасности дулаглутида соответствовал профилю безопасности препаратов группы агонистов рецепторов ГПП-1.
В исследовании REWIND было доказано, что применение дулаглутида снижает риск сердечно-сосудистых осложнений у пациентов с СД 2 типа даже при наличии факторов риска развития ССЗ, обусловленных атеросклерозом.
В сентябре 2019 г., исходя из результатов исследования REWIND, Комитет по лекарственным препаратам для медицинского применения Европейского агентства лекарственных средств рекомендовал включить в инструкцию препарата информацию о снижении риска MACE.
Заключение
Уже накоплен более чем десятилетний опыт успешного применения агонистов рецепторов ГПП-1 в клинической практике. Помимо предсказуемого сахароснижающего эффекта этот класс препаратов привлекателен с позиции улучшения сердечно-сосудистого прогноза. Результаты исследования REWIND позволили упрочить доказательную базу в отношении агонистов рецепторов ГПП-1. Применение дулаглутида позволило снизить риск развития неблагоприятных сердечно-сосудистых событий у пациентов с СД 2 типа как с подтвержденными атеросклеротическими заболеваниями, так и с факторами риска развития таковых. Следовательно, дулаглутид помогает решать задачи первичной и вторичной профилактики ССЗ.
E.V. Biryukova, MD, PhD, Prof., I.V. Solovyova
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Elena V. Biryukova, lena@obsudim.ru
The article is devoted to the actual problem of the medicine – the treatment of type 2 diabetes mellitus (DM). In recent years, the possibilities of therapy have significantly expanded due to the emergence of innovative classes of sugar-lowering drugs.
It is known that patients with type 2 diabetes have a high risk of cardiovascular diseases development. To prevent atherosclerotic vascular complications, not only glycemia, but also other risk factors should be monitored. In particular, in type 2 diabetes, the effectiveness of endogenous incretins is reduced. It was found that glucagon-like peptide 1 (GPP-1) is one of the strongest stimulators of insulin secretion. In addition, it has protective and modulating cardiovascular effects.
Dulaglutide is an agonist of GPP-1 receptors, which hypoglycemic effect is realized through the incretin system. Drugs of this group affect many pathogenetic mechanisms of type 2 diabetes and have a high safety profile. The obvious dulaglutide advantage is the simplicity of its application – once a week.
The effectiveness and safety of dulaglutide was confirmed in the series of randomized clinical trials of phase III AWARD – both as monotherapy and in combination with other hypoglycemic drugs at different stages of therapy. Totally 6000 patients with type 2 diabetes participated in these studies.
The evidence base for the effectiveness and safety of dulaglutide is constantly expanding. The results of the REWIND study on the cardiovascular safety of the drug may be of special interest.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.